日本大百科全書(ニッポニカ) 「ボラン」の意味・わかりやすい解説
ボラン
ぼらん
borane
水素化ホウ素の最小単位BH3およびそのアルキルあるいはアリール誘導体(トリメチルボランB(CH3)3など)をいう。また各種水素化ホウ素BmHnの総称としてボラン類を単にボランということもある。ボラン類の名称はBmHnのmとnをとってmボラン(n)のようによぶ。たとえばB2H6はジボラン(6)である(データノート参照)。
1912年、ドイツのストックAlfred Stock(1876―1946)らの研究により、ホウ化マグネシウムMgB2に酸を反応させると各種のボランが得られることがわかり、それ以降各種の水素化ホウ素がつくられ、またさらにそれらから生ずる陰イオンの塩あるいはBHをCHに置換したカルバボランや複雑な各種ボラン誘導体がつくられ、膨大な研究分野が広がっている。
ボラン類にみられる特徴は、その特異的な結合方式であって、通常の2原子間での2電子による単結合のB-Hのほかに、三つの原子間を2電子によって結び付けるいわゆる三中心二電子結合が存在することである(これによって生ずる化合物を電子不足化合物といっている)。次のような結合がみられる。
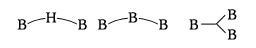
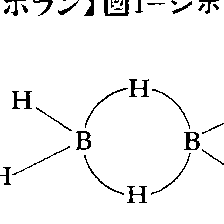
たとえば、ジボラン(6)ではのように同一平面上にH2B-BH2が存在し、それに垂直な面内に二つのHが位置して二つのBをB-H-Bの三中心二電子結合でつないでいる。
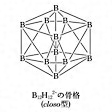
このような特異な結合方式のため、mの値が大きくなった中性分子あるいはイオンの構造には特異的なものがみられる。たとえばcloso(クロソ。閉じたという意)型とよぶものにはBmHn2-(m=nで、m=6、7、8、9、10、11、12などがある)があり、それぞれm個の頂点を有する閉多面体をつくっている。たとえばB12H122-ではのような骨格の二十面体が存在する(各BはBHでありHは省略してある)。
またcloso型の一つの頂点を欠いたものはnido(ニド。鳥の巣のようなものの意)型とよばれ、B5H9、B6H10、B8H12、B10H14、B11H132-などがそうである。また二つの頂点を欠いたものはarachno(アラクノ。くもの巣のようなものの意)型、それ以上をhypho(ハイフォ。網のようなものの意)型、単位が二つつながったものをconjuncto(コンジャンクト。つながるの意)型といっている。arachno型にはB4H10、B5H11、B9H15、B10H142-などがある()。
[中原勝儼]
ジボラン(6)
B2H6。古くはホウ化マグネシウムMgB2に酸を反応させて得ていたが、現在ではテトラヒドロホウ酸ナトリウムNaBH4にフルオロリン酸H2PO3Fを反応させるか、塩化水銀(Ⅰ)Hg2Cl2をジグライム中で反応させて得ている。
2NaBH4+Hg2Cl2
―→B2H6+H2+2NaCl+2Hg
無色で芳香に近い特異臭のある気体。40~50℃で着火し、空気中では自然に発火しやすい。有機溶媒に溶ける。光照射で各種のボラン類を生成する。水では分解して水素を発生し、ホウ酸を生成する。半導体製造、ロケット燃料などに用いられる。毒性が強い。
[中原勝儼]
テトラボラン(10)
B4H10。ジボランの熱分解によって得られる無色の液体ないし気体。比重0.56(-35℃)、0.70(結晶)。不快臭がある。ベンゼン、二硫化炭素に溶ける。水ではゆっくりと分解してホウ酸を生成する。構造はのようである。
[中原勝儼]
ペンタボラン
ペンタボラン(9) B5H9とペンタボラン(11) B5H11が普通に知られている。B5H9はB2H6と水素を熱して得られる無色の液体。のようなnido型の構造である。B5H11はB2H6とB4H10とを反応させて得られる無色の液体。のようなarachno型である。
[中原勝儼]
デカボラン(14)
B10H14。ジボランの熱分解によって得られる無色の結晶。nido型でのような構造。比重0.92(99℃)。有機溶媒に溶ける。
ボランはいずれも有毒。燃焼熱が大きいのでロケット燃料などへの応用が考えられている。有機合成試薬として利用される。
[中原勝儼]
ジボランの構造〔図A〕
クロソ型ボランの構造〔図B〕
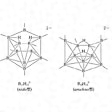
ニド型とアラクノ型ボランの構造〔図C〕
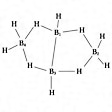
テトラボランの構造〔図D〕
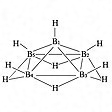
ペンタボラン(9)の構造〔図E〕
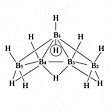
ペンタボラン(11)の構造〔図F〕
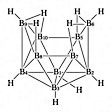
デカボランの構造〔図G〕
ボラン(データノート)
ぼらんでーたのーと
ジボラン(6)
化学式 B2H6
融点(℃) -164.85
沸点(℃) -92.39
テトラボラン(10)
化学式 B4H10
融点(℃) -120.0
沸点(℃) 18
ペンタボラン(9)
化学式 B5H9
融点(℃) -46.8
沸点(℃) 60
ペンタボラン(11)
化学式 B5H11
融点(℃) -122
沸点(℃) 65
ヘキサボラン(10)
化学式 B6H10
融点(℃) -62.3
沸点(℃) 108
ヘキサボラン(12)
化学式 B6H12
融点(℃) -82.3
沸点(℃) 80~90
デカボラン(14)
化学式 B10H14
融点(℃) 99.5
沸点(℃) 213
テトラデカボラン(18)
化学式 B14H18
テトラデカボラン(20)
化学式 B14H20
イコサボラン(16)
化学式 B20H16
融点(℃) 196~199
化学辞典 第2版 「ボラン」の解説
ボラン
ボラン
borane
【Ⅰ】単核の水素化ホウ素BH3のこと.ただし,BH3は安定なものは得られていない.しかし,その誘導体,たとえばB(CH3)3,B(C6H5)3,BCl2C2H5などは安定で,これらを含めることもある.【Ⅱ】複数のBを含む水素化ホウ素の総称.中性のBmHnは,特異のクラスター構造のものが多い.異性体も含めて,現在約35種類が確認されている.さらにこれらのHをハロゲンや有機基で置換した各種の誘導体も含めることがある.このほかに,BmHnp-型の陰イオンや,それを含む塩も存在する.【Ⅲ】BmHnクラスターのBの一部を他種の原子で置換した化合物(ヘテロボラン).広義のボラン類には,Bの一部をCで置換したもの(カルバボラン),Bの一部をC以外の非金属元素で置換したもの(たとえば,アザボラン(N),ホスファボラン(P),チアボラン(S)など),Bの一部を金属で置換したものを(メタラボラン)などがある.このほか,ボランまたはその陰イオンを配位子とした金属錯体なども含めることもある.また,カルバボランのBを金属で置換したメタラカルバボラン,ほかの元素で置換したボランのBを金属で置換したメタラヘテロボランなどもある.
これらのボラン類は,特異な構造をもち,その研究は金属クラスターなど類似化合物の研究開発に貢献している.その合成と結合の研究は,1910年,A. Stockによってはじめられ,かれとその共同研究者によって,BmHn(n = 2,4,5,6,10)などが得られた.また,ボラン類の構造と結合に関する研究では,1976年にW.N. Lipscomb(リプスコム)がノーベル化学賞を受賞している.ボラン類は,炭化水素に比べて質量当たりの燃焼熱が大きいことで,ロケットなどの燃料として注目を集めたため,製造も工業化され,研究も加速された.クラスター型のBmHnは,特異な構造をもち,B数mからはH数nは一意的には決まらない.その構造はウェイド則で説明される.したがって,名称は前に構造の種類を付し,後に(n)で水素数を付すのが普通である(たとえば,nido-ペンタボラン(9)).構造の記号を以下に記す.
(1)面が三角形のみからなる三角形多面体型(たとえば,正八面体)の全頂点にBが位置した構造のものをcloso-(ラテン語の“閉じた”の意味)で示す.ただし,この構造のものはボランでは [BnHn]2- のみである.カルバボランなどには中性のものもある.ウェイド則によれば,この構造の骨格結合には,頂点数nに対してn + 1対の結合電子対が使用される.
(2)closo-型から1個の頂点Bがとれた形のものを,nido-(ラテン語の“鳥の巣”の意味)で示す.分子式BnHn+4で,n + 2対の骨格結合電子対をもつ(たとえば,nido-ペンタボラン(9)).
(3)closo-型から2個の頂点Bがとれた形のものをarachno-(ギリシア語で,“くもの巣”の意味)で示す.分子式BnHn+6で,n + 3対の骨格結合電子対をもつ(たとえば,arachno-テトラボラン(10)).
(4)さらに,closo-型から,頂点Bが3個とれた形のものをhypho-(ギリシア語で“織る”の意味),4個とれた形のものを,klado-(ギリシア語で“技”の意味)で示す.これらは誘導体でみられる.これらの関係の一例を図に示す.
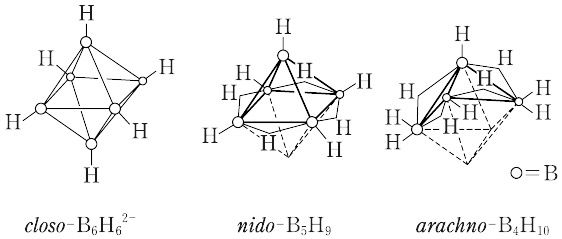
(5)閉じた骨格が2個,両方の1頂点のB間が結合したダンベル型のものを,conjuncto-で示す.たとえば,conjuncto-1,-1-デカボラン(16)は,2個の四角すい型のB5H8の頂点B間が結合した形である.n≧12の大きな分子のボランの多くはこうしたconjuncto-型である.

B2H6は,NaBH4とBF3,またはLiAlH4とBCl3との反応などで得られる.高次ボランの合成は,以前はB2H6などの高温熱分解が工業的にも行われた.しかし,いまは金属テトラヒドロホウ酸塩の合成が容易になったので,それを原料として常温や低温で収量よくつくられている.構造は,特異のかご形のオリゴマー構造で,結合は普通のB-B,B-Hのほかに,二電子三原子結合,B…H…Bなどを含む.とくにB数mの小さいものは活性であるが,B2H6,B5H9,B6H10などは25 ℃ で密閉器中では安定である.B5H9,B10H14などは約150 ℃ まで分解しない.B4H10,B5H11,B8H12などは,密閉器中室温でも不安定である.空気中では酸化されやすいものが多く,空気に触れるとB2H6は爆発的に反応し,B5H9,B5H11などもすぐに発火する.B6H10などは反応が遅く,B10H14などは空気中でも安定である.さらにB数のm > 12のものの多くは,固体であり空気中でも安定である.いずれも酸素との反応性は大きく,同質量の炭化水素より燃焼時の発熱量が大きい.多くのボランは,ブレンステッド酸としてはたらき,ルイス塩基とは付加化合物をつくる.アルケンとは,付加反応を起こす.
例:CH3CH=CH2 + B2H6 → CH3CH2CH2BH2,
(CH3CH2CH2)2BH,(CH3CH2CH2)3B
また,金属錯体とメタラボランを,アルキンとカルボランをつくる.ロケットの燃料,高次ボラン,カルバボラン,メタラボラン,有機ボランなどの製造原料,有機合成などの試薬(ハイドロホウ素化,還元剤など)などに用いられる.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
改訂新版 世界大百科事典 「ボラン」の意味・わかりやすい解説
ボラン
borane
水素化ホウ素の総称。1912年にストックA.Stockが初めて信頼に値するボランを合成し,さらに引き続いて行った研究の集大成を33年に出版した。それ以後ボランの化学は著しく進歩し,とくに近年有機化学の炭素の化学に匹敵する共有性化合物の新しい領域として顕著な発展を遂げ,さらに今後の進展も大いに期待されている。その特徴は,(1)多面体クラスター構造をつくること,(2)三中心結合など結合理論の新しい発展をうながした結合をもつ化合物に富むこと,(3)多様な反応性があり,合成化学への寄与が大であること,などである。化合物の命名法は明確に決まっているが,組成を表すには,分子中のホウ素原子の数をラテン語の接頭語とし,水素原子の数を括弧に入れたアラビア数字で語尾につける。たとえば,B5H9=ペンタボラン(9),B10H14=デカボラン(14)のように表す。特徴的な三中心結合は下式のように表される。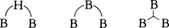
ふつうの共有結合は,一つの結合について共有電子2個が関与するのに対して,これら3種の結合では,それぞれの系全体について,電子が2個しか関与していない。この種の結合を三中心二電子結合という。ボランの種類はきわめて多く,一般に有害である。ボラン類の構造中にあるいくつかのBHをCHで置換したものをつくることができる。これらを一般にカルボランcarboraneという。B10C2H12,B5CH9,B4C2H8などがこれに属する。
ジボランdiborane
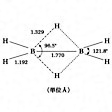
化学式B2H6。単量体BH3の形では単離することができない。構造は2個の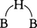 三中心結合を有する(図1)。両端の水素原子と2個のホウ素原子は同一平面上にあり,橋架けの2個の水素原子はこの平面と直交する面上に存在する。B-B間距離は177pmである。無色の気体で,不快臭を有する。沸点180.6K(1気圧),融点108.3K。沸点における液体の比重0.4282。エーテル中において三フッ化ホウ素BF3のテトラヒドロホウ酸リチウムLiBH4による還元でつくられる。
三中心結合を有する(図1)。両端の水素原子と2個のホウ素原子は同一平面上にあり,橋架けの2個の水素原子はこの平面と直交する面上に存在する。B-B間距離は177pmである。無色の気体で,不快臭を有する。沸点180.6K(1気圧),融点108.3K。沸点における液体の比重0.4282。エーテル中において三フッ化ホウ素BF3のテトラヒドロホウ酸リチウムLiBH4による還元でつくられる。
3LiBH4+BF3─→2B2H6+3LiF
室温では酸素中でも安定で,引火点130~135℃。空気中の引火点は145~150℃,110℃以上で徐々に反応する。燃焼熱がきわめて大きく,燃料,推進火薬などへの用途が研究されている。肺機能に障害を与え,めまい,嘔吐感,頭痛を起こす。
ペンタボラン(9)pentaborane(9)
化学式B5H9。融点-46.8℃,沸点60.0℃。きわめて反応性が強い揮発性液体である。構造は5個のB原子が底面が四角形のピラミッド状をなし,それぞれが末端水素原子をもっている。また4個の水素原子は橋架け構造をつくる(図2)。ジボランの熱分解によって合成する。水とは溶け合わず,また反応もゆっくり進行する。空気に触れると自然発火し,条件によっては爆発する。刺激的なニンニクに似たにおいがあり,ジボランよりさらに危険度が高い。神経中枢に障害を与え,頭痛,めまい,痙攣(けいれん),記憶障害などを起こす。
デカボラン(14)decaborane(14)
化学式B10H14。12個のB原子がつくる二十面体から2個のB原子が欠けた構造をしている。各B原子は末端水素原子をもち,また4個のH原子が橋架け構造をとっている。これはB-H-B結合を4個,B-B-B結合を6個もっている。無色の揮発性固体。不快なカビ臭いにおいをもつ。融点99.5℃,沸点213℃。液体の比重0.78(100℃),固体の比重0.92(99℃)。室温では空気に対し安定であるが,酸素とは100℃で爆発する。プロトン引抜き,置換,付加等,多種多様な反応をする。毒性はペンタボラン(9)よりやや弱いが,吸入以外に皮膚からの吸収もあり,腎臓,目,神経系に対して著しい障害作用がある。
執筆者:水町 邦彦
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
百科事典マイペディア 「ボラン」の意味・わかりやすい解説
ボラン
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「ボラン」の意味・わかりやすい解説
ボラン
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
世界大百科事典(旧版)内のボランの言及
【ホウ素化学(硼素化学)】より
…ホウ素の結晶は,B12による三角二十面体がつながったものである。これはホウ化物にもみられるが,最も特異的なのは水素化物すなわちボラン類である。B12H122-は三角二十面体のB12にすべてHのついたかご形構造であり,それらのいくつかのBHがとれた構造もあるし,またBHの代りに等電子構造のCHの入ったBn-2C2Hnのようなカルボラン類もある。…
※「ボラン」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...