同位体効果 (どういたいこうか)
isotope effect
同位体の質量の相違によって起こる物理的・化学的効果。効果は原子番号の小さい元素が関与するほど著しい。たとえば結合の伸縮振動数は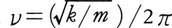 (kは結合伸縮の力の定数,mは質量)であるから,ν(C-H)は約3000cm⁻1であるのに対し,ν(C-D)は約2200cm⁻1である。同位体効果は気体の拡散,遠心分離,電磁場内でのイオンの移動などに現れる。235UF6と238UF6の分離はこの最も重要な応用例である。同位体の分離・濃縮のほとんどは,この種の物理的同位体効果を利用している。
(kは結合伸縮の力の定数,mは質量)であるから,ν(C-H)は約3000cm⁻1であるのに対し,ν(C-D)は約2200cm⁻1である。同位体効果は気体の拡散,遠心分離,電磁場内でのイオンの移動などに現れる。235UF6と238UF6の分離はこの最も重要な応用例である。同位体の分離・濃縮のほとんどは,この種の物理的同位体効果を利用している。
速度論的同位体効果
化学反応速度に及ぼす同位体効果は,k(軽原子)/k(重原子)(たとえばkH/kD。kH,kDは各同位体異性体の反応速度)で定義される。多くの場合,同位体効果は1より大きい(正常同位体効果)が,比が1より小さい逆同位体効果もある。同位体置換が反応に際して生成・切断される結合になされているときの効果を一次同位体効果,そうでない場合を二次同位体効果という。速度論的同位体効果は,律速段階に関与する物質,たとえば活性錯合体において問題としている結合の振動数の質量による差に由来すると考えられる。このためkH/kDは2~7の間に入る。たとえば次のトルエンのラジカル臭素化(Z=HまたはD)
C6H5CH2Z+Br・─→C6H5CH2Br+Z・
ではkH/kDは4.6である。二次同位体効果はkH/kDの場合0.6~2である。臭化イソプロピルの加水分解(Z=HまたはD)
(CZ3)2CHBr+H2O─→(CZ3)2CHOH+HBr
においてkH/kDは1.34である。速度論的同位体効果から律速段階が同定されるため,反応機構の研究に広く用いられている。ただし予想できる反応速度比の極大値はkH/kD(=18),kH/kT(=60)の場合以外は小さく,たとえば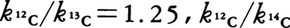
 であり,このため実験誤差との区別がしだいに難しくなってくる。
であり,このため実験誤差との区別がしだいに難しくなってくる。
執筆者:竹内 敬人
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
Sponserd by 
同位体効果
どういたいこうか
同位核効果ともいう。原子や分子で、ある原子核がその同位体(アイソトープ)に置き換わったときに生じる物理的・化学的性質の変化のこと。
同位体効果は一般に同位核間の質量の比が大きいほど大きい。たとえば重水素2個からできている水素分子の慣性モーメントは、通常の水素分子の2倍になり、それに伴って回転エネルギー準位の差は半分に減少する。振動エネルギー準位の間隔は重水素分子では、通常の分子の 1/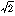 に減る。原子核を取り巻く電子の運動の状態はほとんど変わらず同位体効果は小さい。これは、もともと電子の質量が原子核の質量の数千分の1以下であり、電子の運動を考える際には近似的に原子核は静止していると考えられるからである。しかし、水素原子と重水素原子とでは、電子の換算質量が変わることがおもな原因になって、その電子スペクトルにもわずかながら差が生じる。
に減る。原子核を取り巻く電子の運動の状態はほとんど変わらず同位体効果は小さい。これは、もともと電子の質量が原子核の質量の数千分の1以下であり、電子の運動を考える際には近似的に原子核は静止していると考えられるからである。しかし、水素原子と重水素原子とでは、電子の換算質量が変わることがおもな原因になって、その電子スペクトルにもわずかながら差が生じる。
そのほか、気体の拡散やイオンの易動度などにも同位体効果が現れ、これらは同位体の分離に利用されることがある。化学反応にも同位体効果が現れることがある。たとえば、
Si+H2O→SiO+H2(または2H)
という反応は、相手がD2O(Dは重水素)だとおこりがたい。この原因はまだ明確にされていないが、ポテンシャル障壁をくぐり抜ける量子効果の大きさが質量によって大きく変化することが関係しているという説もある。
[大野公男]
出典 小学館 日本大百科全書(ニッポニカ)日本大百科全書(ニッポニカ)について 情報 | 凡例
Sponserd by 
どういたいこうか
同位体効果
isotope effect
ある化合物の構成元素の同位体を置換することによって得られる,同位体化合物(例えばH216OとH218O)の間の化学的・物理的性質の差およびこれに起因する現象。例えば,H216Oの蒸気圧は25℃でH218Oのそれより約0.6%高い。室温における硫酸還元バクテリアによる32SO42-の還元速度は34SO42-のそれより約2%大きい。この結果発生するH2Sまたはこれに由来する硫化物鉱物は32Sに富んだ特徴的な同位体存在比の分布を示し,マグマ性・熱水性鉱床の硫黄と区別されることが多い。反応速度の差に伴う同位体効果を運動論的同位体効果(kinetic iso-tope effect)と称し,広義の同位体効果と区別することもある。
執筆者:酒井 均
出典 平凡社「最新 地学事典」最新 地学事典について 情報
Sponserd by 
同位体効果
ドウイタイコウカ
isotope effect
分子内の原子を同位体で置換したとき,同位体の質量数,核スピン,核の大きさや形が違うことが原因で,その分子が関与する物理的・化学的挙動に差が生じる現象.質量数の差に起因する同位体効果を質量効果といい,核の体積,形,電荷分布が異なるために核外電子に影響して生じる効果を体積効果あるいは場効果という.質量効果は原子番号の小さい元素ほど大きく現れ,水素の同位体でもっとも大きい.体積効果は逆にウランなど原子番号の大きな元素で大きく現れる.同位体効果は,気体の拡散,遠心分離,蒸留,気化,電磁場内でのイオンの運動などの物理的挙動に現れるが,錯体形成反応,イオン交換反応,加水分解,酸化還元,電気分解反応などの化学反応の速度定数や平衡定数にも現れる.また,分子分光が対象とする回転スペクトル,振動スペクトル,電子スペクトルにおける同位体効果は,同位体の存在比を知るのには便利である.同位体効果を利用して,いろいろな同位体分離が工業的にも行われている.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
Sponserd by 
同位体効果
どういたいこうか
isotope effect
同位体 (アイソトープ ) の質量の違いによって生じる物理的,化学的効果。同位体の質量比が問題になるため,この効果は原子番号の小さい元素ほど著しく,水素において最大である。分子の化学的組成は変らないが,そのなかのいくつかの原子を同位体で置き換えると,気体の拡散,発光スペクトルの振動数や強度,超伝導への転移温度,化学反応速度など物理的,化学的性質が少し変化する。この効果は,物理・化学現象の機構の研究や同位体の分離などに利用される。最初の原子爆弾の製造では,天然ウランから主成分のウラン 238と微量成分のウラン 235を分離するのに,気体である六フッ化ウランの拡散速度が,含まれるウラン同位体によってわずかに違うことを利用した拡散法 (ガス拡散法 ) が用いられた。しかし,ウラン 238とウラン 235の質量比は小さいので,膨大な拡散装置が必要であった。
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
Sponserd by 
同位体効果
通常,同位体をトレーサーとして用いるときは,質量差など同位体であるがゆえの違いの影響はないものと仮定するが,この前提がくずれる例.
出典 朝倉書店栄養・生化学辞典について 情報
Sponserd by 
法則の辞典
「同位体効果」の解説
出典 朝倉書店法則の辞典について 情報
Sponserd by 
世界大百科事典(旧版)内の同位体効果の言及
【超微細構造】より
…物性物理学や化学において磁気共鳴吸収の超微細構造は,固体や分子内の電子の電荷やスピンの分布を知るための有力な研究手段を提供する。 超微細構造としては上記のほかに,質量数の異なる原子核が混在することによって起こる同位体効果も知られている。これは原理的にはスピン0の原子核でも起こりうるが,同位体の分離によって除かれる。…
【同位体】より
…これに対し,元素としては異なるものであっても質量数の同じ原子もあるわけで,そのような場合は[同重体]といっている。 分子内の原子をその同位体で置換したとき,各種の化学的あるいは物理的な性質に違いが生じてくることを[同位体効果]という。同位体は原子番号が同じ原子で,化学的性質はほとんど変りがないので,通常の化学反応では同位体効果はほとんどみられず,加水分解,イオン交換,酸化・還元,電気分解などでわずかな違いがみられるにすぎないが,気体の拡散,遠心分離,蒸留,電磁場内でのイオンの運動などの物理的挙動での効果はかなりな程度みられる。…
【同位体分離】より
…同位体は原子炉やトレーサー,科学実験などで使用されており,たとえば原子炉の燃料としての[ウラン濃縮]は同位体分離のよく知られている例である。 同位体分離は,同位体効果と呼ばれる同位体の質量数の差に基づくわずかな物理的または化学的な性質の相違を利用して行われる。以下にその代表的な例を述べる。…
※「同位体効果」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
Sponserd by 
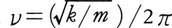 (kは結合伸縮の力の定数,mは質量)であるから,ν(C-H)は約3000cm⁻1であるのに対し,ν(C-D)は約2200cm⁻1である。同位体効果は気体の拡散,遠心分離,電磁場内でのイオンの移動などに現れる。235UF6と238UF6の分離はこの最も重要な応用例である。同位体の分離・濃縮のほとんどは,この種の物理的同位体効果を利用している。
(kは結合伸縮の力の定数,mは質量)であるから,ν(C-H)は約3000cm⁻1であるのに対し,ν(C-D)は約2200cm⁻1である。同位体効果は気体の拡散,遠心分離,電磁場内でのイオンの移動などに現れる。235UF6と238UF6の分離はこの最も重要な応用例である。同位体の分離・濃縮のほとんどは,この種の物理的同位体効果を利用している。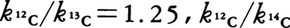
 であり,このため実験誤差との区別がしだいに難しくなってくる。
であり,このため実験誤差との区別がしだいに難しくなってくる。

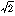 に減る。原子核を取り巻く電子の運動の状態はほとんど変わらず同位体効果は小さい。これは、もともと電子の質量が原子核の質量の数千分の1以下であり、電子の運動を考える際には近似的に原子核は静止していると考えられるからである。しかし、
に減る。原子核を取り巻く電子の運動の状態はほとんど変わらず同位体効果は小さい。これは、もともと電子の質量が原子核の質量の数千分の1以下であり、電子の運動を考える際には近似的に原子核は静止していると考えられるからである。しかし、