翻訳|isotope
精選版 日本国語大辞典 「アイソトープ」の意味・読み・例文・類語
日本大百科全書(ニッポニカ) 「アイソトープ」の意味・わかりやすい解説
アイソトープ
あいそとーぷ
isotope
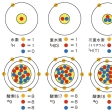
同じ化学元素に属しながら、質量数の異なる原子を、互いにアイソトープであるという。名称の由来はギリシア語のisos(同じ)とtopos(場所)からきている。同位体あるいは同位元素ともいう。原子の質量の大部分は原子核が占めている。原子核は、陽子と中性子とで構成されるから、質量数は、陽子数と中性子数の和で表される。原子番号(陽子の数を表す)と中性子数で区別される原子核のことを核種というが、アイソトープは、原子番号は等しいが、中性子の数が異なる核種どうしの関係を表す。たとえば、普通の水素(プロチウム)の原子核は1個の陽子のみからなるが、そのアイソトープである重水素(ジュウテリウム)は1個の陽子と1個の中性子からなる原子核を有し、三重水素(トリチウム)の原子核は1個の陽子と2個の中性子からなる。いずれも核外電子は1個しかないので、水素としての化学的性質は変わらない。なお、中性子数が等しく陽子数が異なる原子のことをアイソトーンisotoneといい、陽子数も中性子数も異なるが質量数の等しい原子をアイソバーisobar(同重体)という。
[市川富士夫]
アイソトープの発見
アイソトープという名称は1913年にイギリスの化学者ソディが命名したものである。1896年にベックレルがウランの放射線を発見して以来、1910年までに、放射線の種類と半減期および化学的性質によって区別される物質が40も発見されていた。これらの物質はいずれもウランまたはトリウムを最初の核種として放射性壊変を繰り返し、最終的には安定な鉛になることをアメリカのボルトウッドBertram Borden Boltwood(1870―1927)はみいだした。ウランから鉛までは周期表上で11の元素しかないのに、40の物質がそこに存在するという矛盾した現象を、ソディとファヤンスは、周期表上の同一の位置に異なる放射能的性質の物質が存在するためと考えた。これがアイソトープの概念の始まりである。その後、放射性鉱物中の鉛の原子量が鉱物により異なることがみいだされたが、これは、前述の最終生成物である安定な鉛が異なる質量数をもち、それらの混合比が鉱物中のウランやトリウムの含量により変わるためであると考えられた。つまり、アイソトープは非放射性の原子にも当てはまることがわかったのである。1912年トムソンは、ネオンが質量数20と22の2種類のものからなることを、電磁場でのそれらの回折からみいだし、両者の比を9対1と計算した。さらにアストンはガス拡散法でこれらを分離し、アイソトープの存在はここに実験的に証明された。
アイソトープの本来の定義と発見の経過は以上のとおりであるが、一般的にはアイソトープを核種と同じ意味に用いることが多い。核種は元素名の左上肩に質量数を付して表現する。たとえば、コバルト60は60Coと書く。しかし、なかにはトリチウム(T=水素3)やラジウムG(RaG=鉛206)のように特別の名称をもつものもある。
アイソトープは、放射能の有無と天然に存在するかどうかにより分類される。しかし、半減期の極端に長いものは安定同位体との区別がつけにくい。たとえば天然のビスマスである209Biは、従来安定同位体と考えられていたが、精密な研究により、半減期が1.9×1019年のα(アルファ)線を放出することがわかった。また、この分野の研究の進歩は著しいので、アイソトープの数は増える傾向にある。現在発見されている安定同位体は287、ラジオ・アイソトープ(RI。放射性同位体)は約2000である。安定同位体はすべて天然に存在する。一方、ラジオ・アイソトープのなかで、ウラン235、ウラン238、トリウム232、カリウム40など14種は、元素の生成以来存在すると考えられている。ウランとトリウムはその放射性壊変により一連のラジオ・アイソトープを伴うが、そのほかに、重い原子核の不安定さのために自然に原子核が分裂してできる自発核分裂生成物がきわめてわずかに存在する。天然にはこのほかに、宇宙線による核反応で生成したラジオ・アイソトープがある。トリチウムや炭素14がその例である。また、地球の生成初期には存在していたが、半減期が1000万年ぐらいのためにすでに死滅したと考えられるものがある。サマリウム146、鉛205、ウラン236、ネプツニウム237、プルトニウム244およびキュリウム247がそれである。これらは人工的には生成されている。また、核兵器の実験によって大量のラジオ・アイソトープが自然界に付加されているため、天然と人工の区別がむずかしくなっているものもある。たとえば、ヨウ素129は、約1570万年の半減期であるが、わずかながら天然に生成したものが存在し、これに、核実験や原発事故などによる人工のものが付加されている。
[市川富士夫]
アイソトープの安定性と存在比
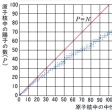
原子核は、陽子と中性子を偶数個含むか奇数個含むかにより、その安定性が異なる。安定同位体287個のうち、陽子、中性子とも偶数のものが168個、陽子は偶数で中性子は奇数のものが57個、反対に陽子は奇数で中性子は偶数のものが53個、どちらも奇数のものは9個である。元素別にみると、偶数の原子番号(陽子数)の元素には安定同位体が多いが、奇数のものには少ない。たとえば、安定同位体がいちばん多い元素は原子番号50のスズで、その数は10個であるが、原子番号49のインジウムは2個、原子番号51のアンチモンも2個しか安定同位体がない。なお、現在のところラジオ・アイソトープのいちばん多い元素はセシウムで、その数は30個以上である。これらのことは、陽子と陽子、中性子と中性子が原子核の中で対をつくって安定化する傾向により説明される。また、安定同位体の原子核中の中性子数(N)を横軸にとり、陽子数(P)を縦軸にとると、安定同位体の分布は、Pが増すにつれてP=Nの線よりもしだいにN過剰の方向にずれてゆくことがわかる。このことは、核の安定化のためには核子(陽子と中性子)間の核力が陽子間の電気的反発力を上回る必要があることを意味している。
天然物質中で、ある元素の同位体の混合比はほぼ一定であるが、厳密にいうと試料によってわずかに異なる。たとえば、トリウム鉱石中には鉛208が多く、ウラン鉱石中には鉛206が多い。これは、トリウムとウランの放射性壊変の最終生成物としての鉛の同位体が異なるためである。一方、軽い元素では、後に述べる同位体効果のために試料の出所や化学形による差がある。たとえば、酸素には質量数16~18の安定同位体があるが、酸素16に対する酸素18の比を精密に測定すると、河川水を基準にして、海水では約1%、大気中では2.5~3.5%、有機物では2~5%も変動する。炭素13に対する炭素12の比も89.3~93.5%まで変わる。
天然ウラン中のウラン235の存在比は通常0.72%であるが、この比が0.29%しかないウランが1972年にアフリカ、ガボン共和国のオクロ鉱山で発見された。種々の研究により、この同位体比の異常の原因は、オクロ地区で約17億年前に、天然の条件からウランの核分裂連鎖反応がおこったためであることがわかった。このような「天然原子炉」の存在の可能性は1956年(昭和31)に黒田和夫(1917―2001)により理論的に予見されていたものである。
[市川富士夫]
同位体効果と同位体交換反応
同じ元素に属するアイソトープは、本来その物理的、化学的性質が等しいはずであるが、実際には質量の差により、その挙動にわずかな違いを生ずる。この違いは軽い元素のアイソトープほど大きい。たとえば、通常の水は1気圧のもとで0℃で凍り、100℃で沸騰するが、純粋の重水のそれは3.81℃および101.42℃となる。このような同位体の性質や挙動の差を同位体効果という。同位体効果は、密度、気化熱、粘度、表面張力などにも現れる。発光スペクトルや吸収スペクトルも同位体効果によるスペクトルのずれを生ずる。同位体効果を利用して、同位体の検出、定量、分離が可能である。生物は軽い元素に対する同位体効果が大きく、たとえばクロレラは、水素よりも重水素、重水素よりも三重水素を濃縮する傾向がある。しかし、もし生物中のすべての水素を重水素で置換してしまうと、同位体効果により反応速度が低下し、反応の平衡も移動するので、その生物は生存不可能になるであろう。
同位体組成の異なる化合物を混合しておくと、その組成が等しくなる方向に同位体が入れ替わる。これを同位体交換という。たとえば、酸素16を含む二酸化炭素を、酸素18を含む水に吹き込むと、二酸化炭素の酸素の一つが酸素18と交換する。同位体交換反応の速度は温度に依存するので、海底に沈降した炭酸塩や貝の中の酸素の同位体比を測定することにより、それらの生成時の温度を推定することができる。
[市川富士夫]
アイソトープの分離・濃縮
個々のアイソトープは研究用にも産業用にも役にたつ。たとえば、重水素を含む水(重水)やウラン235は、原子力の分野で重要な物質である。しかし、同じ元素に属するアイソトープの分離は、元素どうしの分離に比べて著しく困難であり、一般に相当のエネルギーと経費を必要とする。同位体が最初に分離されたのは電磁的方法によるものであった。これは、質量分析と同じ原理で、同位体をイオン化して電界で加速し、これを磁界で曲げると、質量の異なる同位体が別々な焦点に集束するので完全な分離が行われる。この方法はアメリカで大掛りに開発され、オーク・リッジ国立研究所のカルトロンという装置では99.9%以上の純度の安定同位体の分離が盛んに行われた。同位体分離法を、選択的分離法と統計的分離法に区別することがあるが、電磁分離は前者の代表であろう。後者は同位体効果を反復利用して分離効率をあげるもので、分子レベルの統計的挙動の差に基づくのでこの名があるが、隔膜を通しての気体の拡散を用いるガス拡散法はその代表である。
これらは物理的方法に属するが、そのほかの物理的方法として、遠心分離法、熱拡散法、蒸留法、分子蒸留法などがある。これらに対して、化学的同位体効果を利用する方法も注目されており、電気分解法、イオン交換法、溶媒抽出法などがある。このほか、レーザー光による光化学反応の利用も検討されている。
高純度の同位体を得るには、いくつかの方法を組み合わせて用いる。たとえばカナダでは、通常の水に0.014%しか含まれていない重水を、同位体交換法で15%に濃縮し、蒸留法で90%にしたのち、電解法で99.97%まで高純度化している。基本的には、蒸留と電解の組合せが、今日の最新技術でも中心になっている。
[市川富士夫]
ラジオ・アイソトープの製造
アイソトープの利用の面では、ラジオ・アイソトープが大きな比重を占めている。ラジウムのように天然物質から分離するものもあるが、ラジオ・アイソトープの大部分は人工のものである。その製造は、試料(ターゲット)を原子炉やサイクロトロン等の粒子加速器で放射化して行う。その際、原子炉では中性子、加速器では陽子や重陽子などの荷電粒子による核反応がおこる。原子炉では、コバルト60のように、ターゲットのコバルト59のアイソトープが生成し、そのまま分離しないで用いる場合と、リン32のように、ターゲットの硫黄(いおう)と異なる元素を生成して化学分離するものとがある。前者は安定同位体と共存しているが、後者はラジオ・アイソトープが単独に存在する。原子炉ではこのほかにウランの核分裂で多数の放射性核種が生成するが、ストロンチウム90のように、この核分裂生成物から分離する場合もある。加速器ではほとんどの場合、ターゲットと異なる元素のラジオ・アイソトープができるので、化学分離を要する。同じ元素でも、使用目的によりラジオ・アイソトープの種類を選ぶ必要がある。たとえば、ナトリウムのラジオ・アイソトープにはナトリウム22と24があるが、半減期の短い点を重視するならば後者が適しており、安定同位体の共存を避けたいのなら前者を選べばよい。長寿命のラジオ・アイソトープは輸入も可能であるが、短寿命のものは製造と使用の時間間隔を短くする必要上、国産が望ましい。日本でも、日本原子力研究開発機構の原子炉などを使って製造されている。非常に短寿命の場合はそれでもまにあわず、ミルキングという方法を利用できる場合がある。たとえば、半減期が6時間のテクネチウム99m(mは、核エネルギーが励起状態(れいきじょうたい)にあることを表す)は、医学的診断や治療にしばしば用いられるが、運搬中や保存中に急激に減ってしまう。そこで、その親(放射性壊変する前の核種)にあたるモリブデン99をアルミナに吸着させたものを病院に供給し、病院は必要に応じてこれに食塩水を流してテクネチウムを分離して使用する。モリブデン99からはふたたびテクネチウムが蓄積してくるので、繰り返して利用できる。ちょうど牛から乳を絞るのに似ているのでミルキングと称している。さらに短寿命のものを使うために、病院に小型のサイクロトロンを設置する場合もある。なお、トリチウム、炭素14、硫黄35などのラジオ・アイソトープを分子内に含む化合物を標識化合物と称し、種々の目的に利用する。
[市川富士夫]
アイソトープの利用
アイソトープは工業、農業、医療など種々の分野で広く利用されている。その大部分は放射線およびトレーサーとしての利用である。
(1)考古学的利用と年代測定 アイソトープ本来のもつ性質を生かした方法として同位体比の応用がある。堆積岩(たいせきがん)や貝の化石中の酸素16と18の同位体比からそれらが生成した古代海水の温度を推定することができる。鉛の同位体には、質量数が204、206、207、208の4種があるが、このうち204以外の3種はウランやトリウムからつくられるもので、時間とともに増加する。しかし、ある時期に鉛がウランやトリウムから分離して鉱床をつくると、そこでこれら3種の同位体の増加はとまり、四つの同位体の比が固定される。したがって、鉛の産地により固有の同位体比をもつようになる。このことを利用して、日本に古くから伝えられている青銅鏡中の鉛の同位体比測定からその産地を推定し、青銅鏡が中国伝来か国産かを論ずる試みがなされている。また、同位体比は年代測定にも利用される。動植物の試料(化石、木材など)中の炭素14の量を測り、その試料が死んだ年代を数百年から数万年の範囲で決めることができる。1980年代以降、宇宙線の影響で岩石中に生成するベリリウム10とアルミニウム26の比から求める年代測定法を、人類学に利用する新しい試みがなされている。
(2)工業への利用 コバルト60やイリジウム192を密封線源(放射性物質を容器に密封し、外部を汚染することなく放射線を照射できる放射線源)とする非破壊検査が広く普及している。鋳物や溶接部の欠陥の発見、航空機エンジンの透過検査など応用範囲が広い。密封線源としては化学工業でも利用される。放射線による有機化合物の重合や共重合反応により、優れた性質のプラスチック類が生産されている。木材を基盤にした木質プラスチック、発泡ポリエチレンの改質、繊維に対する染色性、撥水(はっすい)性の付与などがその例である。小線源としては、厚み計、レベル計、密度計、水分計、煙探知器、静電気除去装置、地下検層計などに、種々のラジオ・アイソトープが用いられている。以前は夜光時計にラジウムが使われたが、1960年代以降はプロメチウム147やトリチウムが用いられてきた。また、心臓のペースメーカーや人工衛星の動力源として原子力電池が用いられたこともあるが、これらはプルトニウム238、プロメチウム147、ストロンチウム90などの放射線のエネルギーを電気に変換しているもので、作業員の放射線による障害のため、現在は禁止され、ペースメーカーにはリチウム電池、人工衛星には太陽電池が使用されている。また、夜光時計などには、硫化亜鉛系やアルミン酸ストロンチウム系の蓄光物質が使用されている。
トレーサーとしても広く利用されている。石油をパイプラインで輸送する際、製品の切り替え時にコバルト60などを含むカプセルを入れることにより、受液側は放射能によりそのタイミングを知ることができる。野外における調査にも、ラジオ・アイソトープをトレーサーとして用いることがある。亜鉛65、スカンジウム46などを含む人工砂を使い、苫小牧(とまこまい)、酒田、伊良湖(いらこ)岬などで漂砂移動の調査がなされた。しかし、野外での放射性物質の利用は短寿命のものに限られており、また無差別に広く散布などすべきではない。この点を補うものとして、アクチバブルトレーサーという考えが出された。これは、天然の存在量の小さい非放射性の元素をトレーサーとして用い、採取した試料を原子炉で放射化して分布や移動を調べる方法である。河川の流速の測定には臭素、水田に散布した農薬の分布調査やサケの回遊調査にユウロピウムが用いられている。
(3)農業、食品への利用 食品の長期保存のために、発芽防止や殺菌用の大放射線源としてラジオ・アイソトープが使用されている。照射した食品の安全性については、世界保健機関(WHO)、国際原子力機関(IAEA)などにより検討され、100万ラド以下の照射ではあらゆる食品が安全という結論が1980年に出された。日本では、ジャガイモ、米、かまぼこなど7品目について長期にわたる試験が行われてきた。現在のところ悪影響はみられないといわれているが、実用的には、発芽防止と長期保管の目的でジャガイモへの照射のみが北海道の士幌(しほろ)農協で、30万キュリーのコバルト60により大規模に行われている。害虫の駆除にもラジオ・アイソトープが利用されている。たとえば、果物の害虫であるメキシコミバエやチチュウカイミバエの雄に放射線を照射して不妊化したものを大量に放虫して繁殖を減らすのである。放射線による植物の品種改良もラジオ・アイソトープの利用の重要な分野である。コバルト60などを密封線源として、種子や苗を照射して突然変異をおこさせ、有用品種を固定する。日本でも茨城県常陸大宮(ひたちおおみや)市にある農林水産省の放射線育種場(ガンマフィールド)などで、農作物、草花、樹木などの品種改良がなされており、すでに水稲、コムギ、ダイズ、レタスなどで成功している。
(4)医学への利用 医学の分野では、診断におけるトレーサーとしての利用と、治療における放射線源としての利用がおもなものである。診断は、ラジオ・アイソトープで標識した医薬品を体内に入れ、血液、尿、便などを採取して放射能を測定する方法と、体内分布を体外から計測する方法とがある。前者の例としては、鉄59による血液疾患の診断、ヨウ素131による消化管の機能検査などがある。後者ではシンチスキャナ、シンチカメラなどを用い、体内あるいは臓器内のラジオ・アイソトープの分布を測定する。この方法をシンチグラフィという。テクネチウム99m、ヨウ素131などの化合物により、脳、甲状腺(こうじょうせん)、肺、心筋、肝臓、腎臓(じんぞう)、骨その他の疾患が診断される。これらの方法は放射線による患者の被曝(ひばく)の影響を考慮しなければならないが、これを避けるため、放射性物質は体内に入れず、採取した血液などにラジオ・アイソトープで標識した化合物を加えて分析する方法(イン・ビトロ法)が開発され、広く用いられている。また治療の場合は、放射線源として特定臓器にラジオ・アイソトープを注入し蓄積する方法、小密封線源を体に貼布(ちょうふ)、刺入する方法、大線源で大量照射する方法がある。体内注入は、甲状腺や心疾患にヨウ素131、白血病にリン32、癌(がん)性胸腹膜炎に金198のコロイドなどが用いられる。小線源としてはコバルト60の針や管が多用され、セシウム137、ストロンチウム90、金198も用いられる。大量照射はコバルト60などのγ(ガンマ)線により行う。医学へのもう一つの利用は、放射線による殺菌である。注射筒、注射針、手術用糸、包帯、ガーゼ、メスなどを包装のまま放射線照射して完全に殺菌し、使用時まで保存できる。
[市川富士夫]
『日本アイソトープ協会編『アイソトープ便覧』(1984・丸善)』▽『吉井義一著『放射線生物学概論』第3版(1992・北海道大学図書刊行会)』▽『日本原子力文化振興財団編・刊『原子力の基礎講座7 アイソトープ・放射線の利用』第5版(1996)』▽『日本アイソトープ協会編『やさしい放射線とアイソトープ』4版(2006・日本アイソトープ協会)』▽『日本アイソトープ協会編『放射線取扱の基礎 第1種放射線取扱主任者試験の要点』6版(2009・日本アイソトープ協会)』▽『日本アイソトープ協会編『アイソトープ手帳』11版(2011・日本アイソトープ協会)』
ブリタニカ国際大百科事典 小項目事典 「アイソトープ」の意味・わかりやすい解説
アイソトープ
isotope
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「アイソトープ」の意味・わかりやすい解説
出典 株式会社平凡社百科事典マイペディアについて 情報
PET検査用語集 「アイソトープ」の解説
アイソトープ
改訂新版 世界大百科事典 「アイソトープ」の意味・わかりやすい解説
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
栄養・生化学辞典 「アイソトープ」の解説
アイソトープ
最新 地学事典 「アイソトープ」の解説
アイソトープ
isotope
⇒ 同位体
出典 平凡社「最新 地学事典」最新 地学事典について 情報
化学辞典 第2版 「アイソトープ」の解説
アイソトープ
アイソトープ
isotope
[同義異語]同位体
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
世界大百科事典(旧版)内のアイソトープの言及
【同位体】より
…原子番号が同じで質量数が異なる核種を,互いに同位体という。周期表で同じ位置に入る元素という意味で,同位元素ともいう(ギリシア語で,isosは〈同じ〉,toposは〈場所〉という意味)。またアイソトープともいう。これまでに知られている原子の種類は千数百あるが,これを分類整理するのには,原子の重さ,すなわち質量数(原子核中の陽子と中性子の数の和)よりも,原子番号,すなわち原子核中の陽子の数または中性原子の核外電子数によるほうが便利である。…
【原子】より
…例えば,水素原子ではZ=1なので原子番号は1,酸素原子ではZ=8なので原子番号は8である。 電荷数Zが等しくて,質量数Aが異なる原子核を同位核と呼び,そのような核をもつ原子を同位体(アイソトープ)と呼ぶ。同位体は化学的にはほとんど同じ性質をもつので,同じ元素名で呼ばれる。…
【同位体】より
…周期表で同じ位置に入る元素という意味で,同位元素ともいう(ギリシア語で,isosは〈同じ〉,toposは〈場所〉という意味)。またアイソトープともいう。これまでに知られている原子の種類は千数百あるが,これを分類整理するのには,原子の重さ,すなわち質量数(原子核中の陽子と中性子の数の和)よりも,原子番号,すなわち原子核中の陽子の数または中性原子の核外電子数によるほうが便利である。…
※「アイソトープ」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...