翻訳|protein
精選版 日本国語大辞典 「蛋白質」の意味・読み・例文・類語
たんぱく‐しつ【蛋白質】
改訂新版 世界大百科事典 「蛋白質」の意味・わかりやすい解説
タンパク(蛋白)質 (たんぱくしつ)
protein
タンパク質は,生物体を構成するもっとも基本的な物質であり,さまざまな重要な働きをしている。細胞内外に見られる種々の構造は,主としてタンパク質により形成されるし,生物に必須の化学反応を触媒する酵素は,タンパク質でできている。そして,生体運動,神経系の活動,物質の輸送,免疫反応などもタンパク質が行っている。すなわち,タンパク質の第1の特徴として,その機能性をあげることができる。
また,タンパク質はおのおのの生物種に固有のものであり,生物種の特徴はタンパク質により決まっている。タンパク質は,人間をはじめとしてすべての動物の栄養分として重要なものである(タンパク質の栄養的側面については〈栄養〉の項目を参照)。しかし,われわれが牛肉を食べても,牛肉のタンパク質がそのまま体内に入り,筋肉になるのではない。牛肉のタンパク質は,消化管内で構成成分であるアミノ酸にまで分解された後,体内に吸収される。生物の体は,これらのアミノ酸を遺伝情報(核酸の塩基配列)に従ってつなぎ,それぞれに固有のタンパク質を合成するのである。ゆえに,タンパク質の第2の特徴はその特異性である。
DNAが太さ20Åの二重らせんの糸という均一な構造をもつのに対し,タンパク質の立体構造は種類により,鎖の折りたたまれ方も全体の外形もひじょうに多彩である。DNAはどれをとってみても情報の貯蔵・複製・発現という限られた同一の機能しかもたないのに対し,タンパク質は機能的に分化しており,種類により異なるさまざまな機能を果たす。これが構造上の多様性にも表れているのであろう。DNAについては一般論で多くのことを説明できるが,タンパク質は各論を語らないかぎり,その豊かさと精妙さを説明できない。このように,タンパク質の第3の特徴は,その多様性である。
細胞の“生きている”成分である原形質は,水分を除くと主要な部分はタンパク質でできている。したがって,100年以上前の人々が,生命の神秘を解く目的で,まずタンパク質の研究に着手したのは当然であった。タンパク質を意味するproteinという語がギリシア語で“第1の”という意味をもつprōteiosに由来するのも,このような背景から考えると理解できる。しかし,19世紀から20世紀初頭の学界では,まだいろいろと混乱した考えがみられた。たとえば,〈タンパク質は生きているから決まった構造をもたないはずだ〉〈種々のタンパク質は一つの化学式で表される〉〈数万から数十万という大きな分子量をもつ化合物などありえない〉〈タンパク質の構造は単純な構造の繰返しである〉などである。
表1に示すタンパク質研究の歴史は,いわば,これらの誤った考え方が徐々に訂正されてゆく歴史でもある。そして到達した現在のタンパク質観は次のとおりである。タンパク質にはひじょうに多くの種類があり,種ごとに大きさ・形・化学組成が異なる。しかし,一種のタンパク質を取り上げてみると,それは一定の大きさ・一定の形・一定の化学構造をもっている。その構造は,化学構造(アミノ酸配列)・立体構造ともひじょうに複雑であり,単純な構造の繰返しに還元することはできない。複雑な化学構造をまちがえずに合成できるのは,遺伝情報に従って作られるからである。また,複雑な立体構造は,与えられた化学構造の範囲内で自由エネルギーが最小になるように決まる。--それでは,このタンパク質観は最終的なものなのだろうか。また,将来にはどんな問題が残されているのだろうか。まず,現在の知識を整理してから,最後にまたこの問題に戻ってみよう。
タンパク質の構造
タンパク質の構造は一次から四次までの段階に分けて記述されることが多い。一次構造とはいわゆる化学構造で,アミノ酸がどの順序に結合しているかをいう。一般にタンパク質はプロリン残基(図1)を例外として,次のような構造式で表される。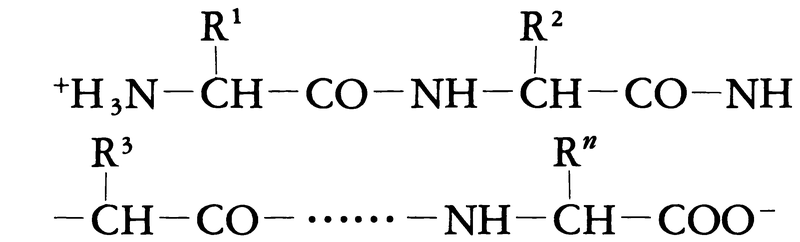
ここで,この式の左端はアミノ末端,右端はカルボキシル末端,-CO-NH-はペプチド結合,-NH-CHRi-CO-はアミノ酸残基,化学構造に注目したとき全体はポリペプチド鎖と呼ばれる。また,Riを側鎖,Ri以外の部分を主鎖,Riの結合する炭素原子をα炭素原子(Cα)という。重合度nは個々のタンパク質により異なり,およそ数十から数千の範囲にあるが,平均300程度である。アミノ酸残基は基本的には図1の20種類であるが,タンパク質合成後にこれらのアミノ酸残基が修飾を受けて変化する場合もある。アミノ酸組成によりタンパク質の元素組成は異なるが,重量にして炭素50~55%,水素6.9~7.3%,窒素13~19%,酸素25~30%,硫黄0~2.5%の範囲にあることが多い。
二次構造とは多くのタンパク質に見いだされる部分的かつ特徴的な立体構造のことである。タンパク質中の原子間結合の長さと結合角(一つの原子から出る結合間の角度)は,一次構造によらずほぼ一定とみなしてよい(図2-a)。したがって,立体構造で大きく変化するのは,結合のまわりの内部回転角のみである。主鎖のNH-CαとCα-COのまわりの内部回転角をそれぞれφとψで表す(図2-b)。主鎖のもう一つの結合であるCO-NHのまわりの内部回転角は,ほぼ180度(トランス)に固定されているとみなしてよい。(φ,ψ)の内部回転角の組には,いくつかのエネルギーの低い部分があり(図2-c),これが連続したアミノ酸残基に実現されるとき,二次構造として認識される。α-らせん,β-構造,ポリ-L-プロリンⅡ型らせんが二次構造の例である(図3)。α-らせんはそれ自身の中で,β-構造は他のβ-構造との間で水素結合を作り,構造を安定化している。また,四つのアミノ酸残基から成り,主鎖の向きを変える立体構造,β-ベンド(またはリバースターン)も二次構造の一つに数えられる場合が多い。β-ベンドに限り,連続するアミノ酸残基の(φ,ψ)は大きく異なることが多い。実際のタンパク質中での二次構造については,図4,6,7に例を示してある。
ポリペプチド鎖1本の全立体構造をタンパク質の三次構造という。完全な三次構造は,主鎖と側鎖を含む全原子の三次元の位置座標で表される。ただし,水素原子の位置は,タンパク質の三次構造を決めるX線解析法では普通見えない。実際に図示する場合,全原子の位置を描くと複雑すぎて見にくくなるので,α炭素の位置のみを示したり(図4-b-Ⅰ),二次構造を模式的に表現したり(図4-b-Ⅱ)する場合が多い。ポリペプチド鎖は,繊維状タンパク質(図5)では1000Å以上の長さに伸びている例もあるが,球状タンパク質では丸まって直径25~60Åの粒になっている。三次構造の一部には二次構造の組合せがよく現れ,これを超二次構造ということもある(図4)。また,三次構造の中で立体的にみてまとまっているような部分をドメインということもある(図4-b-Ⅱと図8-bにその例がある)。
タンパク質のあるものは複数のポリペプチド鎖から成る。この場合,ポリペプチド鎖の数とこれらの間の幾何学的位置関係を合わせて四次構造という。三量体のタンパク質も少数あるが,ポリペプチド鎖の数は2,4,6など偶数が普通である。
タンパク質に熱や圧力を加えたり,溶液のpHを変えるとか変性剤を加えるなどの操作をすると,一次構造は変化しないが二次以上の高次構造が変化してタンパク質が活性を失うことがある。これをタンパク質の変性という。変性に伴いタンパク質が凝固・沈殿することもまれではない。また,変性したタンパク質を元の環境に戻したときに高次構造と活性が回復することをタンパク質の再生という。塩酸グアニジンなどの強い変性剤中では,二次構造は完全に消失し,合成高分子などに見られるランダムコイルの状態になる。このような状態からでも多くの場合再生が可能なので,タンパク質の二,三次および簡単な四次構造は,一次構造すなわちそのタンパク質のもつ遺伝情報のみにより決まると考えられている。
それでは,アミノ酸配列が与えられたとき,そのタンパク質の種々の性質をどの程度予言することができるだろうか。アミノ酸残基により,種々の二次構造を作りやすい,あるいは作りにくいものがあることが経験的に知られている(表2)。これらをもとに,一次構造から二次構造を予言することはかなり正確にできるが,三次構造の予言はまだ難しい。三次構造では親水性(極性)のアミノ酸が表面に,疎水性(非極性)のアミノ酸が分子内部にくる傾向が強い。分子内部では原子はアミノ酸の結晶内部と同程度に密に詰まっている(図6-a)。単位質量のタンパク質をひじょうに多量の溶媒に溶かしたときの体積増加を偏比容という。偏比容は密度の逆数に近いが,タンパク質ではふつう0.69~0.75cm3/g程度であり,アミノ酸組成によりだいたいの値を予言することができる(表2)。また,タンパク質分子の電荷の総和が0になるpHを,そのタンパク質の等電点という。アミノ酸組成から等電点のおよその予想はできるが,正確な値は実験してみないとわからない。
活性ある天然の状態では,タンパク質の立体構造はさまざまな非共有結合により安定化され,エンタルピーHが小さくなっている。これに対し,変性状態ではこれらの結合はほとんど切れているが,その代りに多くの自由度を獲得してエントロピーSの大きな状態になっている。一方熱力学によると,ギブスの自由エネルギーGの小さい状態ほど安定であり,G=H-TSという関係が成立することが知られている。したがって,絶対温度Tの低いときは天然の状態が,また高いときは変性した状態が安定になる。また,熱変性のときある温度を境にこの二つの状態は急激に転移する。天然の構造を安定化する非共有結合として,水素結合,静電結合(塩橋),ファン・デル・ワールス力(分子間力),疎水結合などがある。このうち疎水結合はタンパク質自体でなく,溶媒の水によるものである。水の分子は水どうしと接触するよりタンパク質と接するほうが自由エネルギーが高い。このため水とタンパク質の接触面積を最小にするような,つまりタンパク質をなるべく密な構造にするような力が働く。これが疎水結合の本質である。タンパク質分子間の結合やタンパク質と他の分子(たとえば酵素と基質)の間の結合にも,上に述べた種々の非共有結合が働いているものと考えられる。
タンパク質の生合成と修飾
タンパク質の生合成は,遺伝情報に従ってアミノ酸を順序よくつなぐことである。その機構はかなり複雑で,多くの成分を必要とする。DNA鎖の1本を鋳型にして写しとられたメッセンジャーRNA(mRNAと略記)の塩基は三つずつくぎって読まれ,その三つ組(トリプレットまたはコドンと呼ばれる)に対してアミノ酸が一つ対応する。この対応のしかたを遺伝暗号表という(〈遺伝暗号〉の項目を参照)。mRNAは5′末端側から3′末端側に向かって読まれ,それにつれてタンパク質はアミノ末端からカルボキシル末端に向かって合成される。詳細については〈タンパク質合成〉の項目を参照されたい。
タンパク質は合成後に修飾される場合がかなり多い。その一例はペプチド結合の切断である。トリプシンなどのタンパク質分解酵素やインシュリンなどのペプチドホルモンには,切断を受けて初めて活性の出るものが多い。多くの膜タンパク質は合成時,アミノ末端にシグナルペプチドと呼ばれる部分をもつ。この部分はタンパク質が膜内に正しく組み込まれるときに必要だが,後に切り取られる。また一部の動物ウイルスでは,ひじょうに長いポリペプチド鎖が数個に切断され,おのおのが別の活性あるタンパク質になる。
側鎖やアミノ末端が修飾を受けることもある。側鎖ではメチル化,水酸化,リン酸化など,アミノ末端ではアセチル化,ピログルタミル化などが起こる。リン酸化により活性の調節を受ける酵素は多い。また,ある種の発癌遺伝子には,タンパク質をリン酸化する活性があり,注目されている。広い意味では,糖タンパク質における糖の結合や,酵素タンパク質への補欠分子族(チトクロムcのヘムなど)の結合も,この部類に入るだろう。また,二つのシステイン残基のSH基が酸化され,分子内に-SS-(ジスルフィド)結合の架橋を作る例は,細胞外で働く酵素に多い。皮膚や腱のコラーゲンでは二つのリシン残基の間に,血液凝固産物のフィブリンではグルタミン残基とリシン残基の間に,それぞれ分子間架橋ができる(図5)。いずれの場合も,架橋は構造の安定性に寄与している。
タンパク質の分類
ひじょうに多数の種類から成るタンパク質を分類しようとする試みはいろいろある。ポリペプチド鎖のみから成るものを単純タンパク質simple protein,他の物質と結合して(非共有結合も含める)存在するものを複合タンパク質conjugated proteinという(表3-(1))。溶媒中の等電点の違いによる分類もあり(表3-(2)),また,アルブミン,グロブリンなどの名は,溶解度によりタンパク質を分類したときの名残りである(表3-(4))。主としてX線解析による成果をもとに,二次構造,三次構造の違いからタンパク質を分類しようとする試みをまとめると表3-(3)のようになる。また,機能によって分類することもやや恣意(しい)的ではあるが可能である(表3-(5))。
タンパク質機能の作用機構
タンパク質機能の作用機構に関しては,どのような特徴が挙げられるだろうか。その第1は結合における立体相補性である。タンパク質とタンパク質,およびタンパク質と他の分子との結合面では,凸凹が互いに裏返しになっており,余分なすきまができないようになっている。これは結合の特異性を高める役割を果たしている。図8-dの抗体(免疫グロブリン)と抗原の結合はこの一例である。またとくに酵素と基質の結合は鍵と鍵穴の関係にたとえられてきたが,酵素表面の溝に基質がはまり込むようになっている。図6にその一例を示す。
第2に反応基の最適配置がある。酵素が基質を結合したところを見ると,基質の攻撃すべき部分の近傍に酵素の反応基(Ser,His,Cys,Asp,Gluなどの側鎖,金属イオン,補酵素など)が存在して,反応の効率を高めている。分子間の結合面でも単に立体的な凸凹だけでなく,しかるべき所にしかるべき側鎖や主鎖が配置され,正と負の電荷による結合(塩橋)や-NH(または-OH)と C=Oによる水素結合などが形成できるようになっている。この実例は図6-c,dに示されている。
C=Oによる水素結合などが形成できるようになっている。この実例は図6-c,dに示されている。
第3には結合の誘導適合induced fitが挙げられる。溶液中でのタンパク質の立体構造は,わずかに異なる多くの構造の間を移り変わってゆらいでいる。ところがこれに基質などが結合すると,結合が可能な構造のみに固定される。このため,結果的には基質が酵素の構造を結合に適したように変えたことになる。
そして第4にアロステリック効果がある。これはタンパク質の一部分に他の分子が結合すると,離れた部位の構造や活性が変わるという現象である。生体内においてはこれはさまざまな面で重要な役割を果たしている。その一つは酵素のフィードバック阻害で,代謝の最終産物が代謝系の始めの方の酵素に結合して活性を阻害し,むだな産物の生産を防ぐ役割を果たしている。また,アロステリック効果はヘモグロビンによる酸素運搬にも使われている。ヘモグロビンは1分子当り4分子の酸素を結合するが,一つめの酸素分子を結合するとアロステリック効果で他の結合部位へと影響が及び,二つめ以降の酸素結合がより容易になる。このため,酸素分圧に対し酸素結合量はS字型曲線となり,生理的な酸素分圧の近傍で酸素分圧の小さな変化に対してより多量の酸素の結合・解離ができるようになっている。アロステリック効果の機構は,連結した歯車に次々と動きが伝わるように,タンパク質の一部分に起こった構造変化が順々に隣接した部分を伝わっていくことのようである(図7)。アロステリック効果をもつタンパク質は,ほとんど四次構造をもつ。
以上はある程度実験により確認された機構だが,推測としては他にもいくつかの機構が考えられている。たとえば,タンパク質には多くの解離基や電気双極子をもつ基があるが,これらの分布により活性中心に強い電場が生じ,それが基質を分極させて酵素反応を助けているという説がある。また,溶液中でタンパク質分子は種々の振動をしているが,そのうちの一つの振動を使って基質を食いちぎっているという説がある。さらに,溶媒分子が酵素に衝突すると,そのエネルギーはこの振動に集中的に集められるという考えもある。中には,酵素は基質を追いかけて捕らえるのだという人もいる。タンパク質はひじょうに効率よく仕事をするだけでなく,環境の変化に敏感に受け答えし,まさに生きているようである。これが研究者の想像力を刺激し,種々の考えを生む。この意味ではタンパク質観は現代でもまだ揺れ動いている。推測の考えの中には,将来,否定されるものもあるに違いない。しかし,他方ではもっと精巧な作用機構が発見される可能性も十分にあるといえよう。
タンパク質の研究法
タンパク質の研究法を表4にまとめてある。タンパク質の示す呈色反応としては,ビウレット反応,キサントプロテイン反応,ニンヒドリン反応,ミロン反応などがある。またタンパク質の定量は,ビウレット法,ローリー法などの比色定量法のほか,紫外吸収法,乾燥重量測定,窒素の定量,加水分解してアミノ酸の定量などにより行う。一次構造は,化学的・酵素的に断片化してから断片のアミノ酸配列をエドマン分解法などにより端から順に調べ決定する。二つ以上の方法で断片化を行えば,重なりの部分から断片の配列順序がわかる。現在ではDNAの塩基配列から決定するほうが早いことも多いが,生合成後の修飾はタンパク質で調べないとわからない。三次構造を原子レベルで決定できるのは,現在のところX線結晶解析のみである。しかし,すべてのタンパク質で良い結晶が得られるわけではない。また結晶内の構造と溶液中の構造の微妙な差が問題になることもある。
タンパク質からみた進化
いろいろな生物から同じタンパク質を取り出して,そのアミノ酸配列を比べると進化の道すじがわかる。なぜなら,アミノ酸配列の違いは,種が分かれて以来の突然変異の蓄積によるので,進化の時間を計る時計となるからである。図9-aにチトクロムcのアミノ酸配列から求めた進化の系統樹を示す。これは化石などから決めた従来の系統樹とだいたい一致するので,上に述べた考えが正しいことを示している。また,この二つの方法で求めた系統樹を比べると,一つのアミノ酸残基の置換に要する時間がわかるが,これはタンパク質の大きさだけでなく種類によっても異なる(図9-b)。タンパク質には機能的に重要で置換が許されない部分があるが,その部分の占める割合が種類により異なるからである。
タンパク質の化学合成
人工的にアミノ酸をつなげてタンパク質を化学合成することはまだ難しく,特別な技術とタンパク質の種類に合った方法が必要である。かりにアミノ酸一つをつなげるときの正確さを99%としても,100個つなげると63%,300個つなげると95%がまちがった産物になってしまうからである。しかし,アミノ酸を10個程度つなげたペプチドは,固相合成法で比較的容易に合成できる。これは洗浄や溶媒交換を容易にするために,樹脂の上でアミノ酸をカルボキシル末端側から順につないでいく方法である。操作としては,(1)樹脂に結合したペプチドのアミノ末端(第1段目は樹脂そのもの)に,アミノ基をBoc(t-ブトキシカルボニル)基で保護したBoc-アミノ酸のカルボキシル基を,縮合剤を用いて結合する。(2)トリフルオロ酢酸でBoc基を外すことを繰り返す。
タンパク質研究の将来
現在,構造研究では一次構造決定の微量化,膜タンパク質や構造タンパク質の三次構造決定などがおもな目標とされている。タンパク質の作用機構に関しては,立体構造を見ての推論から実証へ向けての努力が,反応中間体の立体構造決定などを中心に進められるであろう。タンパク質の運動に関する実験と理論計算から興味ある結論の出る可能性もある。また一次構造のデータが莫大な量蓄積されるので,それからいろいろと有用な情報を取り出すことも行われつつある。
遠い将来の目標としては,望む機能をもつタンパク質を設計することが考えられる。これには一次構造を見て機能を予言すること,およびその逆が必要になる。理論的に可能なタンパク質の数は,かりにアミノ酸300残基としても20300≒10400という超天文学的数字になる。これは,地球の誕生以来出現したタンパク質種の総数と比べても限りなく大きい。地上の生物にはないまったく新しいタンパク質で,有用な機能をもつものが多数存在することが予想される。
執筆者:桂 勲

図1~図2
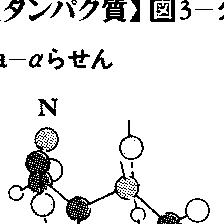
図3~図5

図6~図8

図9-タンパク質のアミノ酸配列から見た…

表1-タンパク質研究史上の大きなできご…

表2-タンパク質を構成する20種のアミ…
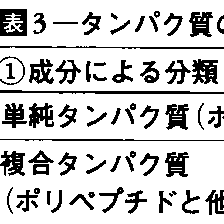
表3-タンパク質の分類

表4-タンパク質の研究法
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「蛋白質」の解説
タンパク質
タンパクシツ
protein
生命の基本となる高分子で,α-アミノ酸の縮合によりできたポリペプチドである.生物から水を除いた残りの50% を占める.通常,20種類のアミノ酸がペプチド結合により縮重合してできており,分子量は 104 から 106 あるいはそれ以上に及ぶ(5000以下のものをペプチドとよんで区別することが多い).種類もきわめて多く,たとえば大腸菌では約3000,ヒトでは5×106 種類のタンパク質が存在するといわれる.これはタンパク質の有する機能がそれだけ多様であることを意味する.タンパク質はきわめて複雑であるが,ある1種類のタンパク質を例にとれば,構成アミノ酸の数,種類はもとより,配列順序も一定である.この配列順序は,タンパク質の立体構造を規定してタンパク質を活性な状態とする.したがって,タンパク質分子におけるアミノ酸の配列順序は,活性と直接的な関係を有し,一方,それはデオキシリボ核酸の塩基配列により決定されることから,タンパク質の有する機能は遺伝子の“表現”であるといえる.タンパク質はα-アミノ酸のみからなる単純タンパク質,α-アミノ酸と補欠分子族と称せられるほかの有機あるいは無機物質とからなる複合タンパク質に分類され,またタンパク質分子の形状から繊維状タンパク質(fibrous protein)と球状タンパク質(globular protein)とに分類されている.1970年,A.L. Lehningerはタンパク質を機能という面から以下のように分類した.( )内には例を示した.
(1)生体反応を触媒する酵素(リゾチーム,トリプシン),
(2)次世代に栄養を供給する貯蔵タンパク質(卵アルブミン,カゼイン),
(3)生体内で物資の運送を行う輸送タンパク質,(ヘモグロビン,β1リポタンパク質),
(4)生物の運動のための収縮タンパク質(ミオシン,アクチン),
(5)生体防御反応をつかさどる防御タンパク質(抗体,フィブリノーゲン),
(6)毒素(ヘビ毒タンパク質,ジフテリア毒素),
(7)タンパク質ホルモン(インスリン,成長ホルモン),
(8)生体あるいは細胞の構造を維持する構造タンパク質(コラーゲン,膜構造タンパク質).
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「蛋白質」の意味・わかりやすい解説
タンパク(蛋白)質【たんぱくしつ】
→関連項目アミノ酸|栄養|トリプシン|ペプチド
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「蛋白質」の意味・わかりやすい解説
蛋白質
たんぱくしつ
protein
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
最新 地学事典 「蛋白質」の解説
たんぱくしつ
蛋白質
protein
すべての細胞中の原形質に主成分として含まれる含窒素有機化合物の総称。生細胞の構成物質として,またその活性物質(酵素)として,生命現象の基本となる物質。通常のタンパク質は約20種のL─α─アミノ酸類が互いにペプチド結合で結合したポリペプチド。分子量は4,000程度(プロタミン)から数千万~数億(ウイルスのタンパク質)に及ぶ。硬タンパク質のようにアミノ酸だけからなるものを単純タンパク質,糖タンパク質のようにアミノ酸以外の有機物を含むものを複合タンパク質という。個々のタンパク質の構造は一次構造と高次構造で決められる。一般の天然タンパク質は抗原性を有し,異種動物体内に入ると抗体が形成される。保存のよい化石中に化学化石の一つとして存在することがあるが,大半は続成変化によって元の構造が変化している。
執筆者:佐俣 哲郎・秋山 雅彦
出典 平凡社「最新 地学事典」最新 地学事典について 情報
食の医学館 「蛋白質」の解説
たんぱくしつ【たんぱく質】
可食部100g中に含まれるたんぱく質の多い食品として、以下のものがあります。ホンマグロ赤身26.4g、カツオ(春どり)25.8g、若鶏ささみ23g、豚ひれ肉(大型種)22.2g、牛肉もも赤身(輸入)21.2g。成人1日あたりの推奨量は男性60g、女性50gです。
漢方薬・生薬・栄養成分がわかる事典 「蛋白質」の解説
たんぱくしつ【蛋白質】
世界大百科事典(旧版)内の蛋白質の言及
【栄養】より
… 摂取する栄養素の質によって栄養型が分類される。緑色植物はクロロフィル(葉緑素)のはたらきで,太陽光線のエネルギーによって二酸化炭素と水から炭水化物であるブドウ糖を合成することができ(光合成),これが体内で分解するときに生じるエネルギーによって,根から吸収した窒素,硫黄,リン,カリウム,マグネシウムなどの無機化合物を材料として,タンパク質,核酸,その他あらゆる生体構成成分を合成する。このような栄養型を独立栄養(無機栄養,自栄養)という。…
【加水分解】より
…水による分解反応を広く加水分解といい,酢酸ナトリウムのような塩(えん)の加水分解,酢酸エチルのようなエステルの加水分解,デンプンやタンパク質の加水分解など,化学反応には加水分解の例が多い。強酸と強塩基との中和によりできた塩,たとえば食塩は,水に溶かすとナトリウムイオンと塩素イオンに電離するだけであるが,酢酸ナトリウムや炭酸ナトリウムのように弱酸と強塩基からできた塩,塩化アンモニウムや硫酸アルミニウムのような強酸と弱塩基からできた塩,さらに酢酸アンモニウムのように弱酸と弱塩基からできた塩は,それを水に溶かすと加水分解が起こる。…
【高分子】より
…しかし互いに類似の化学構造の分子からなる物質でも,分子量が1000程度のものと1万以上のものとではとくに物理的性質に大きな差異があり,一般には分子量が数千以上のものを高分子と呼ぶ。天然に存在する高分子にはセルロース,タンパク質,核酸などがあり,それぞれ生物にとって必須の役割を担っている。そのなかでもセルロースは古くから人類によって被服の材料などとして利用されてきた。…
【ジケトピペラジン】より
…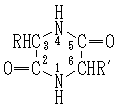 酸またはアルカリによって加水分解され,ジペプチドを経由してアミノ酸となる。ジケトピペラジンは,α‐アミノ酸あるいはそのエステルなどを放置したり,加熱したりすると容易に生成し,またタンパク質の高温加水分解の際にも生成しやすい。このためかつて,これがタンパク質の構成単位であるという〈ジケトピペラジン説〉があったが,現在では否定されている。…
酸またはアルカリによって加水分解され,ジペプチドを経由してアミノ酸となる。ジケトピペラジンは,α‐アミノ酸あるいはそのエステルなどを放置したり,加熱したりすると容易に生成し,またタンパク質の高温加水分解の際にも生成しやすい。このためかつて,これがタンパク質の構成単位であるという〈ジケトピペラジン説〉があったが,現在では否定されている。…
【分子生物学】より
… 分子生物学は,生物現象を要素的,還元的にとらえる。要素は生体分子であり,DNA,RNA,タンパク質分子が生物を構成する基本単位となる。中心概念は,生物を分子的な機械とみなすところにある。…
※「蛋白質」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

