精選版 日本国語大辞典 「次亜塩素酸」の意味・読み・例文・類語
改訂新版 世界大百科事典 「次亜塩素酸」の意味・わかりやすい解説
次亜塩素酸 (じあえんそさん)
hypochlorous acid
化学式HClO。水溶液としてのみ存在する塩素のオキソ酸で,単離はされない。酸化水銀(Ⅱ)を四塩化炭素に懸濁させ,塩素を通じたのち水で処理すると水溶液中にHClOが生ずる。酸化ビスマスを水に懸濁させ塩素を通じても得られる。また,さらし粉に水を加え二酸化炭素気流中で蒸留するか,水酸化カリウム水溶液に塩素を吸収させたのち硫酸を加えて蒸留しても得られる。水溶液を減圧濃縮すれば25%までの濃厚溶液を得ることができるが,さらに減圧濃縮するとCl2Oとなる。塩素水溶液は
Cl2+H2O⇄HCl+HClO
の平衡(平衡定数K=[H⁺][Cl⁻][HClO]/[Cl2]=1.56×10⁻4mol2/dm6,0℃)を保ち,25℃,1気圧で飽和塩素濃度(約0.06mol/dm3)の約50%がHCl+HClOとして存在している。希薄溶液は無色,濃厚溶液は淡黄色で,塩素とはちがった刺激臭がある。弱酸で,酸解離定数はK=[H⁺][ClO⁻]/[HClO]=2.95×10⁻8mol/dm3(25℃)である。水溶液は不安定で酸素を放って分解し,塩酸および塩素酸を生ずる。
2HClO─→2HCl+O2
3HClO─→2HCl+HClO3
-20℃では数日間は安定に保存することができる。強い酸化剤。飽和有機化合物に対しては塩素化作用を示すほか,不飽和有機化合物の二重結合に付加してクロロヒドリンを生ずる。次亜塩素酸塩も強酸化剤で,漂白・殺菌作用を有する。カルシウム塩はさらし粉の主成分である。
執筆者:大瀧 仁志
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「次亜塩素酸」の解説
次亜塩素酸(塩)
ジアエンソサン
hypochlorous acid(hypochlorite)
酸:HClO(52.46).水溶液としてのみ存在する.25% 水溶液は黄緑色.塩素の水溶液中にも存在する.一酸化水銀(Ⅱ)を水中に懸濁させ,これに塩素気体を通した後,低温で濃縮すると25% 水溶液が得られる.-40 ℃ では,HClO・2H2Oの固体が得られる.弱酸性で,pK 約7.49(20 ℃).-20 ℃ では数日間保存しうるが,室温では徐々に分解して,HCl,O2,HClO3を生じる.分解は光,熱で促進される.酸化力が強く,S,H2SはH2SO4に,P,PH3はH3PO4に,H2O2は O2 に,Br2,HBrはHBrO3に酸化される.有機化合物の多くも酸化される.殺菌剤に用いられる.[CAS 7790-92-3]
塩:アルカリ金属,アルカリ土類金属の塩は比較的安定で,次亜塩素酸カルシウム,次亜塩素酸ナトリウムは,無水物または数種類の水和物として固体が得られる.重金属塩は一般に不安定である.いずれも酸化力が強く,Ca,Na塩は漂白や殺菌に用いられる.[CAS 7681-52-9]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
日本大百科全書(ニッポニカ) 「次亜塩素酸」の意味・わかりやすい解説
次亜塩素酸
じあえんそさん
hypochlorous acid
塩素のオキソ酸の一つ。水溶液としてのみ存在する。きわめて弱い一塩基酸。最高濃度は約25%。化学式HClO、式量52.5。塩素水中に次の平衡を保って存在する。
Cl2+H2O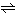 HClO+HCl
HClO+HCl
水に直接塩素ガスを通して薄い溶液が得られるが、酸化水銀(Ⅱ)を水に懸濁させ塩素を通し、濾液(ろえき)を減圧蒸留すると濃厚溶液が得られる。濃厚溶液は淡黄色で、特有の刺激臭がある。極低温では安定であるが、常温では徐々に酸素を放って塩酸に分解する。アルカリ性溶液で塩化物と塩素酸に不均化するが、その反応速度は冷時に小さく、熱時に大きい。強い酸化作用を示し、硫黄(いおう)、リンをそれぞれ硫酸、リン酸に酸化する。蒸気相のHClO分子は折れ線形である。漂白剤、殺菌剤として、その塩(カルシウム塩はさらし粉の主成分)が使われる。
[守永健一・中原勝儼]
ブリタニカ国際大百科事典 小項目事典 「次亜塩素酸」の意味・わかりやすい解説
次亜塩素酸
じあえんそさん
hypochlorous acid
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「次亜塩素酸」の解説
次亜塩素酸
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

