デジタル大辞泉 「周期表」の意味・読み・例文・類語
しゅうき‐ひょう〔シウキヘウ〕【周期表】
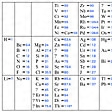
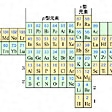
[補説]原子番号と元素一覧
原子番号 元素(元素記号) 周期/族
1 水素(H) 1/1
2 ヘリウム(He) 1/18
3 リチウム(Li) 2/1
4 ベリリウム(Be) 2/2
5 ホウ素(B) 2/13
6 炭素(C) 2/14
7 窒素(N) 2/15
8 酸素(O) 2/16
9 フッ素(F) 2/17
10 ネオン(Ne) 2/18
11 ナトリウム(Na) 3/1
12 マグネシウム(Mg) 3/2
13 アルミニウム(Al) 3/13
14 ケイ素(Si) 3/14
15 リン(P) 3/15
16 硫黄(S) 3/16
17 塩素(Cl) 3/17
18 アルゴン(Ar) 3/18
19 カリウム(K) 4/1
20 カルシウム(Ca) 4/2
21 スカンジウム(Sc) 4/3
22 チタン(Ti) 4/4
23 バナジウム(V) 4/5
24 クロム(Cr) 4/6
25 マンガン(Mn) 4/7
26 鉄(Fe) 4/8
27 コバルト(Co) 4/9
28 ニッケル(Ni) 4/10
29 銅(Cu) 4/11
30 亜鉛(Zn) 4/12
31 ガリウム(Ga) 4/13
32 ゲルマニウム(Ge) 4/14
33 ヒ素(As) 4/15
34 セレン(Se) 4/16
35 臭素(Br) 4/17
36 クリプトン(Kr) 4/18
37 ルビジウム(Rb) 5/1
38 ストロンチウム(Sr) 5/2
39 イットリウム(Y) 5/3
40 ジルコニウム(Zr) 5/4
41 ニオブ(Nb) 5/5
42 モリブデン(Mo) 5/6
43 テクネチウム(Tc) 5/7
44 ルテニウム(Ru) 5/8
45 ロジウム(Rh) 5/9
46 パラジウム(Pd) 5/10
47 銀(Ag) 5/11
48 カドミウム(Cd) 5/12
49 インジウム(In) 5/13
50 スズ(Sn) 5/14
51 アンチモン(Sb) 5/15
52 テルル(Te) 5/16
53 ヨウ素(I) 5/17
54 キセノン(Xe) 5/18
55 セシウム(Cs) 6/1
56 バリウム(Ba) 6/2
57 ランタン(La) 6/3(ランタノイド)
58 セリウム(Ce) 6/3(ランタノイド)
59 プラセオジム(Pr) 6/3(ランタノイド)
60 ネオジム(Nd) 6/3(ランタノイド)
61 プロメチウム(Pm) 6/3(ランタノイド)
62 サマリウム(Sm) 6/3(ランタノイド)
63 ユウロピウム(Eu) 6/3(ランタノイド)
64 ガドリニウム(Gd) 6/3(ランタノイド)
65 テルビウム(Tb) 6/3(ランタノイド)
66 ジスプロシウム(Dy) 6/3(ランタノイド)
67 ホルミウム(Ho) 6/3(ランタノイド)
68 エルビウム(Er) 6/3(ランタノイド)
69 ツリウム(Tm) 6/3(ランタノイド)
70 イッテルビウム(Yb) 6/3(ランタノイド)
71 ルテチウム(Lu) 6/3(ランタノイド)
72 ハフニウム(Hf) 6/4
73 タンタル(Ta) 6/5
74 タングステン(W) 6/6
75 レニウム(Re) 6/7
76 オスミウム(Os) 6/8
77 イリジウム(Ir) 6/9
78 白金(Pt) 6/10
79 金(Au) 6/11
80 水銀(Hg) 6/12
81 タリウム(Tl) 6/13
82 鉛(Pb) 6/14
83 ビスマス(Bi) 6/15
84 ポロニウム(Po) 6/16
85 アスタチン(At) 6/17
86 ラドン(Rn) 6/18
87 フランシウム(Fr) 7/1
88 ラジウム(Ra) 7/2
89 アクチニウム(Ac) 7/3(アクチノイド)
90 トリウム(Th) 7/3(アクチノイド)
91 プロトアクチニウム(Pa) 7/3(アクチノイド)
92 ウラン(U) 7/3(アクチノイド)
93 ネプツニウム(Np) 7/3(アクチノイド)
94 プルトニウム(Pu) 7/3(アクチノイド)
95 アメリシウム(Am) 7/3(アクチノイド)
96 キュリウム(Cm) 7/3(アクチノイド)
97 バークリウム(Bk) 7/3(アクチノイド)
98 カリホルニウム(Cf) 7/3(アクチノイド)
99 アインスタイニウム(Es) 7/3(アクチノイド)
100 フェルミウム(Fm) 7/3(アクチノイド)
101 メンデレビウム(Md) 7/3(アクチノイド)
102 ノーベリウム(No) 7/3(アクチノイド)
103 ローレンシウム(Lr) 7/3(アクチノイド)
104 ラザホージウム(Rf) 7/4
105 ドブニウム(Db) 7/5
106 シーボーギウム(Sg) 7/6
107 ボーリウム(Bh) 7/7
108 ハッシウム(Hs) 7/8
109 マイトネリウム(Mt) 7/9
110 ダームスタチウム(Ds) 7/10
111 レントゲニウム(Rg) 7/11
112 コペルニシウム(Cn) 7/12
113 ニホニウム(Nh) 7/13
114 フレロビウム(Fl) 7/14
115 モスコビウム(Mc) 7/15
116 リバモリウム(Lv) 7/16
117 テネシン(Ts) 7/17
118 オガネソン(Og) 7/18