日本大百科全書(ニッポニカ) 「ケイ素」の意味・わかりやすい解説
ケイ素
けいそ
silicon
周期表第14族に属し、炭素族元素の一つ。工業的にはシリコンということのほうが多い。石英やガラスは古代から知られており、とくにシリカ(二酸化ケイ素)とソーダなどを混合融解してガラスをつくることはよく知られていた。シリカは18世紀の終わりごろまでは一つの元素単体であるとも考えられていたが、19世紀に入ってから、これが未知の元素を含むものとして分離することが試みられるようになった。1811年ゲイ・リュサックとテナールは四フッ化ケイ素とカリウムを熱して粗製のケイ素を得たが、さらに1824年ベルツェリウスがこの方法を検討して実験を重ね、初めてケイ素を取り出すことに成功した。結晶が得られたのは1854年で、フランスのサント・クレール・ドビルHenri Étienne Sainte-Claire Deville(1818―1881)がアルミニウムの混合塩化物を溶融してアルミニウムを分離するときに初めて結晶として得られた。シリコンの名称はラテン語のsilex(ケイ砂)に基づいている。現在半導体としての需要が多く、工業的に高純度のものが大量に生産されている。
[守永健一・中原勝儼]
存在
地殻中には酸素に次いで2番目に多く、すべての岩石、天然水、大気、多くの植物や動物の骨、組織、体液にみいだされる。しかし、炭素と違って遊離状態では産出せず、酸化物または酸素のほか、アルミニウム、マグネシウム、カルシウム、ナトリウム、カリウム、鉄などと化合して無数のケイ酸塩として、岩石、土壌、粘土などを構成している。
[守永健一・中原勝儼]
製法
無定形のものは珪砂(けいさ)をマグネシウムまたはアルミニウムで還元する。
SiO2+2Mg―→Si+2MgO
工業的には、電気炉内でコークスにより還元する。結晶形のものはヘキサフルオロケイ酸カリウムをアルミニウム、カリウム、ナトリウムなどで還元する。
3K2SiF6+4Al
―→3Si+2KAlF4+2K2AlF5
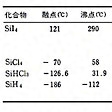
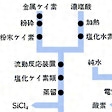
市販品は97~99%の純度。きわめて純粋なものは、たとえば粗シリコンを塩化水素ガスと反応させてトリクロロシランSiHCl3とし、これを蒸留して精製してから水素還元してつくる。その他SiCl4、SiI4などとして精製してから還元することもある。さらに引上げ法やゾーンメルティング(帯融解法)で精製する。純度は99.99%以上が普通。電気特性上の純度でもいわゆるナインナインの純度99.9999999%のものも得られている。なお、シリコン多結晶製造用の中間原料についてはを参照。また、シーメンス法シリコンの製造工程についてはを参照。
[守永健一・中原勝儼]
性質
結晶は灰色で金属光沢がある。ダイヤモンド型構造で、ゲルマニウムとともに半導体としてよく知られている。無定形のものは褐色粉末であるが、これもダイヤモンド型構造である。真性半導体の比抵抗は室温で230キロオーム・センチメートル。3価(たとえばホウ素)または5価(たとえばアンチモン)の不純物の微量を加えると、それぞれp型またはn型の半導体となる。室温では空気中で安定であるが、フッ素とは激しく反応して四フッ化物をつくる。酸素とは400℃、塩素とは430℃、臭素とは500℃、硫黄(いおう)とは600℃、窒素とは1300℃、炭素とは2000℃で反応し、それぞれ二酸化物、四塩化物、四臭化物、二硫化物、窒化物、炭化物をつくる。普通の無機酸に対しては安定であるが、王水では徐々に侵される。フッ化水素と硝酸またはフッ化水素と過酸化水素の混合物にはたやすく溶ける。熱水酸化アルカリ溶液には水素を発生して溶けケイ酸アルカリとなる。融解状態の金属とはケイ化物をつくり、多くの金属酸化物は高温でケイ素によって還元され金属を遊離する。300~400℃で塩化メチルや塩化フェニルと容易に反応していろいろな有機クロロシランとなる。これから、ケイ素‐酸素結合で連結した鎖状分子にアルキル基やアリール基のついたシロキサン、その重合体のシリコーン樹脂(ケイ素樹脂)、シリコーン油などが導かれる。
[守永健一・中原勝儼]
用途
高純度ケイ素は半導体としてダイオード、トランジスタ、IC(集積回路)、整流器、その他の半導体素子に盛んに利用される。シリコーンゴム、シリコーン油など各種シリコーン高分子材料の原料として広く用いられるほか、金属精練における還元剤、脱酸剤として重要。また合金添加元素として金属材料関係に多量に用いられる。高ケイ素鋳鉄(15%ケイ素)は耐酸合金として知られる。ケイ素0.5~4.2%のケイ素鋼板は導磁率が高く、変圧器などの鉄心として重要である。銅合金では約4.5%添加されて電信・電話線などに用いられ、アルミニウム合金では約13%添加されてシルミン合金として自動車その他の車両部品に大量に用いられる。また炭化ケイ素の原料に用いられる。
[守永健一・中原勝儼]
ケイ素(データノート)
けいそでーたのーと
ケイ素
元素記号 Si
原子番号 14
原子量 28.0855±3
融点 1410℃
沸点 2355℃
比重 2.33(測定温度18℃)
結晶系 立方(ダイヤモンド型)
元素存在度 宇宙 1.000×106(第8位)
(Si106個当りの原子数)
地殻 28.15% (第2位)
海水 2×103μg/dm3