翻訳|thorium
精選版 日本国語大辞典 「トリウム」の意味・読み・例文・類語
トリウム
- 〘 名詞 〙 ( [ドイツ語] Thorium ) ( 北欧神話の神トールにちなむ ) 希土類アクチノイド元素の一つ。元素記号 Th 原子番号九〇。原子量二三二・〇三八。銀白色、等軸晶系の結晶。粉末は灰色。重要な天然放射性元素の一つで、地球表層の岩石に広く薄く存在する。主要鉱物は方トリウム鉱・トール石・モナズ石など。一八二八年、スウェーデンのベルセーリウスがトール石中から発見。加熱すると熱電子を放出しやすいのでガス放電管電極・光電管電極・真空管熱陰極や、アーク溶接の溶接棒材、触媒、光学ガラス原料などに用いられる。同素体のトリウム二三二は原子炉での転換によって核燃料ウラン二三三になる。〔稿本化学語彙(1900)〕
改訂新版 世界大百科事典 「トリウム」の意味・わかりやすい解説
トリウム
thorium
周期表第ⅢA族に属するアクチノイド元素の一つ。天然に存在する最も主要な放射性元素の一つである。1828年スウェーデンのJ.J.ベルセリウスがノルウェー産の鉱物中から発見し,オーディンと並んでよく知られる北欧神話の雷神トールThórrにちなんで命名した。98年ドイツのシュミットG.C.N.SchmidtおよびフランスのM.キュリーがそれぞれ独立に放射性元素であることを発見した。
存在
地球表層の岩石に広く薄く分布する。おもな鉱物は方トリウム鉱,セル石などで,インド,アメリカ,カナダなどに産し,工業上の資源としてはモナザイトが最も重要である。天然の放射性系列の一つ,トリウム系列の起源元素で,6回のα崩壊と4回のβ崩壊を行って208Pb(トリウムD)となる。
性質
銀白色の金属。鉛に似て軟らかく,きわめてもろい。水,アルカリには侵されない。塊状のものは空気中に放置しても表面が酸化されて灰黒色の皮膜をつくるだけであるが,細粉は発火することがあるので大量の貯蔵は危険である。空気中での発火温度280℃。希塩酸,希硝酸,希硫酸にしだいに溶け,濃硝酸,濃硫酸には速やかに溶ける。
製法
原鉱を破砕し,苛性ソーダ水溶液で浸出し,硝酸でトリウム塩としてから溶媒抽出し,シュウ酸塩などにしてから熱分解して酸化物とする。酸化物を不活性ガス中約1000℃で金属カルシウムにより還元するか,ハロゲン化物と塩化カリウムとの溶融塩電解,あるいはヨウ化物の熱分解などで金属とする。
用途
同位体の質量数は223から235まであり,このうち230,234がウラン系列,228,232がトリウム系列,227,231がアクチニウム系列に属する天然放射性核種で,他は人工的につくられたものである。直接には原子炉燃料とはならないが,原子炉中で中性子を吸収して232から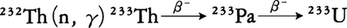 の反応によって原子炉用燃料233Uが得られる。また加熱すると熱電子を放出しやすいので,ガス放電管式ランプなどに用いられる。合金原料として各種金属に添加される。
の反応によって原子炉用燃料233Uが得られる。また加熱すると熱電子を放出しやすいので,ガス放電管式ランプなどに用いられる。合金原料として各種金属に添加される。
執筆者:中原 勝儼
原子炉材料
ウランと並んで天然に存在する核燃料資源の一つである。天然に存在するトリウムは100%232Thであり,それ自身は核分裂性物質ではないが,中性子を吸収して233Thとなり,β崩壊によって核分裂性物質である233Uとなる。すなわち235Uと232Thを原子炉の炉心にいっしょにおくと,235Uは核分裂しエネルギーを発生して消費されるが,そのとき発生した中性子が232Thと反応して核分裂性の233Uを生成し,条件によっては235Uの消費よりも多い233Uが生成される。トリウムはまだ実用炉の燃料としては使用されていないが,高温ガス冷却炉で,(Th,U)O2の混合酸化物の粒子を熱分解黒鉛で被覆したものを使用している例がある。
執筆者:大久保 忠恒
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「トリウム」の意味・わかりやすい解説
トリウム
とりうむ
thorium
アクチノイドに属する元素で、ウランとともに天然に存在する主要な放射性元素の一つ。原子番号90、元素記号Th。
歴史
その発見は比較的早く、1828年スウェーデンのベルツェリウスがノルウェー産鉱石中の新元素をスカンジナビア神話の雷神トールThorにちなんで命名した。1898年に至り、ドイツのシュミットG. C. N. Schmidt(1865―1949)とフランスのM・キュリー(ポーランド生まれ)が独立に放射性元素であることをみいだした。
[岩本振武]
存在と製法
地殻岩石圏に広く分布し、主要鉱物にはトリアン石ThO2、トール石Th(SiO4)があるが、工業資源としてはモナズ石(主成分CePO4)が重要である。原鉱には他の元素が多く含まれているため、粉砕後、濃硫酸溶解、リン酸塩、シュウ酸塩、硝酸塩などとしての分別沈殿を重ね、溶媒抽出法で精製し、電解法あるいは還元法で金属トリウムを得る。
[岩本振武]
性質と用途
銀白色のもろい金属で、フッ化水素酸以外の希酸に溶けにくいが、塩酸、王水に溶ける。硝酸には不動態(不働態)となって溶けない。金属粉末は燃えやすい。高温ではハロゲン、窒素、水素と直接反応する。
天然には質量数223から234までの同位体が存在するが、232のものが事実上100%の存在比を示し、トリウムの原子量はこの同位体の質量によって定められている。トリウム232はトリウム系列の出発核種であり、中性子照射によって原子炉燃料となるウラン233を製造する原料となる。
ウラン・ラジウム系列中で生ずるトリウム234はウランX1、同230はイオニウム、アクチニウム系列中の同231はウランY、同227はラジオアクチニウムとよばれることもある。
加熱によって熱電子を放出しやすいので、光電管、放電管、熱陰極材料となるほか、合金材料にも使われる。化合物は酸化数+Ⅳとなるのが普通である。
[岩本振武]
トリウム(データノート)
とりうむでーたのーと
トリウム
元素記号 Th
原子番号 90
原子量 232.03806
融点 1750℃
沸点 4800℃
比重 11.72
結晶系 立方
元素存在度 宇宙(Si 106個当りの原子数)
0.034(第81位)
地殻 9.6ppm(第37位)
海水 0.6×10-3μg/dm3
化学辞典 第2版 「トリウム」の解説
トリウム
トリウム
thorium
Th.原子番号90の元素.電子配置[Rn]6d27s2の周期表3族遷移金属元素.アクチノイド元素の一つ.天然放射性元素である.原子量232.0381(1).天然放射性核種として量的にはほとんどすべて 232Th(α線放出,半減期1.40×1010 y)であるが,微量の 234Th,230Th(ウラン系列),228Th(トリウム系列),231Th,227Th(アクチニウム系列)が含まれる.そのほか,質量数209~238の人工放射性核種が知られている.1829年,スウェーデンのJ.J. Berzelius(ベルセリウス)によってトール石のなかから発見された.トールは北欧神話の雷神Thorで,Berzeliusはほかの鉱石に誤ってこの名称をつけていたが,新元素の発見により元素名とともに命名しなおした.宇田川榕菴は天保8年(1837年) に出版した「舎密開宗」で,これを音訳して多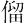 母(トリュウム)としている.
母(トリュウム)としている.
天然にはトール石,ホウトリウム鉱などの鉱物が知られているが,資源的にはモナズ石が利用される.地殻中の存在度3.5 ppm.埋蔵量はオーストラリア,インド,アメリカ,ノルウェイで世界の80% を占める.ThO2をアルゴン中または真空中でカルシウム還元するか,ハロゲン化物の融解塩電解または熱分解などにより金属を得る.銀白色の立方晶系.密度11.780 g cm-3(20 ℃).融点1750 ℃,沸点4790 ℃(α形).1386 ℃ で体心立方晶.密度11.724 g cm-3(20 ℃)(β形)に転移する.水,アルカリには侵されないが,塩酸に易溶,過塩素酸,硫酸に徐々に溶け,硝酸では不動態となる.トリウムの酸化数2~4,通常の酸化数4で,無色の安定な化合物をつくる.標準電極電位 Th4+/Th-1.83 V.第一イオン化エネルギー586.5 kJ mol-1(6.08 eV),ThⅣ(六配位)のイオン半径0.108 nm.ハロゲン,窒素とは高温で反応する.塩化物,臭化物,ヨウ化物,塩素酸塩,臭素酸塩,硫酸塩などは水に可溶,水酸化物,フッ化物,ヨウ素酸塩,リン酸塩,シュウ酸塩などは水に不溶.塩類はチタンやジルコニウムの塩ほど加水分解しやすくはないが,水溶液を温めると容易に加水分解する.多種類の酸イオンと錯化合物をつくりやすく,たとえば,[Th(NO3)6]2-,[Th(SO4)4]2- などがある.
溶接用電極棒,高輝度放電(HID)ランプ電極, 船底塗料などに利用されている.健康衣料・寝具,家庭用温泉器(入浴剤),医療用枕などに含まれていることがある.トリウムは原子力基本法のいう「核燃料物質・核原料物質」で「核原料物質,核燃料物質及び原子炉の規制に関する法律施行令」により,900 g を超える場合は使用許可を要する.[CAS 7440-29-1]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「トリウム」の意味・わかりやすい解説
トリウム
→関連項目イオニウム|シーボーグ|転換炉|ラジオアクチニウム|ラジオトリウム
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「トリウム」の意味・わかりやすい解説
トリウム
thorium
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...



