翻訳|halogen
精選版 日本国語大辞典 「ハロゲン」の意味・読み・例文・類語
ハロゲン
- 〘 名詞 〙 ( [ドイツ語] Halogen [英語] halogen ) =ハロゲンげんそ(━元素)〔稿本化学語彙(1900)〕
改訂新版 世界大百科事典 「ハロゲン」の意味・わかりやすい解説
ハロゲン
halogen
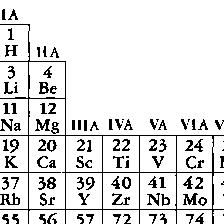
周期表第ⅦB族に属するフッ素F,塩素Cl,臭素Br,ヨウ素IおよびアスタチンAtの5元素の総称。陽性の強い金属元素と典型的な塩類(イオン性化合物)をつくりやすいことから,ギリシア語のháls(塩)とgennáō(つくる)を合わせてつくられた語である。天然における存在量は塩素>フッ素>臭素>ヨウ素の順で,アスタチンは放射性元素なのでごく微量しか存在しない。性質は,無色・気体のフッ素から,黄緑色・気体の塩素,赤褐色・液体の臭素,黒紫色・固体のヨウ素を経て,金属性を帯びたアスタチンへと,きわめて系統的に変化する。0族元素より一つ原子番号(すなわち核の電荷,あるいは電子の数)が少ないので,一般に電子を取り入れて1価陰イオンになりやすく,そのため上記のように陽性の強い金属とはイオン性の強い化合物をつくる。また陽性の弱い金属や非金属とは共有性の化合物をつくるが,その中の化学結合は一般にかなり極性で,ハロゲン原子は多少とも陰電荷を帯びていることが多い。水素との化合物HX(Xはハロゲン)はHF(弱酸性)を除いては強酸性の水溶液を与え,酸の強さはHCl<HBr<HIの順で増加する。種々の酸化物やオキソ酸をつくり(たとえば塩素ではCl2O,Cl2O7,HClO,HClO2,HClO3,HClO4など),その中のハロゲンの酸化数はⅠ,Ⅲ,Ⅴ,Ⅶのいずれかのことが多い。またBrCl,BrF3,IF7など,種々の組成のハロゲンどうしの化合物(ハロゲン間化合物)や,I3⁻,I5⁻,I7⁻,ICl2⁻,BrF4⁻などのポリハロゲン化物イオンを含む化合物も知られる。
執筆者:曾根 興三
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「ハロゲン」の解説
ハロゲン
ハロゲン
halogens
周期表17族に属する元素で,フッ素,塩素,臭素,ヨウ素,アスタチンの5元素をいう.多くの金属ともっとも典型的な塩をつくるので,18世紀にフランスでギリシア語の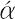 λα
λα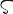 (halas)“塩”およびγενν
(halas)“塩”およびγενν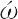 (genno)“つくる”にちなんでハロゲンと名づけられた.ハロゲン元素は化学的に活発なため,天然には単体で存在しない.塩素は天然に広く存在し,フッ素がこれにつぎ,臭素,ヨウ素ははるかに少なく,アスタチンは約30種の同位体が知られているが,もっとも寿命の長いもので半減期8.3 h の不安定な放射性元素で微量しか存在しない.ハロゲンは多くの有用な化合物をつくるので,非常に重要な元素である.この族の元素は化学的性質がよく似ており,原子番号の増加とともに,電気陰性度は減少し,融点,沸点は高くなる.単体はすべて二原子分子 X2 で有色,気体は刺激臭をもつ.常温でフッ素,塩素は気体で,臭素は液体,ヨウ素は固体である.これらの元素はすべてその最外殻の電子配置はs2 p5で,電子1個を得て一価の陰イオンになりやすく,陽性の元素とはイオン結合性の,陰性の元素とは共有結合性の化合物をつくる.反応性は原子番号の増加とともに減少する.とくにフッ素と塩素はしばしば金属や非金属を酸化し,臭素やヨウ素による酸化よりも高い酸化状態に変化させる.水溶液中で安定なフッ素の唯一の酸化数は-1で塩素,臭素,ヨウ素のおもな酸化数は-1,1,3,5,7である.種々のオキソ酸HXOnをつくり,すべて強い酸化剤である.化合物はハロゲン化水素,酸化物,ハロゲン化物の塩,ハロゲン間化合物などの無機化合物のほか,有機化合物に付加または置換反応を起こして多くの有機ハロゲン化物をつくる.放射性元素アスタチンを除くすべてのハロゲンは工業的に大規模に生産されていて,そのなかでは塩素の生産が群を抜いて多く,ヨウ素がそれに続いている.
(genno)“つくる”にちなんでハロゲンと名づけられた.ハロゲン元素は化学的に活発なため,天然には単体で存在しない.塩素は天然に広く存在し,フッ素がこれにつぎ,臭素,ヨウ素ははるかに少なく,アスタチンは約30種の同位体が知られているが,もっとも寿命の長いもので半減期8.3 h の不安定な放射性元素で微量しか存在しない.ハロゲンは多くの有用な化合物をつくるので,非常に重要な元素である.この族の元素は化学的性質がよく似ており,原子番号の増加とともに,電気陰性度は減少し,融点,沸点は高くなる.単体はすべて二原子分子 X2 で有色,気体は刺激臭をもつ.常温でフッ素,塩素は気体で,臭素は液体,ヨウ素は固体である.これらの元素はすべてその最外殻の電子配置はs2 p5で,電子1個を得て一価の陰イオンになりやすく,陽性の元素とはイオン結合性の,陰性の元素とは共有結合性の化合物をつくる.反応性は原子番号の増加とともに減少する.とくにフッ素と塩素はしばしば金属や非金属を酸化し,臭素やヨウ素による酸化よりも高い酸化状態に変化させる.水溶液中で安定なフッ素の唯一の酸化数は-1で塩素,臭素,ヨウ素のおもな酸化数は-1,1,3,5,7である.種々のオキソ酸HXOnをつくり,すべて強い酸化剤である.化合物はハロゲン化水素,酸化物,ハロゲン化物の塩,ハロゲン間化合物などの無機化合物のほか,有機化合物に付加または置換反応を起こして多くの有機ハロゲン化物をつくる.放射性元素アスタチンを除くすべてのハロゲンは工業的に大規模に生産されていて,そのなかでは塩素の生産が群を抜いて多く,ヨウ素がそれに続いている.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「ハロゲン」の意味・わかりやすい解説
ハロゲン
halogen
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「ハロゲン」の解説
ハロゲン
関連語をあわせて調べる
〘 名詞 〙 春の季節がもうすぐそこまで来ていること。《 季語・冬 》 〔俳諧・俳諧四季部類(1780)〕[初出の実例]「盆栽の橙黄なり春隣〈守水老〉」(出典:春夏秋冬‐冬(1903)〈河東碧梧桐・高...