翻訳|bromine
精選版 日本国語大辞典 「臭素」の意味・読み・例文・類語
しゅう‐そシウ‥【臭素】
改訂新版 世界大百科事典 「臭素」の意味・わかりやすい解説
臭素 (しゅうそ)
bromine
周期表ⅦB族に属するハロゲン元素の一つ。ブロムBromともいう。常温で液体となっている唯一の非金属元素。1824年にフランスのバラールA.J.Balardが地中海の海草からはじめて抽出し,26年にギリシア語の臭気bromosにちなんで命名された。同位体には74Brから88Brまで(77mBr,80mBr,82mBr,84mBrを含めて)19種が知られている。天然には単体としては存在せず,岩塩,岩石,海水(1l中に約67mgが含まれる),天然鹹水(かんすい),塩湖の水などに臭化物として含まれている。
性質
赤褐色で不快な刺激臭がある重い液体。気体はBr2分子から成り赤褐色。Br-Br結合距離は2.27Å。Br原子半径は1.14Å。Br⁻イオン半径は1.96Åと算定されている。液体の臭素はハロゲン化アンモニウム,各種有機化合物を溶解し,これらの溶液は多少イオン化される。水にわずかに溶け,次亜臭素酸HBrO,臭素水,臭化物イオンBr⁻,Br3⁻,Br5⁻などを生ずる。アルコール,エーテル,クロロホルム,二硫化炭素に溶けて赤色溶液となる。化学作用は塩素に似ているが塩素ほど激しくはない。水素とは常温では反応しないが,熱または光により化合する。オゾンとは激しく反応する。リンとは室温で激しく反応し,三臭化リン,五臭化リンを生ずる。カリウムとは容易に反応する。金は室温で容易に侵されるが,純粋な銀は安定,白金は比較的安定である。
製法・用途
工業的には溶液中に含まれる臭化物イオンを酸化して臭素を遊離させる。かつては原料として岩塩から食塩などを分離した母液や海水を濃縮した際の残液が用いられたが,今日では主として海水から直接臭素を得ている。この場合,海水中に含まれる臭化物イオンの酸化剤としては,おもに塩素が用いられ,生じた臭素は水蒸気あるいは空気により海水から抽出,分離される。臭素はしばしば塩素,ヨウ素を不純物として含み,これらは蒸留によっては容易に除くことができない。純粋な臭素を得るためには,まず臭素を臭化カリウム水溶液に溶かして蒸留して塩素を除く。ついでシュウ酸カリウムと反応させて臭化カリウムとし,ごく一部を酸化して臭素とし,加熱してヨウ素を蒸発。残りの臭化カリウムを二クロム酸カリウムと硫酸で酸化したのち蒸留し,水洗後乾燥して真空蒸留する。
酸化剤,臭素化剤,殺菌剤として用いられ,また各種の無機および有機臭化物が製造されて,農薬,難燃剤,医薬品,写真材料用などとして広く利用される。毒性が強く,激しく皮膚を侵し,蒸気は粘膜を刺激し催涙させる。
執筆者:大瀧 仁志
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「臭素」の解説
臭素
シュウソ
bromine
Br.原子番号35の元素.電子配置[Ar]3d104s24p5の周期表17族非金属元素.原子量79.904(1).ハロゲン元素の一つ.天然には質量数79(50.69(7)%),81(49.31(7)%)の安定核種があり,ほかに質量数67~97の放射性同位体がある.常温で液体である唯一の非金属元素で,1826年フランスの化学者A-B. Balardによってにがりのなかから発見された.英語名は悪臭を意味するギリシア語βρμο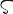 (bromos)に由来する.宇田川榕菴は天保8年(1837年)に出版した「舎密開宗」で,蒲羅密烏母(フロミウム)としている.
(bromos)に由来する.宇田川榕菴は天保8年(1837年)に出版した「舎密開宗」で,蒲羅密烏母(フロミウム)としている.
天然には単体として存在せず,主としてアルカリ金属およびアルカリ土類金属の臭化物として,塩素よりはるかに少量ではあるが塩素とともに存在する.また海水1 L 中に平均67 mg 含まれている.生産国はアメリカ(42%),ついでイスラエル(36%)(2007年),埋蔵量はアメリカ,フランス,スペインの順である.海水,にがり,かん水あるいは岩塩より食塩を分離した母液に塩素を通じてつくられる.単体は固相,液相,気相のいずれでも二原子分子 Br2 である.赤褐色の刺激性の液体.揮発しやすく,室温で赤褐色の蒸気を放つ.密度3.1226 g cm-3(液体20 ℃),7.59 g L-1(気体25 ℃).融点-7.2 ℃,沸点58.78 ℃.Br-Br0.22811 nm.第一イオン化エネルギー11.814 eV.Br- のイオン半径は0.196 nm.水100 g に対する溶解度は3.58 g(293 K)であるが,一方,臭素に対する水の溶解度は0.046%(293 K)と低い.臭化アルカリ溶液には三臭化物イオン Br3- となってよく溶ける.アルコール類,エーテル,ベンゼン,四塩化炭素などの一般の有機溶媒に易溶.塩素水より安定であるが,水溶液中では一部加水分解して次亜臭素酸と臭化水素酸を生じる.酸化数-1,1,3,5,7(例:HBr,HBrO,HBrO2,HBrO4).水素とは加熱または光照射によって反応してHBrを生成する.フッ素と反応してBrF,BrF3,BrF5などをつくり,塩素,硫黄とも反応してBrCl,S2Br2をつくる.酸化作用があり,アンモニアを N2 に,二酸化硫黄を硫酸に酸化する.Br- は Cl2 によって酸化され Br2 となり,Br2 は I- を I2 に酸化する.多くの金属と室温または高温で反応し臭化物をつくる.有機化合物に対しては酸化作用をもち,不飽和化合物には付加,また水素を置換する.
塩素より酸化力は弱いが,酸化剤,殺菌剤,臭素化剤として,また多くの無機,有機臭素製品の原料として用いられ,とくに写真材料,医薬品の原料として重要である.臭素化物難燃剤が電子機器・家電製品に多用されてきたが,EU・アメリカで規制が行われるようになり,生産量が減っている.液体臭素やその蒸気は触れると上気道,肺組織に障害を起こす.毒物劇物取締法・劇物指定.[CAS 7726-95-6][別用語参照]臭素の製造
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
日本大百科全書(ニッポニカ) 「臭素」の意味・わかりやすい解説
臭素
しゅうそ
bromine
周期表第17族に属し、ハロゲン元素の一つ。通称のブロムはドイツ語Bromからきている。1824年、フランスのバラールが海藻灰の中から発見、これに対しフランスアカデミーのボワボードランL. de Boisbaudran(1838―1912)とテナールが「悪臭」を意味するギリシア語bromosにちなんでbromineとすることを提案し、それが一般に受け入れられた(1826)。単体は天然には存在しない。海水中に臭化マグネシウムとして、地殻中にはアルカリ金属またはアルカリ土類金属の臭化物として存在する。臭化物に二酸化マンガンと硫酸を加えて熱するか、臭化物に塩素を作用させると得られる。工業的には、にがりと海水を原料として、塩素を吹き込んで単離する。赤褐色の液体。非金属元素の単体として室温で液体である唯一のもの。刺激性の有毒蒸気を出し、金属や有機物を侵す。反応性は塩素より弱いが、水素とは熱または光によって臭化水素を生成する。リン、ヒ素、スズ、アルミニウムとは激しく化合する。金とも化合するが、白金とは作用しない。水に溶けて臭素水をつくり、アルコール、クロロホルム、二硫化炭素などの有機溶媒に溶けて赤色溶液となる。水溶液からは低温で水和物Br2・8H2Oが得られる。アルカリ性水溶液は、低温で臭化物と次亜臭素酸塩に、高温では臭化物と臭素酸塩に不均化する。
酸化剤、臭素化剤として使われるほか、農薬(臭化メチルなどの殺線虫剤)の製造、エチル液(テトラエチル鉛の掃鉛剤)、医薬、塗料、難燃剤、香料、臭素化合物などの製造に用いられる。皮膚につくと炎症をおこすので取扱いには注意を要する。
[守永健一・中原勝儼]
臭素(データノート)
しゅうそでーたのーと
臭素
元素記号 Br
原子番号 35
原子量 79.904
融点 -7.2℃
沸点 58.78℃
比重 液体 3.10(測定温度25℃)
(密度) 気体 7.59g/dm3
結晶系 固体 斜方
溶解度 3.58g/100mL(水20℃)
元素存在度 宇宙 20.6(第35位)
(Si106個当りの原子数)
地殻 2.5ppm(第48位)
海水 67mg/dm3
ブリタニカ国際大百科事典 小項目事典 「臭素」の意味・わかりやすい解説
臭素
しゅうそ
bromine
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「臭素」の意味・わかりやすい解説
臭素【しゅうそ】
出典 株式会社平凡社百科事典マイペディアについて 情報
栄養・生化学辞典 「臭素」の解説
臭素
世界大百科事典(旧版)内の臭素の言及
【海水】より
…主要イオンの組成は一定であるから,これらの主要元素濃度のいずれもが塩分と比例関係にある。そこで,実際に塩分を求める場合には海水中の主要成分を全部測定するのではなく,最も量が多く定量の容易な塩素イオン(臭素イオン,ヨウ素イオンを含む)を測定して比例係数を乗じて塩分を代表させる方法が,海洋観測の常法となっていた。すなわち,塩分Sは塩素量Clから S(‰)=1.80655Cl(‰)の関係式で求めた。…
※「臭素」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...



