精選版 日本国語大辞典 「リチウム電池」の意味・読み・例文・類語
リチウム‐でんち【リチウム電池】
日本大百科全書(ニッポニカ) 「リチウム電池」の意味・わかりやすい解説
リチウム電池
りちうむでんち
Lithium cell
Lithium battery
負極活物質にリチウムLiを使用する電池の総称で、一次電池と二次電池(蓄電池)がある。また二酸化マンガンリチウム一次電池をさすことがある。リチウムは電気化学的に卑(ひ)な電位をもつ(イオン化傾向の大きな)金属であるだけでなく、金属中でもっとも軽量であることから高い作動電圧をもち、高エネルギー密度の電池を作製することができる。しかしリチウムは水と激しく反応するため電解質には水溶液系を使用することができない。そのため、一次電池ではリチウム電解質塩を有機溶媒に溶解した有機電解液が用いられ、また二次電池では有機電解液のほか、ゲル高分子電解質や固体高分子電解質、ガラス系電解質のような固体電解質、それに溶融塩電解質などが使用されている。
[浅野 満]
リチウム一次電池
負極活物質にはすべてリチウム金属が使用されるので、正極活物質に使用する材料の名を冠して命名されている。二酸化マンガンリチウム一次電池、フッ化黒鉛リチウム一次電池、塩化チオニルリチウム一次電池、酸化銅リチウム一次電池、二硫化鉄リチウム一次電池、ヨウ素リチウム一次電池などがある。これらは公称電圧が3.0ボルトかそれ以上高いものもあり、マンガン乾電池やアルカリマンガン電池などの一次電池に比べてエネルギー密度が数倍で、貯蔵寿命が長く、長期耐用性があり、低温特性と耐漏液性に優れている。
日本では、1973年(昭和48)松下電器産業(現、パナソニック)により円筒形フッ化黒鉛リチウム一次電池が、そして1975年三洋電機によりコイン形二酸化マンガンリチウム一次電池が世界に先駆けて開発・販売された。これらの一次電池はそれぞれの特性を生かし広い分野で使用されている。2002年における全一次電池に対するリチウム一次電池の生産額比率は33%で、アルカリマンガン電池に次いで多い。リチウム一次電池は負極に化学的に活性なリチウム金属を使用し、また有機電解液などの可燃性材料を使用しているので、従来の1.5ボルトの水溶液系電解液を用いるものに比べて、その取り扱いには十分注意する必要がある。
[浅野 満]
二酸化マンガンリチウム一次電池
負極には一般にシート状リチウム金属が使用され、その電極反応は
Li―→Li++e-
で、これはリチウム一次電池すべてに共通している。二酸化マンガンMnO2正極反応は
Mn(Ⅳ)O2+Li++e-
―→(Li+)Mn(Ⅲ)O2
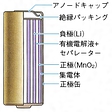
で示される。Mn(Ⅳ)O2へLi+イオンが挿入する反応であり、Mnは4価から3価に還元される。公称電圧は3.0ボルト、エネルギー密度は308Wh/kg、450~650Wh/lである。電解液には一般にプロピレンカーボネート(PC)、エチレンカーボネート(EC)、ブチレンカーボネート(BC)などの1種または2種と1、2‐ジメトキシエタン(DME)との混合溶媒に、電解質塩として過塩素酸リチウムLiClO4を溶解したものが用いられる。セパレーターにはポリエチレンやポリプロピレンなどのポリオレフィン系樹脂微多孔膜が用いられている。
もっとも早く実用化されたコイン形のほか、円筒形、および円筒形を2個パックにしたものがあり、円筒形には誤使用時の内圧上昇に対する安全対策や過電流防止対策などが施されている。高電圧、高エネルギー密度という特徴を生かし、時計、カメラ、電卓、ゲーム機、通信機器、メモリーバックアップ用などの電源に用いられている。電子時計では5~10年間の連続使用が可能になった。
当初はMnO2を正極活物質に用いることは困難とされていたが、400℃前後で熱処理して無水に近いMnO2とすることによりリチウム一次電池に使用することが可能となった。その工学的意義は大きい。安価に製造できるのでリチウム一次電池の主流となっており、生産量の90%以上を占めている。二酸化マンガンリチウム電池、マンガンリチウム電池、あるいは単にリチウム電池と表示されている。
[浅野 満]
フッ化黒鉛リチウム一次電池
フッ化黒鉛(CF)nが正極活物質に用いられており、その電極反応は一般に
(CF)n+nLi++ne-―→nLiF+nC
で示され、(CF)nの層間へのLiの挿入反応である。しかしこの反応の熱力学的起電力は約4ボルトと高すぎて実状とあわないため、
(CF)n+nxLi++nxe-―→n(CLixF)
のような中間生成物を考えたほうがよいといわれている。公称電圧は3.0ボルト、エネルギー密度は約320Wh/kg、570Wh/lである。電解液はγ(ガンマ)‐ブチルラクトン、PC、DMEなどに四フッ化ホウ酸リチウムLiBF4を溶解したものである。ポリプロピレン製の不織布セパレーターが用いられている。二酸化マンガンリチウム一次電池に比べて高負荷放電特性などが若干劣るものの、正極反応生成物の炭素により導電性が保持され、電圧の平坦(へいたん)性がよい。とくに長期間の貯蔵性や作動の信頼性が高く、長寿命である。密封構造の円筒形、コイン形、ピン形、パック形があり、時計、電卓、電気浮き、ガス遮断安全装置、メモリーバックアップ用などの電源として普及している。
[浅野 満]
塩化チオニルリチウム一次電池
1970年代初めにアメリカを中心に開発された。正極活物質の塩化チオニルSOCl2は液体であり、電解質塩として用いられる四塩化アルミニウムリチウムLiAlCl4の溶媒も兼ねている。したがって電池中では負極活物質のLiと接触するが、両者の反応によりLi負極面に生成する塩化リチウムLiCl被膜が固体電解質として機能している。正極反応は
2SOCl2+4Li++4e-―→4LiCl+S+SO2
で、公称電圧は3.6ボルトと高く、またエネルギー密度は1000Wh/lである。完全密閉構造となっており、放電電圧はきわめて平坦で、メモリーバックアップ、ガスメーター、軍用などの用途がある。
[浅野 満]
酸化銅リチウム一次電池
酸化銅CuO正極の電極反応は
CuO+2Li++2e-―→Cu+Li2O
で、公称電圧は1.5ボルトである。酸化銀電池やアルカリマンガン電池の代替用として円筒形やボタン形のものが腕時計や軍用に用いられていたが、現在ではほとんど使用されていない。
[浅野 満]
二硫化鉄リチウム一次電池
正極の二硫化鉄FeS2の電極反応は
FeS2+4Li++4e-―→Fe+2Li2S
で示され、公称電圧は1.5ボルトでマンガン乾電池やアルカリマンガン電池の高容量代替用として円筒形がおもにカメラ用に市販された。
[浅野 満]
リチウム二次電池
一次電池の負極にはリチウム金属が用いられているが、二次電池の負極としては充放電の可逆性に課題が多いため、実用二次電池ではリチウムを吸蔵させた炭素材料やリチウム合金、リチウムと遷移金属との複合酸化物などが用いられ、可逆的に反応が進むようにくふうされている。一方これらの負極と組み合わせる正極にはリチウムを含有する遷移金属酸化物、金属硫化物、導電性高分子、硫黄(いおう)、有機硫黄化合物、リン酸塩などが用いられる。リチウム二次電池は、高放電電圧の高エネルギー密度二次電池として広い分野で使用され、より優れた性能を目ざして新しい電極材料や電解質塩、有機溶媒などの研究開発が活発に行われている。2002年における全蓄電池に対するリチウム二次電池のシェアは48%であり、今後さらに増加するものと思われる。
[浅野 満]
リチウムイオン二次電池
1991年(平成3)にソニーにより実用化された。それは負極にリチウムを挿入脱離できる黒鉛CyLixを、正極にはコバルト酸リチウムLi1-xCoO2を用い、リチウム電解質塩を溶解した有機電解液を使用するものである。放電反応は
(負極)
CyLix―→Cy+xLi++xe-
(正極)
Li1-xCoO2+xLi++xe-
―→LiCoO2
(全体)
Li1-xCoO2+CyLix
―→LiCoO2+Cy
で、放電可能な範囲は0<x<0.5である。充電反応はこの逆に進行する。充放電すると層状物質の黒鉛負極とLi1-xCoO2正極間をLi+イオンが移動して挿入脱離するだけで、溶解析出はなく、有機電解液は濃度変化がないので必要最小限の量でよい。このような反応メカニズムの電池はリチウムイオン二次電池とよばれている。
負極材料の炭素には、天然黒鉛のような結晶性の高いものから難黒鉛化性炭素(ハードカーボン)のように結晶性の低いものなど多くの種類が用いられている。正極のLi1-xCoO2はCoが高価なので、資源のより豊富で安価なニッケル酸リチウムLi1-xNiO2もよく研究されているが、2001年現在実用化されているのはLi1-xCoO2とマンガン酸リチウムLixMn2O4である。検討中の正極材料には、リン酸鉄リチウムLiFePO4、置換バナジウム酸リチウムLiMVOx,(M=Cu, Zn, Cd…)、置換ホウ酸リチウムLiMBO3,(M=Mn, Fe, Co…)などがある。有機電解液にはエチレンカーボネート(EC)またはプロピレンカーボネート(PC)とジメチルカーボネート(DMC)、メチルエチルカーボネート(MEC)、あるいはジエチルカーボネート(DEC)との混合溶媒に電解質塩として六フッ化リン酸リチウムLiPF6やビス(トリフルオロメタンスルホニル)イミドリチウムLiN(CF3SO2)2などを溶解したものを使用する。そしてセパレーターにはポリエチレンなどのポリオレフィン系多孔膜が、正極と負極間の隔離と有機電解液の保持を兼ねて用いられている。有機電解液のイオン導電率は、ニッケル水素蓄電池などに使用されるアルカリ水溶液電解液と比べて約102倍低いので、電極板やセパレーターは薄く長くして放電特性の改善が図られている。使用温度範囲はマイナス20~60℃と広く、自己放電率は小さい。
円筒形と角形があり、公称電圧は正極がLi1-xCoO2では3.6ボルト、またLixMn2O4では3.7ボルトと高い。エネルギー密度は130~150Wh/kg、320~390Wh/lで、ニッケルカドミウム蓄電池の約3倍、ニッケル水素蓄電池の約1.5倍である。
日本のメーカーがリチウムイオン二次電池の全世界の需要の大部分をまかなっていて、携帯電話、ノートパソコン、カメラ一体形VTR、ミニディスクプレーヤーなどの移動用電子機器に用いられており、それらの飛躍的発展をもたらした。また2000年(平成12)にはLixMn2O4を正極に用いたリチウムイオン二次電池を搭載したハイブリッド・カー「ティーノ」が日産自動車から限定販売された。
[浅野 満]
金属酸化物負極を用いるリチウムイオン二次電池
Li+イオンの挿入脱離を伴う充放電反応に対して結晶構造が安定な遷移金属酸化物負極材料として、アナターゼ形二酸化チタンa-TiO2にLiを挿入させた欠損スピネル構造のチタン酸リチウムLi4/3Ti5/3O4が開発された。マンガン酸リチウムLixMn2O4を正極として、有機電解液を用いるコイン形のリチウムイオン二次電池が1994年から製造販売されている。作動電圧は1.5~1.2ボルトで、エネルギー密度は40Wh/lであり、炭素材料を負極に用いるものより小さいが、電池容量の100%を2000回以上充放電することが可能であり、また過放電に耐え、充電電圧が1.6~2.6ボルトの間で自由に設定できるという特徴がある。そのため高エネルギー密度よりも安全性と信頼性が要求されるソーラー時計、コードレスソーラーディスプレーなどの長期バックアップ電源に用いられている。
そのほか実用化されているものには、単斜晶系の五酸化ニオブNb2O5負極と層状の五酸化バナジウムV2O5正極を用いたコイン形のものが1991年から市販されている。放電電圧は1.8~1.0ボルトでエネルギー密度は47Wh/lであり、充放電サイクル特性がよい。またNb2O5負極とLiCoO2正極を用いるものが知られており、放電電圧は2.8~1.5ボルト、エネルギー密度は107Wh/lと大きい。非晶質系酸化物負極としてスズ複合酸化物SnB0.5P0.5O3がある。1996年には正極としてLiCoO2を組み合わせた円筒形が試作されており、放電電圧は3.5ボルト、エネルギー密度は135Wh/kg、380Wh/lである。また非晶質のリチウムケイ素複合酸化物Li4SiOを負極に用い、正極にLixMn2O4を使用したもの(電池電圧3.0ボルト)と、Li4/3Ti5/3O4を使用したもの(電池電圧1.5ボルト)が1998年に実用化されている。さらに窒化物系のLi3-xMxN(M=Co, Ni, Cu)負極が研究されている。
[浅野 満]
置換マンガン酸リチウム正極を用いるリチウムイオン二次電池
正極材料に用いられるLiMn2O4のMnの一部をほかの遷移金属で置換して置換スピネル形マンガン酸リチウムLiMn2-xMxO4(M=Ti, Cr, Fe, Co, Ni, Cu, Zn)とすると、スピネル構造が安定化し、サイクル特性や保存特性を改善することができる。また、これらの置換形のうちCoで置換したLiCoMnO4は、Li負極に対して4ボルト付近だけでなく5ボルト付近でも平坦な放電電圧を示し、LiNi0.5Mn1.5O4も4.7ボルトを示すことがわかり、大きな関心がもたれている。LiCoO2正極に比べ容量と充放電サイクル特性に劣るが、高電圧に耐える有機電解液が開発できれば、リチウムイオン二次電池の高電圧化による高エネルギー密度化を図ることができるため、いっそうの研究開発が期待されている。
[浅野 満]
ゲル高分子電解質を用いるリチウムイオン二次電池
携帯電子機器の小形化に伴い、リチウムイオン二次電池をさらに小形、軽量、薄形化するため、ゲル状の高分子電解質を用いたものが1999年に実用化された。通常のリチウムイオン二次電池では有機電解液が使用されており液漏れの危険がある。そこで密封化するために液体電解質にかえてゲル高分子電解質を用い、また容器にも鉄缶やアルミニウム缶のかわりにアルミラミネートフィルムを使用して軽量化が図られた。このゲル高分子電解質はゲル高分子とリチウム電解質塩に可塑剤として有機溶媒を添加して作製したもので、室温におけるLi+イオン導電率は約10-3S/cmと有機電解液の5×10-3S/cmに近い。正負両極の活物質には通常のリチウムイオン二次電池に用いられている材料と同じものを使用することが多い。
ゲル高分子電解質用の高分子には一次元直鎖高分子のポリエチレンオキシド(PEO)やポリフッ化ビニリデン(PVdF)、ポリアクリロニトリル(PAN)、PVdF‐ポリヘキサフルオロプロピレン(PHFP)共重合体などが用いられ、リチウム電解質塩にはLiPF6やLiN(CF4SO2)2、トリフルオロメタンスルホン酸リチウムLiCF3SO3が、そして有機溶媒にはECとDMCまたはEMCとの混合溶媒が主として使用されている。また一次元直鎖高分子の耐熱性や機械的強度などを向上させるために、アクリル系モノマーをリチウム塩と有機溶媒に混合したのち重合させた三次元化学架橋ゲル高分子電解質が研究されている。
正負両極内におけるLi+イオンの移動と伝導性をよくするために、あらかじめ両極活物質のそれぞれをゲル高分子電解質と混練して作製した電極が用いられる。また正負電極とゲル高分子電解質薄膜との密着性をよくするため、さまざまなくふうがされている。
ゲル高分子電解質を用いたリチウムイオン二次電池は通常の有機電解液を使用したものと同等の電池特性を有し、たとえば黒鉛|ゲル高分子電解質|LiCoO2構成のものでは放電電圧として3.6~3.7ボルトが得られる。薄形で柔軟性のあるタイプを作製できるので、ノートパソコンや携帯電話などの軽量、小形化に寄与している。
[浅野 満]
固体高分子電解質を用いるリチウム二次電池
高分子電解質には、有機溶媒を使用せず、ポリエチレンオキシド系共重合体に電解質塩としてLiN(CF3SO2)2を添加して作成した真性の固体高分子電解質がある。室温におけるLi+イオン導電率はゲル高分子電解質に比べて2桁(けた)以上低くなるが、60℃以上で十分な導電率が得られるため高温形リチウム二次電池といわれる。負極にリチウム金属を用いることが可能で、正極に酸化バナジウムVOxを用い、Li|固体高分子電解質|VOxの3層を一体化し、外装にラミネートフィルムを用いた全固体形リチウム二次電池では、60℃で放電電圧2.5~2.3ボルトが得られ、出力密度は400Wh/kg以上、エネルギー密度は300Wh/kgを超える。可塑剤として有機溶媒を使用していないので、貯蔵性、安全性、信頼性が高く、室温作動させる必要のない分野で実用化されよう。
この二次電池は固体高分子電解質の開発が鍵(かぎ)を握っており、室温作動の高イオン導電性高分子電解質が開発されれば、全固体形リチウム二次電池の実現へ一歩近づくことができる。
[浅野 満]
高分子正極を用いるリチウム二次電池
2000年現在、実用化されているリチウム二次電池の電極活物質には炭素や合金、金属酸化物などの無機物質が用いられているが、共役二重結合をもった導電性高分子を用いることができる。たとえば、電解質塩にLiClO4を用いた場合、充電時にはClO4-アニオンが高分子正極にドープ(添加)され、同時にLi+カチオンが負極にドープされる。ここで高分子正極活物質を(P)nで表すと正極の充電反応式は以下のようになる。
(P)n+nxClO4-
―→[Px+(ClO4-)x]n+nxe-
また放電時には正極からClO4-アニオンが、そして負極からはLi+カチオンが有機電解液中へ放出されるという逆の反応が生じ、ClO4-もドーパント(添加物)となる。Li+カチオンだけでなくClO4-アニオンも電極反応に関与しており、リチウムイオン二次電池とは充放電反応が異なる。また充放電により有機電解液濃度が大きく変化するのでエネルギー密度を大きくできないという欠点があり、現状では小容量のコイン形に限られている。
正極用導電性高分子には当初ポリアセチレンが研究されたが、劣化しやすいので、その後ポリピロール、ポリチオフェン、ポリアセンなどが検討された。そして1991年にはポリアセン系有機半導体(PAS)を使用したLiPAS負極|LiPAS正極構成のものがカネボウとセイコーインスツルメンツより市販された。ポリアセンはフェノール樹脂などを700℃以下の低温で焼成した炭化過程の炭素材料である。公称電圧は2.5ボルトであるが、放電に伴う電圧変化が比較的大きい。コイン形がメモリーバックアップ用に用いられている。高分子であるため薄形化が可能であり、電力をあまり必要としない分野での利用に有効である。なお、1987年(昭和62)にはリチウムアルミニウム合金|ポリアニリン系のコイン形がブリヂストンとセイコーインスツルメンツにより実用化されたが、現在は生産されていない。
[浅野 満]
有機硫黄化合物正極を用いるリチウム二次電池
有機ジスルフィド化合物(SRS)は分子内にチオレート基(‐SM、M=H, Liなど)を二つ以上もっており、充電(酸化)すると高分子化して‐(SRS)n‐となり、放電(還元)によりSRSモノマーに戻る。したがって、この性質を利用して正極とし、Li負極と組み合わせてリチウム二次電池とすると、95℃で3.0~2.5ボルトの放電電圧が得られる。またSRS正極の酸化還元反応速度を速めて室温で使用可能とするためポリアニリンと複合化すると、3.4~3.2ボルトに作動電圧を高めることができる。さらに‐(SRS)n‐のRを炭素原子としたポリカーボンジスルフィド化合物(CSx)n(x=1.2~2.3)を導電性高分子と複合化して正極とすると2.4~1.7ボルトの放電電圧が得られ、硫黄単体/導電剤複合系を正極に用いても2.0ボルトの放電電圧が得られるので、これらの構成によりリチウム二次電池を作製できる。
[浅野 満]
リチウムアルミニウム合金負極を用いるリチウム二次電池
リチウム二次電池として最初に実用化されたものは、負極にリチウムアルミニウムLiAl合金を用いたコイン形で、リチウムイオン二次電池よりも早い1988年のことである。代表的なものとして負極にLiAl合金、正極に三洋電機で開発された改質二酸化マンガン(CDMO)を用いたリチウム二次電池がある。
MnO2には種々の結晶構造のものがあるが、γ‐MnO2がリチウム一次電池の正極に用いられている。しかし二次電池の正極として充放電を繰り返すと劣化してしまうので、γ‐MnO2とLi2MnO3を複合化させたCDMOが用いられている。また負極のLiAl合金のLi原子比は約50%で、第3成分としてMnなどを加えて充放電による微粉化を抑制してサイクル特性の改善が図られている。
CDMOを便宜上Mn(Ⅳ)O2で表すと、放電反応は
(負極)
LiAl―→Li++Al+e-
(正極)
Mn(Ⅳ)O2+Li++e-
―→Mn(Ⅲ)O2(Li)
(全体)
Mn(Ⅳ)O2+LiAl
―→Mn(Ⅲ)O2(Li)+Al
で示され、公称電圧は3.0ボルトである。充電反応はこの逆となる。自己放電率が非常に小さく、5年間放置しても約90%の容量がある。コイン形が主としてメモリーバックアップ用に使用されている。
一方、LiAl合金負極を用いる高温形リチウム二次電池がアメリカのアルゴンヌ国立研究所で1970年代から研究され始めた。当初はLi金属が用いられたこともあったが、融点が低いためにLiAl合金とし、正極には二硫化鉄FeS2、電解質に塩化リチウムLiCl‐臭化リチウムLiBr‐臭化カリウムKBr系溶融塩(共融温度320℃)を用いるもので、作動温度は400~450℃である。放電反応は
(負極)
LiAl―→Li++Al+e-
(正極)
FeS2+4Li++4e-―→2Li2S+Fe
(全体)
FeS2+4LiAl―→2Li2S+Fe+4Al
で、充電反応はこの逆である。開回路電圧は1.55ボルト、またセルを積み重ねたセルスタックではエネルギー密度は180Wh/kg、出力密度は400Wh/kgに達する。電気自動車用二次電池として開発が進められたこともあったが、現在では中止されている。そのほかの高温形としてLiAl負極|LiCl-KCl溶融塩電解質|Fe3O4正極構成の二次電池が研究されたが、サイクル特性に難がある。
負極に用いることのできるリチウム合金にはLiAl合金以外にマグネシウム、銀、鉛、ビスマス、カドミウム、ゲルマニウムとリチウムとの合金やリチウムウッド合金などが知られている。またMg2SnやSn-Ca系などを負極に用いることが検討されている。
[浅野 満]
薄膜形固体リチウム二次電池
正リン酸リチウム(Li3PO4)を窒素ガス中でスパッタリング(イオンを照射して発散した物質を付着させること)して作製したリチウムリンオキシ窒化物(LixPO4-yNy)薄膜を固体電解質に用いる数マイクロメートル厚さの薄膜形固体リチウム二次電池が1993年にアメリカのオークリッジ国立研究所とケンタッキー大学との共同で開発された。これはLi負極、LixPO4-yNy電解質、V2O5正極の各薄膜を順次析出させて作製するもので、3.7~1.5ボルトレンジで100μA/cm2の放電電流密度が得られている。このほか、ヨウ化リチウム‐五酸化リン‐五硫化リン系ガラス状固体電解質と、二硫化チタンTiS2正極およびLi負極を組み合わせた薄膜固体リチウム二次電池などが研究されている。
[浅野 満]
『高村勉・佐藤祐一著『ユーザーのための電池読本』(1988・コロナ社)』▽『池田宏之助著『電池の進化とエレクトロニクス――薄く・小さく・高性能』(1992・工業調査会)』▽『池田宏之助編著、武島源二・梅尾良之著『「図解」電池のはなし』(1996・日本実業出版社)』▽『小久見善八監修『新規二次電池材料の最新技術』(1997・シーエムシー)』▽『西美緒著『リチウムイオン二次電池の話――ポピュラー・サイエンス』(1997・裳華房)』▽『日本電池株式会社編『最新実用二次電池 その選び方と使い方』(1999・日刊工業新聞社)』▽『小久見善八監修『最新二次電池材料の技術』普及版(1999・シーエムシー)』▽『芳尾真幸・小沢昭弥編『リチウムイオン二次電池 材料と応用』(2000・日刊工業新聞社)』▽『小久見善八編著『電気化学』(2000・オーム社)』▽『電気化学会編『電気化学便覧』(2000・丸善)』▽『電池便覧編集委員会編『電池便覧』(2001・丸善)』▽『小久見善八・池田宏之助編著『はじめての二次電池技術』(2001・工業調査会)』▽『『新型電池の材料化学 季刊化学総説No.49』(2001・学会出版センター)』▽『金村聖志編『21世紀のリチウム二次電池技術』(2002・シーエムシー出版)』
化学辞典 第2版 「リチウム電池」の解説
リチウム電池
リチウムデンチ
lithium battery
リチウムイオン Li+ が電極反応に関与している電池.旧来は金属リチウムを負極とする一次電池および二次電池のことをリチウム一次電池,リチウム二次電池とよび,それらの総称をリチウム電池とよんでいた.しかし,1990年代に入り,金属リチウムを用いず,リチウムを含む化合物をそれぞれ正極・負極に用いたリチウムイオン電池が実用化されると,それらを含めてリチウム電池と称するようになった.リチウムは非常に軽く,酸化還元電位が水素標準電極に対して-3.04 V と非常に低いため,適切な正極材料を用いることにより,電池1個当たり3 V 以上の放電電位が得られ,単位重量当たりでは非常にエネルギー密度の高い電池を構成することが原理的に可能である.負極を金属リチウムとし,正極材料をAとすると,リチウム一次電池の放電反応の電極反応式は下記のとおりとなる.
負極 xLi → xLi+ + xe-
正極 A + xLi+ + xe- → LixA
全体 A + xLi → LixA
金属リチウムを負極,酸化物あるいは硫化物を正極,リチウム塩を有機溶媒に溶解させた有機電解液を負極とするリチウム一次電池が1960年代より検討されはじめ,1970年代に実用化された.現在でも,電卓や時計の電源として用いるコイン型や,カメラ用の円筒型のリチウム一次電池が広く用いられている.リチウム二次電池に関しても,1960年代より研究が開始され,1980年代に負極に金属リチウムを用いたものが一時期実用化されたことがあるが,安全性および可逆性の問題から使用されなくなった.その後,1990年代に入り,金属リチウムを一切用いないリチウムイオン二次電池が実用化され,ノートパソコン,携帯電話などの携帯機器用の電源として幅広く用いられるようになった.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
改訂新版 世界大百科事典 「リチウム電池」の意味・わかりやすい解説
リチウム電池 (リチウムでんち)
lithium cell
リチウムを陰極に用いた電池。リチウムは金属のなかで最も軽く,標準電極電位も-2.91V(水素電極基準)と最も卑なので,リチウムを陰極に用いた電池は起電力が大で,軽量であることが大きな特徴である。高エネルギー密度の小型電池として将来の用途が注目されており,現在のところ電子機器用電源,ペースメーカー用電源などに用いられている。しかしリチウムは水と激しく反応して水素を発生するので,電解質には水溶液を用いることができず,プロピレンカーボネートなどの有機質非プロトン性溶媒に過塩素酸リチウムLiClO4などの電解質を溶解させた非水溶液,あるいはヨウ化リチウムLiIなどの固体電解質が用いられる。表におもなリチウム一次電池を示す。硫化チタンTiS2などを陽極活物質に用いた電池は放電時にその結晶にLi⁺が侵入し,充電すると可逆的にLi⁺が電解質中へ追い出されるので,二次電池としての可能性が研究されている。また,リチウム-水系の注水電池の開発も行われている。
執筆者:笛木 和雄
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
百科事典マイペディア 「リチウム電池」の意味・わかりやすい解説
リチウム電池【リチウムでんち】
出典 株式会社平凡社百科事典マイペディアについて 情報
関連語をあわせて調べる
冬に 4日間暖かい日が続くと 3日間寒い日が続き,また暖かい日が訪れるというように,7日の周期で寒暖が繰り返されることをいう。朝鮮半島や中国北東部の冬に典型的な気象現象で,日本でもみられる。冬のシベリ...