改訂新版 世界大百科事典 「酸化銀」の意味・わかりやすい解説
酸化銀 (さんかぎん)
silver oxide
化学式Ag2O。褐黒色固体。銀塩の水溶液に水酸化ナトリウムを加えると沈殿して生ずる(このとき水酸化銀は生成しない)。銀板は空気中に放置しても表面に酸化物の薄膜が生成するのみで,それ以上は酸化されない。結晶は,銀原子のみをみると面心立方に,また酸素原子のみで体心立方に配列し,この2種の格子が互いに入り組んでAg2Oの格子をつくっている構造で,酸素原子が4個の銀原子によって正四面体形にとりかこまれ,原子間距離はAg-O=2.043Å,Ag-Ag=3.336Åとなっている。銀は貴金属の一種であるから,酸化物はあまり安定でない。光によって室温でも分解し,加熱すると160℃で分解して酸素を発生しはじめ,250℃では速やかに分解が進む。また他の金属,水素ガス,一酸化炭素,ヒドラジン,有機還元剤でたやすく還元される。オゾンや過酸化水素にも酸化剤として作用し,容易に金属銀となる。塩基性酸化物で,湿った状態で二酸化炭素を吸収する。水に対する溶解度は小さい(25℃で27mg/l)。アンモニア水に溶けやすいが,これを長時間放置すると黒色沈殿を生ずる。これは窒化銀Ag3Nであって,きわめて爆発性が強く危険性が大きい。硝酸銀のアルカリ性溶液をペルオキソ二硫酸カリウムで酸化するとAgOの組成のものが得られるが,これは2価銀の化合物ではなくAgⅠAgⅢO2の混合酸化状態の化合物と考えられている。これは灰色粉末で比重7.483(25℃)。100℃に加熱すると銀と酸素とに分解する。反磁性で半導体性をもつ。強い酸化剤。皮膚,目,呼吸器官に対し刺激性が強い。
執筆者:水町 邦彦
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「酸化銀」の意味・わかりやすい解説
酸化銀
さんかぎん
silver oxide
酸素と銀の化合物。普通、酸化銀というときは酸化銀(Ⅰ)をさすが、そのほかに一酸化銀(誤って過酸化銀とよばれることもある)も知られている。
(1)酸化銀(Ⅰ) 硝酸銀の濃水溶液に水酸化ナトリウムの希水溶液を加えて得られる暗褐色粉末。熱および光に対して不安定で、熱すると約160℃で分解し始め、250~300℃で急激に分解して酸素を放ち金属銀となる。水にわずかに溶け(水100gに0.00214g溶ける)、エタノール(エチルアルコール)に不溶。希硝酸、アンモニア水に溶ける。水溶液は強いアルカリ性で、空気中から二酸化炭素を吸収する。
(2)一酸化銀 銀にオゾンを作用させるか、硝酸銀水溶液にペルオキソ二硫酸塩(NH4)2S2O8を反応させて得られる。灰黒色粉末。AgOと書かれるが、銀(Ⅱ)の酸化物ではなく、Ag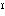 Ag
Ag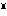 O2のような銀(Ⅰ)と銀(Ⅲ)の混合酸化物であるとされている。式量123.9。比重7.48。冷水に不溶、アンモニア水に溶ける。もっとも強い酸化剤の一つである。
O2のような銀(Ⅰ)と銀(Ⅲ)の混合酸化物であるとされている。式量123.9。比重7.48。冷水に不溶、アンモニア水に溶ける。もっとも強い酸化剤の一つである。
[中原勝儼]
酸化銀(データノート)
さんかぎんでーたのーと
酸化銀(Ⅰ)
Ag2O
式量 231.8
融点 300℃(分解)
比重 7.22
結晶系 立方
化学辞典 第2版 「酸化銀」の解説
酸化銀
サンカギン
silver oxide
【Ⅰ】酸化銀(Ⅰ):Ag2O(231.74).硝酸銀などの可溶性な銀塩水溶液に,アルカリ金属またはアルカリ土類金属の水酸化物を加えると暗褐色の沈殿として得られる.等軸晶系.密度7.48 g cm-3.水に対する溶解度は2.5×10-2 g L-1.溶液はリトマス紙に対してアルカリ性を示す.加熱すると酸素を放出して,300~340 ℃ で完全に分解して単体の銀になる.湿った沈殿を乾燥すると酸素を一部放出し,銀と酸化銀の混合物が得られる.硝酸およびアンモニア水に可溶.アンモニア水中に長時間置くと爆発性の黒色の粉末(雷銀:主成分AgN3)を生じる.有機合成のヒドロキシ基導入剤,触媒,ガラスの着色,導電性ガラスの製造,医療などに用いられる.[CAS 20667-12-3]【Ⅱ】酸化銀(Ⅱ):AgO(123.87).アルカリ水溶液の陽極酸化(銀を極とする)か,酸化銀(Ⅰ)に強い酸化剤を作用させると得られる.銀粉とオゾンでは過酸化銀Ag2O2が得られる.酸化銀-亜鉛アルカリ電池に用いられる.[CAS 1301-96-8]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「酸化銀」の意味・わかりやすい解説
酸化銀
さんかぎん
silver oxide
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

