精選版 日本国語大辞典 「過酸化水素」の意味・読み・例文・類語
かさんか‐すいそクヮサンクヮ‥【過酸化水素】
改訂新版 世界大百科事典 「過酸化水素」の意味・わかりやすい解説
過酸化水素 (かさんかすいそ)
hydrogen peroxide
化学式H2O2。1818年にフランスのテナールLouis Jacques Thénard(1777-1857)によって過酸化バリウムと塩酸から初めて得られた化合物。無色,オゾン臭のある油状の液体で,融点-0.89℃,沸点151.4℃,比重1.46(0℃)。白金,パラジウム,二酸化マンガンなどの粉末,粗い面をもつ固体,アルカリ,血液中の酵素カタラーゼ,さらにふつうの塵埃(じんあい)など,きわめて多様な物質が触媒となって容易に分解し,水と酸素になる。
2H2O2─→2H2O+O2
しかし,まったくこれらの異物との接触を断って保存すれば長く分解せず,リン酸や尿酸,バルビタールなどの物質は逆に分解を妨げるので,市販品に安定剤として加えられる。この分解のため過酸化水素には酸化力があり,その作用はアルカリ性溶液中で著しく強まるが,一方,還元力もあり,酸化銀から酸素を奪って銀を生ずる。
Ag2O+H2O2─→2Ag+H2O+O2
弱酸性で,水酸化バリウムで中和すると,その塩である過酸化バリウムBaO2・8H2Oが沈殿する。分子は図のような形をしており,構造式HO-OHの二つのOH結合はO-Oの軸に対しても,また相互にも90度あまりねじれている。
製法
工業的には大部分がアントラキノン法によってつくられている。アントラキノン法は,2-アルキルアントラキノンに触媒の存在下水素を反応させて2-アルキルアントラヒドロキノンとし,これに酸素を反応させて過酸化水素とする。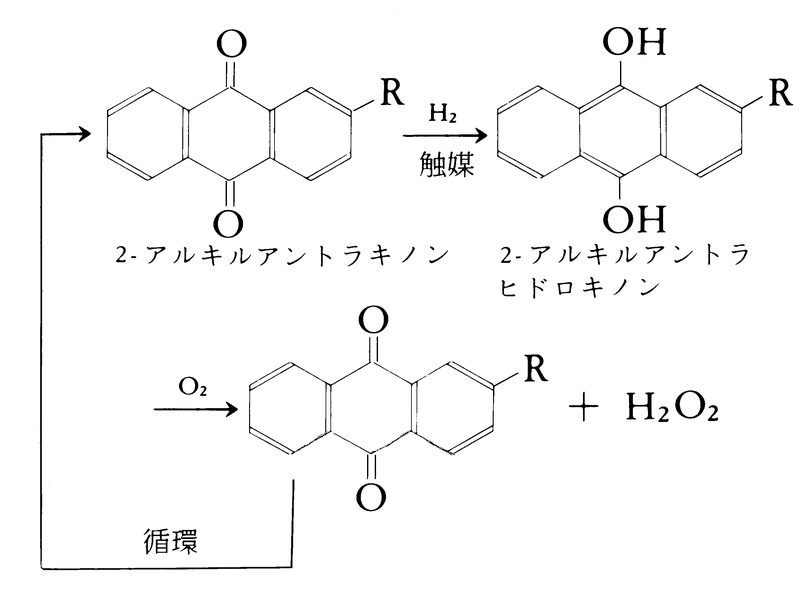
このほか,硫酸アンモニウム(NH4)2SO4水溶液を電解酸化して得られるペルオキソ二硫酸アンモニウム(NH4)2S2O8の加水分解により過酸化水素を得る方法もある。
実験室で少量を得るためには,過酸化ナトリウムまたは過酸化バリウムと希硫酸との反応,または過酸化バリウムと二酸化炭素の反応などを利用する。これらの方法で得られるのは水溶液であるが,減圧濃縮,硫酸による脱水,分別結晶などの方法を組み合わせて,濃縮すれば純粋なものが得られる。
用途
漂白剤,消毒剤,実験室での酸化剤として広く用いられ,またビニル重合の触媒などプラスチック工業にも利用される。高濃度の過酸化水素水はロケットや潜水艦などの動力源ともなる。市販品は,化学用の濃いものは30%,消毒用のものは3%程度の水溶液で,後者は薬局方ではオキシドールと呼ばれている。
執筆者:曽根 興三
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「過酸化水素」の意味・わかりやすい解説
過酸化水素
かさんかすいそ
hydrogen peroxide
水素と酸素の化合物の一つ。過酸化バリウムに酸を作用させると得られる。1818年フランスのテナールにより発見された。
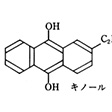
工業的には、有機物の自動酸化を利用する。2-エチルアントラキノール溶液に酸素を通し、生じた過酸化水素を純水に抽出する。キノンは触媒の存在下、水素によりキノールに再生される。また古くは、硫酸水素アンモニウム水溶液の電解酸化により生じるペルオキソ二硫酸アンモニウム溶液を減圧蒸留してつくっていた。減圧蒸留では通常25%程度までであり、脱水剤を加えて真空蒸留して100%のものが得られる。
減圧蒸留、硫酸による脱水、分別結晶法により精製する。純粋なものは無色オゾン臭のある油状液体。水溶液は弱酸で、重金属、金属パラジウムその他のコロイドあるいは重金属酸化物、塵埃(じんあい)、アルカリなどが存在すると酸素を放って爆発的に分解する。リン酸は分解を阻止するので、市販品にはこれが加えられている。過酸化水素中の酸素の酸化状態は、酸素と水の中間にあたる。
強い酸化力をもち、酸化剤として用いられることが多いが、過マンガン酸塩との反応では還元剤として作用する。市販品は普通30%水溶液で、3%水溶液は薬局方でオキシドールという。主要な用途は漂白用で、パルプ、木綿、麻、絹、羊毛など天然繊維のほか各種化学繊維、食品に用いられる。そのほか合成化学原料、消毒剤、殺菌剤として医薬用に、重合開始剤、金属表面処理剤、また90%以上のものはロケット推進薬として用いられる。低濃度でも酸素を発生しながら分解しやすいため、直射日光を避け、熱源に近づけないように注意しなければならない。高濃度のものは皮膚を侵し、炎症をおこす。
[守永健一・中原勝儼]
過酸化水素(データノート)
かさんかすいそでーたのーと
過酸化水素
H2O2
式量 34.01
融点 -0.43℃
沸点 150.2℃
比重 1.465(測定温度0℃)
結晶系 正方
化学辞典 第2版 「過酸化水素」の解説
過酸化水素
カサンカスイソ
hydrogen peroxide
H2O2(34.01).硫酸アンモニウム-硫酸水溶液を電解酸化して得られる.実験室では,ナトリウム,バリウムの過酸化物を少量ずつ冷希硫酸に加えてつくる.純粋のH2O2は室温で淡青色のシロップ状液体.融点-0.43 ℃,沸点152.1 ℃.密度1.465 g cm-3(0 ℃).水と自由に混合する.エーテルに易溶,エタノールに可溶,ベンゼン,石油エーテルに不溶.強い酸化力がある.とくにアルカリ性において,重金属イオンが痕跡でも存在すると,たやすく分解する.希水溶液は弱酸性を示す.Ka 1.5×10-12(20 ℃).酸性,塩基性のいずれの水溶液においても強酸化剤である.MnO4-のようなきわめて強い酸化剤に対してのみ還元剤としてはたらく.H2O2の分子は曲がった鎖状構造をしている.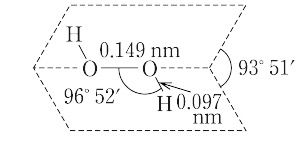 液体では水素結合でH2Oよりも高度に会合している.市販の過酸化水素は通常30% 水溶液で,薬局方ではオキシドールという.市販品には二リン酸ナトリウムのような安定剤が加えてある.酸化剤,漂白剤,消毒剤,殺菌剤,防腐剤,ビニル重合触媒,液体ロケット燃料,パルプ・紙・繊維工業などに用いられる.[CAS 7722-84-1]
液体では水素結合でH2Oよりも高度に会合している.市販の過酸化水素は通常30% 水溶液で,薬局方ではオキシドールという.市販品には二リン酸ナトリウムのような安定剤が加えてある.酸化剤,漂白剤,消毒剤,殺菌剤,防腐剤,ビニル重合触媒,液体ロケット燃料,パルプ・紙・繊維工業などに用いられる.[CAS 7722-84-1]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「過酸化水素」の意味・わかりやすい解説
過酸化水素
かさんかすいそ
hydrogen peroxide
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「過酸化水素」の意味・わかりやすい解説
過酸化水素【かさんかすいそ】
出典 株式会社平凡社百科事典マイペディアについて 情報
栄養・生化学辞典 「過酸化水素」の解説
過酸化水素
世界大百科事典(旧版)内の過酸化水素の言及
【食品漂白剤】より
…過酸化ベンゾイルは漂白と同時に製パン性を改善する目的で小麦粉に添加される。また,過酸化水素がかずのこ,しらす,かまぼこの漂白にかつて広く用いられたが,1980年に日本で発癌性の疑いが判明したので,最終製品の完成前に分解または除去することが定められた。【田島 真】。…
【滅菌】より
…
[化学的方法]
古くからアルコール,ホルムアルデヒド,石炭酸(フェノール)などが用いられている。2.5~3.5%の過酸化水素はその酸化作用のため消毒に用いられる。過酸化水素は空気,光などにより分解して効力を失うので,冷暗所に保存する。…
※「過酸化水素」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...