翻訳|alkane
日本大百科全書(ニッポニカ) 「アルカン」の意味・わかりやすい解説
アルカン
あるかん
alkane
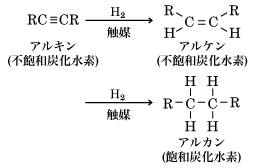
炭素Cと水素Hのみからなり、C-C原子間の結合がすべて単結合で、炭素原子の残りの原子価はすべて水素原子と結合した脂肪族飽和化合物の総称。一般式CnH2n+2で表される。表1にn=1~20の例を示す。メタン系炭化水素あるいはパラフィン系炭化水素ともよばれる。パラフィンとはラテン語でのparum affinis(親和力に乏しい)に由来し、アルカンが化学的活性に乏しいことを表している。C-C単結合の長さは1.54Å(オングストローム。1Åは0.1ナノメートル)程度で、アルケンの二重結合(1.34Å程度)、アルキンの三重結合(1.20Å程度)よりも長い。分子内にC=C二重結合をもつアルケンや、C≡C三重結合をもつアルキンは不飽和化合物とよばれる。これらは水素と白金、ニッケルなどの金属触媒を用いて水素添加することにより、飽和化合物であるアルカンに導くことができる。
[佐藤武雄・廣田 穰]
同族体と異性体
アルカンには炭素原子が一列につながっている直鎖状のものと、炭素鎖が枝分れしたものがある。直鎖状のものをn-パラフィン(または正パラフィン)、枝分れしたものをイソパラフィンとよぶことがある。環状の飽和炭化水素はシクロアルカンとよばれる。
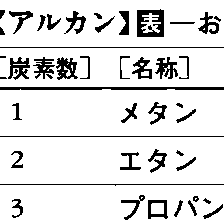
n-アルカンはメタンからエタン、プロパンと炭素数が増加するにつれて-CH2-単位が一つずつ増える。このように-CH2-の数だけが異なる化合物を、互いに同族体あるいは同族列化合物であるという。に代表的なn-アルカンの例を示す。
炭素数3のプロパンまでは分子式に対応する化合物は一つずつしかないが()、炭素数4のブタンでは分子内での炭素原子の配列が異なる化合物が存在する。すなわち、直鎖状のブタンのほかにイソブタンとよばれる化合物がある。このように同じ分子式をもちながら異なる原子配列をとっている化合物を異性体(構造異性体)という。この例では「イソブタンはブタンの異性体である」または「ブタンとイソブタンは互いに異性体の関係にある」のようにいう。にC4のブタンからC6のヘキサンまで、にC7のヘプタンの構造異性体の化学式と融点・沸点を掲げる。同じ炭素数の異性体を比べると、沸点、融点などの物理的性質だけでなく化学的性質も異なっている。の沸点を、同じ炭素数の異性体の間で比べてみると、すべての場合で、枝分れのないn-アルカンがもっとも高い沸点で、枝分れが多くなり炭素鎖が短くなるにしたがって沸点が低くなっている。たとえばC5のn-ペンタンは沸点が36℃で常温では液体であるが、同じC5でもネオペンタンは沸点が9.5℃で常温では気体である。にアルカンの炭素数と構造異性体数の関係を示す。このように炭素数が増えるにしたがって異性体数は増大する。炭素数20のエイコサンの異性体は37万に近い。前記の、、の例からわかるように、炭素の少ない低級のアルカンについては可能な異性体はすべて実際に存在することが知られている。
[佐藤武雄・廣田 穰]
命名法
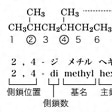
有機化合物は、炭素骨格に各種の官能基が導入されたものとして命名される。したがってアルカンの命名は有機化合物の命名法の基本となる。アルカンであることを示す接尾語は-ane(アン)である。炭素数1から4までのアルカンには慣用のメタン、エタン、プロパン、ブタンという名称を用いる。炭素数5以上の場合は、数を表すギリシア語(一部ラテン語)の数詞に-aneをつけて命名する。たとえば炭素数5のものはpenta+ane=pentane、ペンタンとなる。炭素数6以下のアルカンについては、必要な場合にはn-ブタン、n-ペンタン、n-ヘキサンのように接頭語「n」をつけて直鎖の異性体であることを表記できる。枝分れアルカンについては、炭化水素名に限ってイソブタン、イソペンタン、ネオペンタン、イソヘキサンなどの慣用名を使ってもよい。一般に枝分れのあるアルカンを命名する方法は、化合物中でもっとも長い炭素鎖(主鎖という)に、アルキル基が置換したものと考えて命名する。炭素数8のオクタンの異性体の例をあげると、のようになる。
この場合、もっとも長い炭素鎖は6であるので、炭素数6のヘキサンを主鎖としてそのジメチル置換体として命名するわけである。
アルカンの水素一つを取り除いた基名はアルカン名から-aneをとり-yl(イル)をつけて命名する。すなわち、エタンethane→エチルethyl、ブタンbutane→ブチルbutylのように命名する。に鎖状飽和炭化水素名とアルキル基名を示す。
[佐藤武雄・廣田 穰]
分子の形
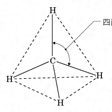
炭素の原子価が四面体構造をもつことは、すでに1874年にオランダのファント・ホッフとフランスのル・ベルによって独立に提案され、その後電子線回折などの物理的測定により実証された。もっとも簡単な構造のアルカンであるメタンは、に示すように正四面体の中心に炭素原子を置くと、各頂点に水素原子が位置する構造をしている。水素―炭素―水素各原子がつくる角は、109.5°、より精確には109°28′である。この角度を四面体角とよぶことがある。
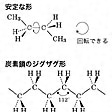
二つの炭素原子をもつエタンCH3-CH3では二つのCH3基がC-C結合の周りで回転できる。回転に伴い分子は規則的に形が変わる。鎖状の炭素骨格の基本となるブタンについてみると、もっとも安定な形(立体配座という)はに示すように両端にある二つのメチル基が互いにもっとも離れた位置をとる。炭素の鎖がジグザグ形をとりやすいのはこのためである。
四面体構造をもつ炭素化合物では、一つの炭素原子に4種の異なる原子あるいは原子団がつくと、2種類の異性体が可能となる。この異性体は互いに、実像と鏡像の関係にあり、光学異性体とよばれる。は構造異性体数のみを示してあり、光学異性体を考えるとさらに異性体の数は増大する。
[佐藤武雄・廣田 穰]
性質
にn-アルカンの炭素数と沸点および融点との関係を示す。n-アルカンの沸点は分子量の増大に伴って上昇する。炭素数1から4のアルカンは常温で気体だが、炭素数5から17では液体となる。それ以上の炭素数のアルカンは固体で蝋(ろう)状の物質である。炭素数の増大に伴う沸点上昇の幅はしだいに狭まり、メタンとエタンの差約70℃はノナンC9H20とデカンC10H22では25℃になる。融点は沸点と異なり分子量以外に分子の形、炭素数の偶数か奇数かなどに依存していることがわかる。n-アルカンの比重は1より小さく、液体のアルカンは水に溶けないので水に浮く。ベンジン、クロロホルム、エーテルなどの有機溶媒にはよく溶けるが、メタノールへの溶解度はアルカンの炭素数が多くなるにしたがって減少する。
アルカンは空気中で燃焼して水と二酸化炭素になる。この際放出される熱量を燃焼熱という。メタンでは
CH4+2O2
―→CO2+2H2O+191.8kcal
になる。
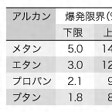
空気中に一定の範囲内の濃度のアルカンが存在すると、点火した場合に爆発がおこる。この濃度範囲の上限と下限を爆発限界という。にアルカンの発火温度と爆発限界を示す。炭坑や室内でメタンやプロパンガスの爆発がおこらないようにするには、爆発範囲のガス濃度にならないように注意する必要がある。
アルカンは、アルケンやアルキンとよく反応する濃硫酸、濃硝酸、水酸化ナトリウム、過マンガン酸カリウムなどのイオン性試薬とはまったく反応しない。光を遮断した状態ではハロゲンとも反応しないが、光照射下では塩素などのハロゲンと激しく反応する。メタンを例にとると、水素を次々と塩素原子で置換し、のように変化して、メタンの水素原子が1~4個の塩素により置換された生成物を与える。
光によるアルカンとハロゲンとの反応、アルカンが酸素により燃焼する反応は、ともにラジカル連鎖反応であることが知られている。まとめとして、アルカンは光や熱により誘発されたラジカル的反応をするが、イオン的な反応はおこしにくいということができる。
[佐藤武雄・廣田 穰]
製法
実験室でアルカンを合成するにはに例を示すような方法が用いられる。
(1)アルケンあるいはアルキンを金属触媒を用いて水素添加する。たとえば、アルケンはラネーニッケル触媒や白金触媒を用いて接触水素化を行うと容易にアルカンを与える(式1)。
(2)ハロゲン化アルキルを水素化アルミニウムリチウムまたはナトリウムアマルガムを用いて還元する(式2)。
(3)ケトンや脂肪酸を還元する(式3)。
(4)ウルツ‐フィティッヒ反応を用い、ハロゲン化アルキルとナトリウムを反応させる(式4)。
(5)飽和脂肪酸を脱炭酸する(式5)。
(6)飽和脂肪酸のナトリウム塩を電気分解する(式6)。この反応をコルベ反応という。
(7)フィッシャー‐トロプシュ反応を利用する。この反応はコバルト、ニッケル、鉄などの触媒上に、一酸化炭素と水素を通じることによって進行し、炭素1個C1から炭化水素をつくる化学反応として重要である(式7)。
[佐藤武雄・廣田 穰]
資源
アルカンはおもに石油と天然ガスから得られる。これらは有史以前に動植物が蓄積した有機物が分解して生成したものである。産地により異なるが、石油は炭素数2から40ぐらいまでのアルカンを主成分として含むほかに、シクロアルカン、芳香族炭化水素、複素環式化合物から構成されていて、炭化水素の重要な資源である。採掘された石油原油は、接触分解や水素化分解の行程を経て低分子量の炭化水素に変えられ、現代の生活に欠かせないガソリン、灯油、軽油、重油などの燃料や石油化学工業原料として使われている。ガソリンの主成分はアルカンで、含まれるアルカンの比率はガソリンの製法や産地により異なり、30~100%である。石油精製のプロセスでは、触媒を用いて、長い炭素鎖を切断して低分子量にしたり、異性化させて枝分れの多い炭化水素を増やしたりする。石油化学工業では、ナフサ分解などの行程を経て、アルカンを有用なアルケンに変えて種々の化学工業製品の原料をつくっている。天然ガスは低分子量のアルカンであるメタンとエタンが主成分で、少量のプロパン、ブタンを含んでいる。メタンは、沼地で落ち葉など水中で枯死した植物から嫌気性発酵により発生するので沼気(しょうき)ともよばれているが、資源としては地下のガス田から採掘する。多量のメタンが水と結合して「メタンハイドレート」の形で深海に存在することもわかり、有望なエネルギー資源として注目されている。
[佐藤武雄・廣田 穰]
『デビュー、ラインハート著、塩見賢吾、廣田穣、務台潔訳『有機化学』(1971・共立出版)』▽『務台潔著『新有機化学概論』(2000・朝倉書店)』

アルカンの分子模型
代表的なn-アルカンの例〔表1〕

C~Cアルカン〔表2-1〕

C~Cアルカンの異性体〔表2-2〕

Cアルカンの異性体〔表2-3〕
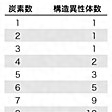
炭素数と構造異性体数〔表3〕
枝分れアルカンの命名法〔図A〕

鎖式飽和炭化水素名とアルキル基名〔表4…
メタンの構造〔図B〕
ブタン分子の形〔図C〕

n-アルカンの沸点と融点〔図D〕
アルカンの発火温度と爆発限界〔表5〕
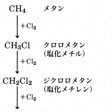
光塩素化反応〔図E〕

アルカンの合成法〔表6〕
化学辞典 第2版 「アルカン」の解説
アルカン
アルカン
alkane
鎖式飽和炭化水素,パラフィン系炭化水素,メタン系炭化水素ともいう.一般式CnH2n+2で表される化合物の総称.炭素原子からなる骨格は鎖式構造であって環を含まず,炭素原子間の結合はすべて単結合で,炭素原子の残りの原子価はすべて水素原子との結合に用いられている.もっとも簡単なものは,n = 1のメタンCH4であり,n = 2,3,4のものは,それぞれエタン,プロパン,ブタンとよばれる.nが5以上のものは,炭素原子数nを示すギリシア語(一部はラテン語)に由来する数詞の語尾に,アン(英語では-ane)をつけた名称でよばれる.n = 5ペンタン,n = 6ヘキサン,n = 7ヘプタンなど.直鎖構造のものはノルマル(n-)パラフィンともよばれる.炭素原子数が4以上のものには,炭素骨格が枝分れした異性体がある.たとえば,n = 4のものにはn-ブタンCH3CH2CH2CH3とイソブタン(CH3)2CHCH3とがある.可能な異性体の数は炭素原子数の増大とともに急速に増大する.メタンは天然ガスや石炭ガスの主成分である.n = 1からn = 70くらいまでのものは石油のなかに含まれている.天然ガスや石油の分留によって得られるほか,次のような製法がある.
(1)不飽和炭化水素にラネーニッケルのような触媒を用いて水素付加する.
(2)一酸化炭素と水素との混合物を金属触媒上で反応させて,アルカンの混合物をつくる(フィッシャー-トロプシュ合成).
(3)低分子量のアルケンとアルカンとを高温・高圧で反応させると,側鎖をもつ高級アルカンが得られる.
(4)ハロゲン化アルキルに還元剤を作用させる.
(5)ハロゲン化アルキルを金属ナトリウムと加熱する(ウルツ反応).
(6)脂肪酸ナトリウムをソーダ石灰とともに加熱する.
CnH2n+1COONa + NaOH → CnH2n+2 + Na2CO3
(7)脂肪酸塩の濃い水溶液を電気分解する(コルベ電解).
アルカンはすべて無色である.炭素原子数nが小さいもの(低級アルカン)は常温・常圧で気体,中くらいのもの(中級アルカン,直鎖のものではnが5から15くらいまで)は液体,nが大きいもの(高級アルカン)は固体である.直鎖のものでは融点,沸点,比重がnの増大とともにしだいに高くなる.比重は,たとえばn = 6(ヘキサン)で0.66,n = 7(ヘプタン)で0.68と,nの増大とともにしだいに高くなり,n = 17以上はほぼ一定で0.78である.同じ炭素原子数の異性体のなかでは,直鎖のものより枝分れのあるもののほうが沸点が低い.水に難溶,ガソリン,ベンジンなどの炭化水素溶媒に可溶,エタノール,エーテルなどに易溶.空気中で点火すると多量の熱量を出して燃える.非常に安定で反応性が小さく,普通の条件ではほとんどすべての試薬に侵されない.しかし,条件によっては,ハロゲン,発煙硫酸,硝酸,酸化剤などと反応する.また,高級アルカンを高温で熱分解させると,低分子量のアルカン,アルケンの混合物が得られる.常温・常圧で気体や液体のアルカンは燃料として用いられるほか,液体のものは溶媒として用いられる.石油エーテル,石油ベンジン,リグロインなどは,主として液状のアルカン系炭化水素の混合物である.固体のものはパラフィンとして軟膏基剤,ろうそく,防水剤などに用いられる.アルカンはまた石油の主成分として,石油化学工業の主要な原料となっている.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
改訂新版 世界大百科事典 「アルカン」の意味・わかりやすい解説
アルカン
alkane
脂肪族鎖式飽和炭化水素の一般名。一般式CnH2n+2で表される一群の化合物で,パラフィンparaffin(e),パラフィン系炭化水素,メタン系(メタン列)炭化水素などとも呼ばれる。パラフィンの名はラテン語のparum affinis(親和力が低い)に由来する。骨格をつくる炭素原子間の結合はすべて単結合で,炭素原子の残りの原子価はすべて水素原子との結合に用いられ,環構造や多重結合を含まない。個々のアルカンの名称は,含まれている炭素原子数を示す数詞(主としてギリシア語)に語尾〈アンane〉をつける(表参照)。炭素数n=1~3のアルカンは各1種しかないが,n=4以上になると,炭素鎖が枝分れのない直鎖のものと枝分れのあるものがある。炭素原子の並び方が異なるこの種の異性体数は炭素数が大きくなるとともに急激に大きくなり,たとえばn=4のブタンC4H10では2個であるが,n=10のデカンC10H22では75種,n=20のエイコサンC20H42では36万6319種ある。以前は直鎖のアルカンには名称の前にn-(normalの略)をつけたが,IUPAC命名法では,枝分れのあるアルカンは最大長の鎖の誘導体として命名されるので,枝分れの有無は側鎖アルキル基が名称に含まれているか否かで判定され,n-を用いる必要はない。
n=1~4のものは無色の気体,n=5~16のものは室温で無色の液体,nがさらに大きいものは白色固体となり,蠟のような外観をもつ。種々の合成法が知られているが,実際に合成されるのは特殊な目的の場合に限られ,通常は天然ガスや石油の分留によって個々のアルカンを得る。パラフィンの語源からわかるように反応性が低く,室温では酸,塩基,ハロゲン,アルカリ金属とは反応しない。しかし,適当な触媒の存在下で高温にすると,空気酸化,脱水素,異性化,熱分解などの反応が起こり,これらは石油工業や石油化学工業の基礎となっている。また直射日光,紫外線を照射するとハロゲンともラジカル的に反応して,ハロアルカンを生成する。
→アルキン →アルケン
執筆者:竹内 敬人
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
栄養・生化学辞典 「アルカン」の解説
アルカン
百科事典マイペディア 「アルカン」の意味・わかりやすい解説
アルカン
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「アルカン」の意味・わかりやすい解説
アルカン
「メタン系炭化水素」のページをご覧ください。
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
世界大百科事典(旧版)内のアルカンの言及
【パラフィン】より
…脂肪族鎖式飽和炭化水素(アルカン)およびパラフィンワックスparaffin waxのこと。パラフィンワックスは石蠟(せきろう)ともいい,アルカンCnH2n+2の炭素数nが約20以上のものの混合物で,常温では白色半透明の蠟状の固体(ときに結晶性)。…
※「アルカン」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...