翻訳|tellurium
精選版 日本国語大辞典 「テルル」の意味・読み・例文・類語
テルル
改訂新版 世界大百科事典 「テルル」の意味・わかりやすい解説
テルル
tellurium
周期表第ⅥB族に属する酸素族元素の一つ。1783年,ドイツのミュラーFranz Joseph Müller(1740-1825)により含金鉱物から単離され,89年M.H.クラプロートによって確認された。英語名は大地を意味するラテン語tellusに由来する。天然にはわずかしか存在せず,ふつう金,銀,銅,鉛の硫化鉱物中にこれらの金属のテルル化物として少量含まれて産する(〈テルル鉱物〉の項参照)。
性質
亜テルル酸溶液に二酸化硫黄を通して還元したものは無定形の黒色ないし銀灰色粉末である。電気分解や融解して得られた銀灰色の金属テルルは六方晶系a=4.447Å,c=5.915Åで,結晶構造は灰色セレンと同じで,テルル原子がらせん鎖をつくっており,隣りあった別の鎖の原子との間に金属結合的な弱い相互作用がある。モース硬度2.5で,もろい。セレンとは連続的な割合で固溶体をつくる。金属テルルは半導体としての特性を示し,その電気抵抗は微量の不純物に影響され,また温度上昇とともに低下する。無定形のものも六方晶系のものもいずれも水に不溶,ベンゼン,二硫化炭素にも溶けない。塩酸には侵されないが,濃硫酸,硝酸と熱すると反応する。水酸化アルカリ,シアン化アルカリには溶ける。またポリ硫化ナトリウム溶液にも溶ける。空気中で熱すると青白い炎をあげて燃焼し酸化テルル(Ⅳ)TeO2を生ずる。
テルルは水素や他の金属と結びついて-2価の原子価をもつテルル化物を形成しやすい(例,H2Te,ZnTe)。テルル化合物におけるその他のおもな原子価は4,6であって,それぞれTeO2,TeCl4およびTeF6などの化合物をつくる。4価のテルルはヘキサクロロテルル酸イオン[TeCl6]2⁻など錯イオンを形成する傾向が強い。テルル化アルキル(例,(CH3)2Te,(C2H5)2Te),テルル化アリール(例,(C6H5)2Te)など多くの有機テルル化合物がある。テルルおよびその化合物は毒性があり,空気中の最大許容量は0.1mg/m3である。
製法
工業的には銅製錬のさいの陽極スライムの酸化焙焼残物をアルカリに溶かして亜テルル酸イオンとし,これに塩酸を加えて中和しTeO2とする。こうして得られた粗TeO2を塩酸に溶かし塩化ヒドロキシルアンモニウムNH2OH・HClを加えて不純物のセレンを沈殿させて除き,溶液に二酸化硫黄を吹き込んでテルルを沈殿させる。または粗TeO2を水酸化ナトリウム溶液に溶かし陽極に鉄,陰極にステンレス鋼を使用して電気分解し陰極上にテルルを析出させる。粗テルル粉末は一度ポリ硫化ナトリウムNa2Sx溶液に溶かし,不溶物をろ(濾)別した後,ろ液に亜硫酸ナトリウムを加えると黒色のテルル粉末として得られる。強アルカリ溶液に過剰の亜鉛粉末とともに粗テルルを溶解すると不純物は亜鉛粉末とともに不溶物として残る。溶液に塩素ガスを吹き込むと純テルルが析出する。真空蒸留,ゾーンメルティングなどにより精製される。
用途
テルルは鉛,銅,ステンレス鋼などに耐酸性,耐疲労性,切削性の向上のため添加される。亜鉛,カドミウム,鉛などのテルル化物は光伝導性が著しく,光伝導セルとして用いられている。とくにPbTeは近赤外領域で高い光感度をもっており,テルル化鉛セルとして用いられる。三テルル化二ビスマスBi2Te3をはじめとしてアンチモン,セレンを含む三元化合物Bi2(Se,Te)3,(Bi,Sb)2Teは半導体として,またこれらの大きなゼーベック効果やペルチエ効果を利用して熱発電や電子冷却の素子として用いられている。
執筆者:漆山 秋雄
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「テルル」の意味・わかりやすい解説
テルル
てるる
tellurium
周期表第16族に属し、酸素族元素の一つ。俗称テルリウム。1783年ドイツのミュラーFranz-Joseph Müller von Reichenstein(1740―1825)により含金鉱石中から発見されたが、これには反論があり決定には至らなかった。しかし1798年ドイツのクラプロートによって確認され、ラテン語の地球tellusにちなんで命名された。
まれに単体の自然テルルとして産するが、テルル鉱石は希少である。一般にはテルル化物として硫化鉱中に少量混在し、金、銀のテルル化物(シルバニア鉱、ペッツ鉱など)としてわずかに存在する。工業的には、銅および鉛の電解精錬工場からのアノード泥が主原料で、ソーダ灰などと熱処理して可溶性のテルル酸塩としたのち、中和して亜テルル酸TeO2・nH2Oとして分離する。金鉱石の焙焼(ばいしょう)炉の煙塵(えんじん)からも少量回収される。亜テルル酸の溶液を二酸化硫黄(いおう)で還元すると、いわゆる無定形テルルが灰色粉末として沈殿する。これを熱すると銀灰色の金属テルルとなる。金属テルルは半導体で熱を導きにくい。蒸気は黄色、2000℃近くまで二原子分子Te2からなる。化学的には同族のセレンに似ているが、テルルおよびテルルの化合物はセレンほどではないが有毒である。空気中で青緑炎をあげて燃え、二酸化テルルTeO2を生じる。水素とは直接反応しないが、ハロゲンとは激しく反応してハロゲン化物となる。硝酸に溶ける。水、塩酸、希硫酸に不溶。酸化数-Ⅱ、Ⅱ、Ⅳ、Ⅵの化合物が知られる。高純度テルルは乾式コピー用感光体、金属テルルは耐酸性合金や鋼の合金添加剤として、化合物は特殊な着色剤、酸化剤、熱電素子としての用途がある。
[守永健一・中原勝儼]
テルル(データノート)
てるるでーたのーと
テルル
元素記号 Te
原子番号 52
原子量 127.60±3
融点 449.5℃
沸点 989.8℃
比重 金属、6.236(測定温度20℃)
結晶系 六方
元素存在度 宇宙(Si106個当りの原子数)
6.76(第38位)
化学辞典 第2版 「テルル」の解説
テルル
テルル
tellurium
Te.原子番号52の元素.電子配置[Kr]4d105s25p4の周期表16族非金属元素.原子量127.60(3).質量数105~132の同位体が知られているが,120,122~126,128(31.74(8)%),130(34.08(62)%)の8種が安定で,それ以外は放射性同位体である.1782年オーストリアのF.J. Müllerが金鉱石からテルルを分離した.確認はM.H. Klaprothで,元素名は1798年にかれがローマ神話の“地球の女神”tellusにちなんで命名した.日本語の元素名はドイツ語の元素名Tellurから.宇田川榕菴は天保8年(1837年)に出版した「舎密開宗」で,的爾律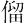 母(テルリュリュウム)としている.
母(テルリュリュウム)としている.
地殻中の存在度0.01 ppm(深度20マイルまでの平均元素存在度).カルコゲン中で存在量は最少で,硫化物中にテルル化物などとして存在する.銅,鉛などの電解精錬の副産物として得られる.六方晶系に属する銀白色のもろい半金属.融点449.5 ℃,沸点990 ℃.密度6.24 g cm-3(20 ℃).酸化数-2,4,6.第一イオン化エネルギー9.009 eV.亜テルル酸(テルル(Ⅳ)酸H2TeO3)を二酸化硫黄で還元すると灰色の無定形テルルが得られる.水とは反応しないが,空気中で徐々に酸化され,熱すると青い炎をあげてTeO2になる.塩酸,希硫酸に不溶,酸化力のある酸,王水,水酸化ナトリウム溶液に可溶.テルルは硫黄,セレンに似ているが,より金属的で塩基性も示す両性物質である.硫黄やセレンほど反応性は高くないが,濃アルカリ溶液でテルル化物と亜テルル酸塩となり,酸性にするとテルルが析出する.硫黄やセレンに相当する化合物が多いが,テルル酸H6TeO6は硫酸やセレン酸に比較して弱酸である.テルルは活性金属との反応により硫化物に似たテルル化物をつくるが,硫化物より不安定である.水素とは反応しないが,ハロゲンとは直接反応してハロゲン化物をつくる.陽性元素とは-2の酸化数の,陰性元素とは2,4,6の酸化数の化合物をつくる.また,Te42+,Te62+ などのポリ陽イオンもできる.
鋼,ステンレススチールなどへの少量(0.01~1%)の添加は機械的加工性,強靭性を改善する.ガラスの顔料や触媒,ゴム加硫促進剤としても用いられる.TeGeSb合金,GeSbTeBi合金などは光記録媒体としてCD-R,CD-RW,DVDなどに,Cd-Te合金は太陽電池に用いられる.人体に有毒で,「テルル及びその化合物」はPRTR法・第二種指定化学物質.作業環境クラス2(気体1 mg/m3 以下,粒子状物質0.1 mg/m3 以下).労働安全衛生法の名称等を通知すべき危険物及び有害物.[CAS 13494-80-9][別用語参照]テルル化物
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「テルル」の意味・わかりやすい解説
テルル
tellurium
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「テルル」の意味・わかりやすい解説
テルル
出典 株式会社平凡社百科事典マイペディアについて 情報
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...



