翻訳|sulfur
共同通信ニュース用語解説 「硫黄」の解説
硫黄
更新日:
出典 共同通信社 共同通信ニュース用語解説共同通信ニュース用語解説について 情報
精選版 日本国語大辞典 「硫黄」の意味・読み・例文・類語
いおういわう【硫黄】
- 〘 名詞 〙
- ① ( 「ゆあわ(湯泡)」から「ゆわう」「いわう」と変化したものか。あるいは、「硫」の字音「る」を日本化して「ゆ」と発音した「ゆわう」から変化したものともいう ) 非金属元素の一つ。黄色・無臭のもろい結晶体で、熱すると溶解し、点火すると青い炎を出して燃える。火山地帯に多く産し、火薬、マッチの他、薬剤として用いる。元素記号S 原子番号一六。原子量三二・〇六六。斜方硫黄、単斜硫黄などの同素体がある。
- [初出の実例]「嶋のなかにはたかき山あり。〈略〉硫黄と云ふ物みちみてり」(出典:平家物語(13C前)二)
- ② スギやヒノキの幅三センチメートルくらいの薄片の一端に硫黄を塗り、火を移すのに用いたもの。付け木。硫黄木。
- [初出の実例]「硫黄(イオウ)。ずゐぶん花のよく付きたるを買ひ、二つに割りて使ふべし、心得て買ふべし」(出典:諸事だい徳用鑑(1818‐30か))
ゆおうゆわう【硫黄】
日本大百科全書(ニッポニカ) 「硫黄」の意味・わかりやすい解説
硫黄
いおう
sulfur
周期表第16族に属し、酸素族元素の一つ。古くはsulphurの文字も使われたが現在ではsulfurに統一されている。天然に遊離の状態で産出するため古くから知られ、古代でも硫黄を燃やした煙でいぶす消毒法が行われたという。その後も医薬や火薬として用いられた。名称はサンスクリットの「火の元」を意味するsulvereからきたラテン語のsulphuriumに由来する。硫黄を元素として正しく認識したのは18世紀後半フランスのA・L・ラボアジエである。
[守永健一]
存在
地球上に広く多量に存在し、火山地方に遊離の状態で産出するものは土硫黄(どいおう)とよばれる。アメリカのルイジアナ州やテキサス州、イタリアのシチリア島などがおもな産地で、日本では岩手県の松尾鉱山が最大のものであった(1969年廃鉱)。火山ガス、鉱泉、温泉などにも硫化水素H2S、二酸化硫黄SO2および硫酸H2SO4の形で含まれている()。そのほか化合物としては、硫化物(黄鉄鉱FeS2、閃(せん)亜鉛鉱ZnSなど多数)や硫酸塩(石膏(せっこう)CaSO4・2H2Oなど)として存在する。また、石油中にも各種化合物として存在し、その量は産地によって異なるが、およそ0.05~5%含まれる。硫黄は生物界においても重要な元素で、ある種のタンパク質やアミノ酸に含まれる。また、植物体中にも存在している。植物の炭化によって生じた石炭には1~1.5%含まれている。
[守永健一]
製法
天然に産出する硫黄は、土砂、石膏などが混じって不純である。純粋な硫黄を得るためには、まず混在物から粗硫黄を分離し、これをさらに精製する。現在では天然ガスおよび石油から回収されるものがほとんどである。
[守永健一]
粗硫黄の分離
日本で多く行われているのは焼取法で、鉱石を鉄窯(てつがま)に入れて石炭などで熱し、溶融した硫黄を土質と分けて取り出す。メキシコ湾岸一帯では地下の硫黄鉱床に鉄管を通じ、過熱水蒸気を送って硫黄を溶かし、圧縮空気によってこれを地表に汲(く)み上げるフラッシュ法が行われている。この方法は鉱床と採取規模が大きく、生産額は世界の90%以上を占めており、純度も99.5%以上のものが得られている。またイタリアでは、土硫黄の一部を燃やし、その熱で大部分の硫黄を融解して取り出すカルカローニ法が行われている。
[守永健一]
粗硫黄の精製
室温で二硫化炭素に溶かし、氷冷して再結晶するか、昇華法あるいは蒸留法が用いられる。蒸留法では鉄製のレトルト中で硫黄を溶融し、発生する蒸気を冷却室に導いて冷やし、細粉状の固体とする。これを硫黄華という。冷却室の温度を高くすれば液状のものが捕集され、これを鋳型に入れて棒状硫黄として販売する。
[守永健一]
石油からの硫黄の回収
今日では、石油精製そのほかの副成品からの回収による方法が多くなっている。重油の直接脱硫による方法で、高純度のものが多量に得られるようになった。重油中の硫黄はチオールRSH、チオフェンC4H4Sなどの形で炭素と結合している。触媒を用い水素を吹き込んで400℃、150気圧で反応させ、硫化水素として追い出す(これにより重油中の硫黄含量約4%を0.2%にまで下げることができる)。硫化水素は一部を燃焼させて、二酸化硫黄の気体とし、残りの硫化水素とボーキサイトなどの触媒上で反応させて硫黄を回収するIG‐クラウス法が行われる。
[守永健一]
性質
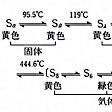
常温で黄色の非金属性固体で、多くの同素体がある。天然の硫黄は、同位体32S、33S、34S、36Sの混合物で、32Sが95%を占める。95.5℃以下で安定な斜方晶系硫黄はα(アルファ)硫黄(Sα)ともいわれ、硫黄華を二硫化炭素に溶かし、常温で放置するとき得られる結晶。すべての硫黄は放置すると、このα硫黄になる。95.5℃以上で安定な単斜晶系硫黄はβ(ベータ)硫黄(Sβ)といわれる。普通の硫黄を融解してから固化すると得られる針状結晶であり、二硫化炭素に溶ける。どちらも硫黄原子の8員環(S8分子)ができているが、βは配列に乱れがある構造となっている()。Sαを徐々に熱すると、Sβを経て119℃で融解し、液状の黄色いλ(ラムダ)硫黄(Sλ)となる。さらに加熱すると160℃以上で褐色のμ(ミュー)硫黄(Sμ)となる()。液状硫黄は初めのうち温度とともに粘性が増すが、200℃を超すとふたたび流動性を回復する。褐色の液状硫黄を冷水中に注ぐと、濃褐色の弾性を有するゴム状硫黄が得られる。これはμ硫黄の過冷却状態のものである(純度の高い硫黄から得られたゴム状硫黄は常温では黄色となる)。この他150℃以上で融解した硫黄をゆっくりと冷却するか、エタノール、二硫化炭素などの熱濃溶液を冷却するとγ(ガンマ)硫黄(Sγ)が得られる。零下78℃で二硫化炭素から結晶させるとδ(デルタ)硫黄(Sδ)が得られる。Sγは淡黄色結晶で真珠硫黄ともよばれる。Sδは黄色六角板状晶で、比重2.182(零下110℃)。39℃で分解する。その他δよりも多い多員環のcyclo-Snも各種の方法でつくられており、n=10、12、18、20などがよく知られている。いずれも黄色結晶。cyclo-Snの環が切断されて鎖状となったcatena-Snも知られており、Sの鎖が20万を超すものもあるとされている。液体の硫黄をさらに加熱すると444.674℃で気体となるが、その蒸気中には各種のSn分子が存在する。600℃まではS8分子がもっとも多く、ついでS6、S7などであり、蒸気の色は緑である。620~720℃ではS7、S6が多くなり、S2、S3、S4なども増えてくる。720℃以上ではS2が主となる。これらの蒸気は紫色である。この蒸気を液体窒素の温度まで冷やした表面に凝縮させると非晶質の無定形硫黄が得られる。電気の不導体で摩擦すると帯電する。高温になるほど解離して、2000℃では単原子のSとなる。いずれも水には不溶であるが、二硫化炭素、ベンゼンその他の有機溶媒に溶ける。
硫黄は化学的にかなり活発な元素で、とくに高温ではきわめて反応性が高い。金、白金以外のたいていの金属と反応し、硫化物をつくる。水素、炭素、塩素などの非金属と反応して、硫化水素、二硫化炭素、二塩化二硫黄などを生じる。酸素とは大きな親和力をもっていて、空気中で熱すると370℃で発火し、青い炎をあげて燃え、二酸化硫黄(俗称亜硫酸ガス)となる。亜硫酸塩に溶けてチオ硫酸塩を生じ、水酸化ナトリウムの熱溶液に溶けると、硫酸塩と硫化物を生じる。このとき硫黄が多いと、ポリ硫化物Na2Sx(x=2~5)となる。化合物中における硫黄の酸化数は、おもに-Ⅱ、+Ⅳ、+Ⅵである。-Ⅱの化合物として重要なのは硫化物、+Ⅳでは二酸化硫黄およびその誘導体、+Ⅵでは三酸化硫黄、硫酸およびその誘導体である。いずれも悪臭を有し毒性がある。
[守永健一]
用途
世界的には、硫酸原料として使用されるものがもっとも多いが、日本では医薬品などの原料である二硫化炭素の製造が多く、紙パルプ工業での用途がこれに次いでいる。無機薬品製造用として亜硫酸塩、酸化クロム、クロロ硫酸、酸化リン、硫化鉄、硫化水素ナトリウムなどがあり、そのほか火薬、マッチ、抜染(ばっせん)剤、ゴム加硫剤、水産食品用など、きわめて広い用途がある。
[守永健一・中原勝儼]
薬用
日本薬局方名のイオウは、純度99.5%以上、淡黄色あるいは黄色の無味無臭の粉末である。温泉場でとれる湯の華(はな)(硫黄華)もこれである。従来、日本薬局方では製法により昇華イオウ、精製イオウ、沈降イオウに分けられていたが、現在はイオウに統一された。寄生虫性皮膚疾患やにきび、脂漏、慢性湿疹(しっしん)に、軟膏(なんこう)、懸濁液(ローション)として3~10%の濃度で使用される。腸内細菌の作用で硫化水素を生成し、またアルカリ性の腸液によって硫化アルカリとなり、腸管の蠕動(ぜんどう)を促進するところから、緩和な下剤として用いられる。イオウを含む薬剤には、複方ダイオウ・センナ散、イオウ・カンフルローション、イオウ・サリチル酸・チアントール軟膏などがある。
[幸保文治]
人体と硫黄
人体に約112グラム含まれる重要な無機質の一つで、アミノ酸、ビタミン、ホルモンなど各種の化合物の構成元素となっている。とくにタンパク質では、メチオニンをはじめ、シスチン、システインなど、一連の含硫アミノ酸中に含まれる。栄養上、これらは重要なアミノ酸で必須アミノ酸(ひっすあみのさん)とよばれ、食事から一定量とる必要がある。食品中ではネギ類に、その特有の辛味成分、またにおいの成分として、硫黄の化合物が含まれている。これらは、消化器を刺激し、食欲を増すとともに、ビタミンB1の吸収をよくするなどの働きがある。
[河野友美・山口米子]
『糸川嘉則編『ミネラルの事典』(2003・朝倉書店)』
硫黄(データノート)
いおうでーたのーと
硫黄
元素記号 S
原子番号 16
原子量 32.06
融点 α;112.8℃
β;119.6℃
γ;106.8℃
沸点 444.7℃
比重 α;2.07
β;1.96
γ;2.19
結晶系 α;斜方
β,γ;単斜
元素存在度 宇宙(Si106個当りの原子数)
5.60×105(第10位)
地殻 260ppm(第15位)
海水 (/mgL-1)885
改訂新版 世界大百科事典 「硫黄」の意味・わかりやすい解説
硫黄 (いおう)
sulfur
周期表第Ⅵb族に属するカルコゲン元素(造鉱物元素)の一つ。イギリスではかつてsulphurと書かれた。英語名は,サンスクリット語の〈火の元〉を意味するsulvereのラテン語sulphuriumに由来する。単体として産出するので古くから知られており,聖書にもブリムストンbrimstoneという名で登場する。古代ギリシアやローマでは二酸化硫黄を燻蒸(くんじよう)や漂白に用いていた。その後医薬または黒色火薬として広く用いられてきた。
存在
天然には遊離の状態で自然硫黄として,また広く鉄その他の重金属と結合した硫化物の黄鉄鉱FeS2,方鉛鉱PbS,セン亜鉛鉱ZnS,黄銅鉱CuFeS2など,硫酸塩のセッコウCaSO4・2H2O,硬セッコウCaSO4,重晶石BaSO4などとして産する。日本をはじめ,シチリア島,アイスランド,メキシコ,スペインなどの火山地帯では遊離硫黄(自然硫黄)を産し,アメリカのルイジアナ州,テキサス州にも多量の遊離硫黄の層が存在する。日本が輸入している精製用原油には平均1.53%(1980年)の硫黄が含まれる。温泉の硫黄泉と呼ばれるものには遊離硫黄が,硫化水素泉には硫化水素化物イオンHS⁻と硫化水素H2Sが2mg/kg以上含まれ,含セッコウ泉には硫酸イオンSO42⁻となって存在している。生物界でも重要な生体元素の一つとなっており,タンパク質に多く含まれる。自然硫黄などを昇華によって精製したものは硫黄華と呼ばれる。
硫黄の同素体
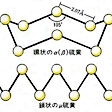
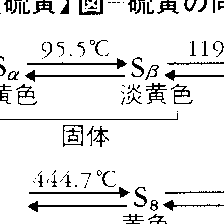
多くの同素体が存在し,その関係は複雑であるが,おもなものを図に示す。α硫黄Sαは斜方晶系,95.5℃以下で安定,融点112.8℃,比重2.07で,斜方硫黄ともいい,β硫黄Sβは単斜晶系,融点119℃,比重1.96で,単斜硫黄ともいう。Sα,Sβともに固体で,二硫化炭素CS2によく溶ける。Sαを徐々に熱すると,Sβを経て119℃で融解し,λ硫黄Sλとなる。加熱を続けると粘度を増して固まるが,再び濃褐色の粘稠な液状のμ硫黄Sμになる。ほかにπ硫黄の変態もあるとされる。そのほか無定形固体状のγ硫黄Sγ,δ硫黄Sδがある。熱した液状硫黄を水に注ぐとゴム状硫黄が得られるが,これは主としてSμからなるとされる。Sα,Sβ,Sλは王冠状のS8環状分子で,Sμは直鎖状のS6分子,SπはS4分子,ゴム状硫黄はらせん鎖状分子と考えられている。気体はS8,S6,S4,S2の分子の混合物で,温度上昇とともに低分子量のものが増し,1500℃以上では原子状硫黄も存在する。
製法
地下の硫黄鉱床から採取する方法と石油,天然ガスからの回収,排煙脱硫からの回収による方法がある。アメリカでは岩塩ドームの硫黄鉱床に直接パイプをさし入れ,これに熱水または高熱蒸気を圧入し,溶けた硫黄を吸い上げる方法(フラッシュ法)で安価に生産している。硫黄鉱床の規模が極度に大きいので,このような方法が実施できる。日本では,硫化物鉱石を焙焼(ばいしよう)する方法などで生産していたが,二酸化硫黄ガスが発生し公害発生源となるため,姿を消しつつある。逆に,石油,天然ガスの使用量が増大するとともに二酸化硫黄ガスの発生も増し,公害防止の目的から重油の水素化脱硫,燃焼ガスの排煙脱硫が行われ,回収硫黄の生産が伸びている。
→脱硫
性質
常温では黄色の固体。酸素と同じ負2価元素として金属と化合物をつくり,ほかに正4価,6価の元素としても多くの化合物をつくる。またカートネーション(自己結合)をする傾向が強いため,ポリ硫化物イオンSn2⁻(nは整数)などを生ずる。高温において非常に反応性が高く,金および白金を除くほとんどすべての金属と反応して硫化物をつくる。アルカリ金属,アルカリ土類金属とはイオン性硫化物をつくり,水に溶ける。水溶液中では硫化物イオンS2⁻は加水分解している。
S2⁻+H2O⇄SH⁻+OH⁻
二,三の遷移金属の硫化物(硫化鉄FeS,硫化コバルトCoS,硫化ニッケルNiSなど)は,金属イオンが硫黄原子によって八面体型にとり囲まれているヒ化ニッケル型構造であるが,金属-金属結合距離は2.60~2.68Åで比較的短いので半金属的な性質をもっている。硫黄は多くの金属と非化学量論的化合物をつくる。水素との化合物硫化水素H2Sは還元剤であり,炭素との化合物二硫化炭素CS2は溶媒として多く用いられ,またジチオカルバミン酸塩,キサントゲン酸塩の原料でもある。硫黄を空気中で燃焼させると青い炎をあげて燃え二酸化硫黄SO2を生ずる。これは水に溶けて亜硫酸H2SO3となる。SO2とO2を触媒の存在下で反応させると三酸化硫黄SO3が得られる。これは水と反応して硫酸H2SO4となる。そのほか種々多様なオキソ酸とその塩,たとえばチオ硫酸H2S2O3,ジチオン酸H2S2O6,二硫酸H2S2O7,ペルオキソ一硫酸H2SO5などが知られている。硫黄酸化物は有害で,大気汚染防止法に環境基準が設定されている。
用途
硫黄は化学工業の重要な基礎原料の一つで,二硫化炭素などの薬品原料,ゴムの加硫,パルプ工業,合成繊維工業,染料工業,医薬品工業などにおいて広く用いられている。硫酸は化学工業において重要な酸の一種であるが,日本では硫化鉱の精錬排ガス,火力発電所の重油燃焼排ガス中に含まれる二酸化硫黄を回収して製造し,硫黄鉱はほとんど使用されていない。放射性同位体35S(β⁻崩壊,半減期87日)は,硫黄の中性子照射によって容易に得られるので,含硫アミノ酸の代謝研究にトレーサーとして用いられる。
執筆者:漆山 秋雄
生体と硫黄
硫黄は生体を構成する必須元素の一つで,含硫アミノ酸(システイン,メチオニン)の成分としてタンパク質に含まれる。とくにシステインは,別のシステインと結合してジスルフィド(-S-S-)架橋を形成して,タンパク質の立体構造の形成・維持に重要な役割を果たす。また,ビタミンB1(チアミン),ビタミンH(ビオチン),ペニシリンなどの複素環式化合物にも含まれる。フェレドキシン,NADHデヒドロゲナーゼなど電子伝達系に重要な役割を果たす鉄-硫黄タンパク質の活性中心形成にも関与する。硫黄細菌は硫化水素H2Sを光合成における電子供与体として用い,無機硫黄あるいは硫酸を生成する。逆に脱硫酸細菌は硫酸を還元してH2Sを生成する。H2Sは,含硫アミノ酸ことにシステイン生合成における硫黄の供給源となる。
執筆者:柳田 充弘
日本における産出と輸出
日本には火山地帯が広く分布し,火山に関係ある硫黄鉱床が多く,古来諸所から硫黄を産した。《続日本紀》に8世紀初め相模,信濃,陸奥の諸国から硫黄を献じたことが見える。中世から近世にかけ豊後の九重山,薩摩の硫黄島は著名な硫黄産地であった。豊後速見郡の玖倍理湯井,鶴見山などは近世期に多量の硫黄を採取した。硫黄は鎌倉時代初めに南宋に輸出されており,日明貿易でも重要な輸出物であった。1451年(宝徳3)の遣明船には21万8640kgを積んでいる。朝鮮へは14世紀末足利義満が使船を送り,以来九州,中国の大小名が使船を派遣し,進物を進め綿布などを給与されたが,進物中に多量の硫黄があった。これら硫黄は石硫黄と記され自然生の硫黄鉱石である。近代において日本はアメリカに次いでイタリアとともに世界の硫黄主産地で,古来の九重山,硫黄島のほか,岩手県松尾鉱山,北海道幌別鉱山などが主産地となった。
執筆者:小葉田 淳
シンボリズム
錬金術の体系の中に,古代ギリシア以来の四大(地,水,火,風),四つの質(冷,熱,乾,湿)と並んで,硫黄,水銀,塩の〈三原質〉を取り入れるのは,遠くアラビアの錬金術師ゲーベル(ジャービル・ブン・ハイヤーン)に始まり,R.ベーコン,B.ウァレンティヌスらに継承されたが,この三分法を普及させたのはパラケルススである。三つとも,同名の化学物質をさすというより,物質のある種の特性を表す象徴的用語として,錬金術のシンボリズムに組み込まれた。硫黄は,男性原理,能動性,不揮発性を意味し,水銀が女性原理,受動性,揮発性を意味するのと対照をなす。ただし,錬金術における多くの用語がそうであるように,硫黄もテキストによって多義的で,〈白い硫黄〉〈赤い硫黄〉等さまざまな名称を与えられており,意味内容も一定しない。図像の上では,冠を戴く王の姿で表され,王妃の姿をした水銀との交合図で物質の結合と変容を示す場合が多い。
執筆者:有田 忠郎
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「硫黄」の解説
硫黄
イオウ
sulfur
S.原子番号16の元素.電子配置[Ne]3s23p4の周期表16族非金属元素.原子量32.065(5).天然には質量数32(94.99(26)%),33(0.75(2)%),34(4.25(24)%),36(0.01(1)%)の安定核種元素が存在し,ほかに質量数26~49の放射性同位体がある.硫黄は古くから知られていて,旧約聖書やホメロスのオデュッセイアにも出てくる.英語名はラテン語のsulpurからで,さらにその語源は火の元素を意味するサンスクリット語sulvereといわれている.宇田川榕菴は天保8年(1837年)に出版した「舎密開宗」で,須爾扶尓(シュレフュル)としている.「硫黄」は「ゆあわ」から変化した当て字とされる.
火山地方では遊離硫黄,硫化水素,二酸化硫黄として,地殻中では硫化物,硫酸塩として,また原油中では有機硫黄化合物として広く存在する.生体内にも有機化合物の成分として含まれる.融点115.21 ℃,沸点444.72 ℃.資源としては硫化鉱の精錬,天然ガスや石油の脱硫で副産する.精製は二硫化炭素からの再結晶か,固体のまま昇華させる.同素体の数がきわめて多く,主要なものとしては固体では斜方晶系硫黄(α硫黄),単斜晶系硫黄(β硫黄)が知られており,そのほか三方晶系硫黄もある.斜方晶系硫黄は最安定型で,16個の S8 からなる結晶単位格子をもつ黄色の結晶で,95.2 ℃ で単斜晶系硫黄に転移し,119.0 ℃ で融解する.α硫黄の融点は112.8 ℃.液体ではλ硫黄,μ硫黄が知られており,前者は硫黄を加熱融解すると最初にできる黄色の流動性液体で,157 ℃ 以上ではおもに後者を多く含む粘性度の高い濃褐色の液体となる.また気体では,王冠形 S8 分子に S6,S4,S2 などの分子が共存している.その他,γ硫黄,δ硫黄,無定形硫黄も知られている.密度はα 2.07 g cm-3(20 ℃),β 1.957 g cm-3(20 ℃).第一イオン化エネルギー10.360 eV.電気の不導体.水,無機酸に不溶であるが,各種有機無機溶媒に易溶.酸化数-2~6.S-Ⅱ,SⅣ,SⅥ化合物が多い.常温では反応性に乏しいが,高温では多くの非金属および金,白金,イリジウムを除く金属元素と直接反応し硫化物(S-Ⅱ化合物)を与え,その挙動は酸素に似ている.約250 ℃ で空気中で発火する.有機酸,アルコール,アルデヒド,エーテルなどの酸素を硫黄で置換した多数のチオ化合物が知られているが,どれもかなりの悪臭を有し,有毒である.硫黄はとくにカテナ化する傾向が強く,ほかのカルコゲンにはみられない化合物である.ポリ硫化イオン Sn2-,スルファン(sulfane)XSnX(XはH,ハロゲン,-CN,-NR2など),ポリチオン酸HO3S-Sn-SO3Hとその塩などがある.
硫黄はすべての生物に必要で,下等生物では単体硫黄,硫化物,亜硫酸塩,硫酸塩,チオ硫酸塩などの形で利用し,システイン,シスチン,メチオニンなどのアミノ酸をはじめ,そのほか多くの含硫有機化合物がすべての生物に利用されている.硫酸,二硫化炭素をはじめ種々の硫黄化合物の原料,肥料,農薬,医薬品などの製造に,弾性ゴムの加硫に用いられる.[CAS 7704-34-9]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「硫黄」の意味・わかりやすい解説
硫黄【いおう】
→関連項目太平洋戦争(日本)|脱硫|硫化染料
出典 株式会社平凡社百科事典マイペディアについて 情報
漢方薬・生薬・栄養成分がわかる事典 「硫黄」の解説
いおう【硫黄】
ブリタニカ国際大百科事典 小項目事典 「硫黄」の意味・わかりやすい解説
硫黄
いおう
sulfur
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
旺文社日本史事典 三訂版 「硫黄」の解説
硫黄
いおう
S
古来薬用や烽火 (のろし) などに利用。中世には火薬・付木 (つけぎ) 用として日明・日朝貿易の重要輸出品となる。当時のおもな産地は大隅国(鹿児島県)硫黄島。江戸時代は国内需要も多くなり,各地で生産された。
出典 旺文社日本史事典 三訂版旺文社日本史事典 三訂版について 情報
岩石学辞典 「硫黄」の解説
硫黄
栄養・生化学辞典 「硫黄」の解説
硫黄
最新 地学事典 「硫黄」の解説
いおう
硫黄
sulfur ,sulphur
⇒ 自然硫黄
出典 平凡社「最新 地学事典」最新 地学事典について 情報
世界大百科事典(旧版)内の硫黄の言及
【黄】より
…黄色がユダヤ人の象徴色とされるのは,本来彼らがヤハウェの光の色として黄色を使用したことに基づくらしい。他方,黄は硫黄の色で,硫黄は燃えると悪臭を放つところから,悪人を懲罰するためにしばしば用いられたことが聖書に見える(《創世記》19:24,《ヨブ記》18:15~18,《ヨハネの黙示録》19:20など)。この意味での黄色の使用は,中世ヨーロッパの〈ベアトゥス本〉の写本画に著しい。…
【塩】より
…また少量であったが金の精錬,ガラスの製造,治療剤にも用いられ,ときには油灯の炎を黄色にし,もっと明るい快適な照明を行うために使用され,またその防腐性を利用してミイラをつくるときにも死体を塩水に浸していた。【加茂 儀一】
[塩の象徴]
錬金術における硫黄・水銀・塩の〈三原質〉のうち,塩は硫黄と水銀の中間項として,両者を媒介する運動と考えられ,それを通じて水銀(質料)が硫黄(形相)に結びつくとされる。そのため,硫黄を王,水銀を王妃で表す婚姻図において,塩を僧侶の姿で描き,両者を結びつける役割をもつことを示す場合もあった(B.ウァレンティヌス《哲学の十二の鍵》)。…
【四大】より
…しかしその際,四元素よりも変成の妙を発揮する水銀が物質変換の中心的存在となった。また物質それ自体は生物と同様に増成するという観点から,男性的原理と女性的原理の拮抗・融和によって物質の変化をとらえるという考えが定着し,水銀が女性原理を,硫黄が男性原理を代表するという硫黄―水銀の原素論がアラビア世界を通じて登場した。これがさらには,三位一体のキリスト教的発想も手伝い,塩という中性要素を加えた硫黄―塩―水銀の三原素説が四元素に優先する考えになった。…
【太陽】より
…これが〈通常の黄金〉と異なる〈真の黄金〉で,神的ないぶきをはらむその霊妙な性質のため,これを〈賢者の石〉そのものとみなすこともあった。錬金術の化学過程を示す図像では,太陽は三原質の一つである〈硫黄〉の象徴とされることが多い。この場合,三原質のもう一つの元素である水銀は月で表され,物質の結合と変容のプロセスは,男性である太陽と女性である月との交合図ないしは婚姻図で表された。…
※「硫黄」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...