翻訳|hydrazine
精選版 日本国語大辞典 「ヒドラジン」の意味・読み・例文・類語
ヒドラジン
改訂新版 世界大百科事典 「ヒドラジン」の意味・わかりやすい解説
ヒドラジン
hydrazine
化学式H2NNH2。アンモニアに似た臭いのする無色の液体。空気中で発煙する。融点1.4℃。沸点113.5℃。水,アルコールに任意の割合でまざる。N-N結合の長さは1.47Å,二つの非共有電子対の間のねじれ角は90度である(図参照)。液体状態では安定だが,気体状態では不安定で,きわめて燃えやすい。空気あるいは金属の存在下に加熱したり,紫外線を照射すると,爆発的に分解して,窒素とアンモニア,または水素と窒素を生ずる。
3NH2NH2─→4NH3+N2
NH2NH2─→2H2+N2
強力な還元剤である。二酸塩基で,N2H5⁺およびN2H62⁺の2系列の塩を作り,これらはヒドラジニウム塩とよばれる。塩基解離指数(20℃)はpK1=5.89,pK2=14.88。非常に有毒で,皮膚,粘膜,肝臓などに障害を引き起こす。
工業的な合成法には次のものがある。
(1)次亜塩素酸ナトリウムNaOClとアンモニアとを反応させて生ずるクロロアミンNH2Clに,水酸化ナトリウム水溶液中で過剰のアンモニアを作用させる。
NH3+NaOCl─→NH2Cl+NaOH
NH2Cl+NH3+NaOH─→NH2NH2+NaCl+H2O
(2)水酸化ナトリウムの水溶液中で,尿素(NH2)2COと次亜塩素酸ナトリウムとを反応させる。
(NH2)2CO+NaOCl+2NaOH─→NH2NH2+NaCl+Na2CO3
+H2O
高圧ボイラーの脱酸素剤,ロケット推進薬,燃料電池の燃料,発泡剤の原料,医薬,農薬の合成原料などに用いられる。なお,フェニルヒドラジンなどの炭化水素基置換体を総称してヒドラジン類とよぶ。
執筆者:小川 桂一郎
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「ヒドラジン」の解説
ヒドラジン
ヒドラジン
hydrazine
H2N-NH2(市販品の多くは一水和物)と,そのHを炭化水素基で置換した化合物(ヒドラジン類)をいう.【Ⅰ】N2H4(32.05)(一水和物は,N2H4・H2O(50.06)):体系名はジアザン(diazane).硫酸ヒドラジニウムにNaOHを反応させた後,N2 中で蒸留すると一水和物が得られる.これを脱水すると無水物も得られる.また,直接Rasching法で,ゼラチンなどを制御剤として,NH3または尿素を,NaClOまたはさらし粉とNa2CO3の混合物とをアルカリ水溶液中で酸化すると得られる.気体では,H2N-NH2分子.N-N約1.45 Å,N-H約1.04 Å.∠N-N-H約112°.両方のH-N-H面の二面角約90~95°.単斜晶系.Hは隣接分子のNと水素結合している.N-N約1.45 Å,N…H約3.19~3.30 Å.無水物は,アンモニア臭のある液体で,空気中で発煙する.融点2.0 ℃,沸点113.5 ℃.密度1.00 g cm-3(25 ℃).180 ℃ で N2 とNH3に分解する.一水和物も発煙性の液体で,沸点118 ℃.密度約1.03 g cm-3(20 ℃).いずれも水,エタノールに易溶,クロロホルムやエーテルに不溶.塩基で,K1b 8.5×10-7,Kb2 8.9×10-15(25 ℃).還元性が大きい.塩,S,Pなどを溶かす.無水ヒドラジンと酸素または空気の混合物は加熱すると燃焼する.猛毒で皮膚をおかす.腐食性も大きく,コルク,ゴム,ガラスなども侵す.還元剤,無機物の溶媒,発泡剤,農薬や医薬品の製造過程での使用,ロケット燃料の原料,清缶剤などに用いられる.[CAS 302-01-2:無水物][CAS 7808-57-8:一水和物]【Ⅱ】有機誘導体:たとえば,アルデヒド,ケトン,糖などの確認に広く用いられるフェニルヒドラジンC6H5NHNH2,ロケット燃料になるジメチルヒドラジン(CH3)2NNH2など.これらヒドラジン誘導体は,一般にカルボニル化合物からヒドラゾン,オサゾンを,カルボン酸からヒドラジドをつくり,特徴のある反応を示す.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
日本大百科全書(ニッポニカ) 「ヒドラジン」の意味・わかりやすい解説
ヒドラジン
ひどらじん
hydrazine
窒素と水素の化合物。アンモニアまたは尿素を次亜塩素酸塩で酸化するラーシッヒ法で製造される。
NH3+NaOCl―→NH2Cl+NaOH
NH2Cl+NH3+NaOH
→N2H4+NaCl+H2O
最終的にヒドラジン一水和物の濃水溶液として得られる。重金属イオンが存在すると収量が低下するので、キレート剤、にかわなどを加える。次亜塩素酸塩のかわりに塩素とアセトンを用いるバイヤー法もある。
無水ヒドラジンは無色、発煙性、アンモニア臭の油状液体。空気中では発煙する。強熱すると爆発する。水に易溶。弱い塩基でヒドラジニウム塩(一般式N2H5XおよびN2H6X2、Xは1価の陰性原子または基)をつくる。硫酸塩N2H6SO4は水に溶けにくい。水溶液は還元作用があり、銀塩溶液から銀を沈殿させ、鉄(Ⅲ)塩を鉄(Ⅱ)塩に変える。溶存酸素により窒素を生じる。酸化剤となることもある。
一水和物N2H4・H2Oは無色、発煙性の液体。式量50.1。融点-51.7℃。沸点は118.5℃(水銀柱740ミリメートル)。比重1.0305(25℃)。二大用途は高圧ボイラー用水の脱酸素剤と高分子材料の発泡剤で、ついで農薬用、医薬用である。過酸化水素とともにロケット推進薬の燃料として用いられる。また燃料電池などにも用いられる。きわめて有毒。
[守永健一・中原勝儼]
ヒドラジン(データノート)
ひどらじんでーたのーと
ヒドラジン
NH2NH2
式量 32.0
融点 1.4℃
沸点 113.5℃
比重 1.011(測定温度15℃)
屈折率 (n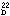 ) 1.470
) 1.470
百科事典マイペディア 「ヒドラジン」の意味・わかりやすい解説
ヒドラジン
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「ヒドラジン」の意味・わかりやすい解説
ヒドラジン
hydrazine
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「ヒドラジン」の解説
ヒドラジン
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...


