精選版 日本国語大辞典 「水素イオン濃度」の意味・読み・例文・類語
すいそイオン‐のうど【水素イオン濃度】
日本大百科全書(ニッポニカ) 「水素イオン濃度」の意味・わかりやすい解説
水素イオン濃度
すいそいおんのうど
hydrogen-ion concentration
溶液中の水素イオンの濃度をいう。濃度の表し方はもっとも普通には、溶液1立方デシメートル中に存在する水素イオンのモル数またはグラム当量数を用い、これをモル濃度または規定度という。水素イオンは1モルが1グラム当量なのでモル濃度と規定度は同じである。この値は非常に広範囲に変化するので、便宜上、通常、水素イオン指数を用いて表す。
[成澤芳男]
水素イオン指数
水素イオン濃度指数ともいう。水素イオンのモル濃度の逆数の常用対数のことで、pHと書き、英語読みではピーエイチ、ドイツ語読みではペーハーとなる。pHの概念は1909年デンマークのセーレンセンSøren Peter Lauritz Sørensen(1868―1939)により提唱され、前記の定義は24年に彼が提案したものである。
純水H2Oは次のように電離し、平衡に達する。
H2O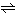 H++OH-
H++OH-
この電離により生じる水素イオンは、記号H+で示されるように水素原子から電子が取り除かれたプロトン(陽子)ではなく、実際には水溶液中では水分子と結合したH2n+1On+(n=1~4)というオキソニウムイオンとして存在し、とくにH3O+(n=1)をヒドロニウムイオンという。したがって、水の電離は、
2H2O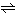 H3O++OH-
H3O++OH-
と書くことがあるが、化学の分野では水溶液中のH3O+などをH+と書く習慣がある。25℃における水のイオン積Kwは、
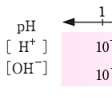
Kw=[H+][OH-]
=1.00×10-14
であり、純水の電離においては[H+]=[OH-]であることから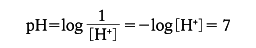
となる。すなわち中性溶液のpHは7であり、それより水素イオン濃度が大きいときpHは7より小さくなり、その溶液は酸性であるといい、その逆にpHが7より大きいとき溶液はアルカリ性(塩基性)であるという。
塩酸のような強酸は水溶液中で完全電離し、水素イオン濃度は溶解している酸の濃度で表される。たとえば、10-5M塩酸の水素イオン濃度は10-5Mとなり、pH=5と考えてよい。しかし、10-8M塩酸の水素イオン濃度は10-8M、すなわちpH=8としてはいけない。塩酸濃度が非常に小さくても酸であるから、pHは7より小さくなければならない。10-5M程度より低い濃度の場合は、水の電離による水素イオン濃度を考慮しなくてはならなくなるからである。10-8M塩酸の水素イオン濃度を求めてみる。溶液中には塩酸の電離で生じた水素イオンと塩化物イオンの濃度はそれぞれ、[H+]=10-8M、[Cl-]=10-8Mである。同時に水の電離で生じた水素イオンと水酸化物イオンが存在し、それをxMとすると、水素イオン濃度は[H+]=x+10-8M、水酸化物イオン濃度は[OH-]=xMとなる。水のイオン積を用いて解くと
[H+]×[OH-]=(x+10-8)×x
=Kw=10-14
x=0.95×10-7M,[H+]=1.05×10-7M
pH=6.98
となる。酸である限り、限りなく7に近づくが、7を超えることはない。この例では塩酸の電離で生じる水素イオン濃度に比べて、水の電離で生じる水素イオン濃度のほうが9.5倍も大きい。つまり水の電離が非常に重要なのである。アルカリの場合は逆に、7より小さくなることはない。
[成澤芳男]
水素イオン濃度を測定する方法
大別して電位差法と酸塩基指示薬を用いる方法がある。前者は検液を用いて水素電極をつくり、これを標準水素電極と組み合わせてその濃淡電池(濃度の異なる相と相の間の物質移動を生ずる電池)の起電力を測定するか、甘汞(かんこう)電極(カロメル電極)と組み合わせて電池をつくり、その起電力を測定する方法である。水素電極は取扱いがめんどうであるから、ガラス電極を用いpHを測定する方法、キンヒドロン電極、アンチモン電極などを用いる方法もある。酸塩基指示薬を用いる方法は、水素イオン濃度既知の標準液をいくつか用意し、これを同体積の試験管に等量ずつ入れ指示薬を等量加えて比色標準液をつくり、検液にも同一条件で指示薬を加え、その呈色を比較する。そのほか、簡単に行うにはpH試験紙を用い、その呈色を標準と比較する方法がある。指示薬法によるときは、緩衝能のない溶液では指示薬自身の酸性または塩基性によって溶液のpHが変化すること(酸塩基誤差)、塩の共存による影響(塩誤差)、タンパク質、アルカロイドなどへの色素の吸着(タンパク誤差、アルカロイド誤差)などを考慮しないとpH測定に誤差が生じる。
水素イオン濃度は溶液の酸性の度合いを示し、化学のあらゆる分野において重要な量であり、溶液中の水素イオン濃度があまり変化しないような緩衝能をもつ各種pHの緩衝溶液が知られている。
[成澤芳男]
『益子安著『分析ライブラリー11 pHの理論と測定』(1981・東京化学同人)』▽『ダグラス・ダルゼル・ペリン、ボイド・デンプシー著、辻啓一訳『緩衝液の選択と応用 水素イオン・金属イオン』(1981・講談社)』▽『喜多英明・市川和彦著『大学の基礎化学』(1985・学術図書出版社)』▽『佐藤弦・本橋亮一著『化学セミナー13 pHを測る』(1987・丸善)』▽『竹原善一郎著『新化学ライブラリー 電池――その化学と材料』(1988・大日本図書)』▽『玉虫伶太著『電気化学』第2版(1991・東京化学同人)』▽『森本安夫著『ザ・ペーハー あなたのはいくつ?』(2003・新風舎)』
化学辞典 第2版 「水素イオン濃度」の解説
水素イオン濃度
スイソイオンノウド
hydrogen ion concentration
溶液中の水素イオン H+ の濃度をいい,1 L の溶液中に存在する水素イオンの物質量を意味する.この値は非常に広範囲に変化するので,便利のため,通常,この値の常用対数をとり負号をつけて表し,pH の記号で示す.水素イオン濃度は溶液の酸性の強さを表し,分析化学,コロイド化学,生化学,そのほかの化学の各分野とその応用面で重要な量である.水素イオン濃度を測定する方法には,大別して電位差測定法と水素イオン濃度指示薬を用いる比色測定法とがある.電位差測定法は,被検液を用いてつくった水素電極を適当な参照電極(たとえば,カロメル電極,銀-塩化銀電極など)と組み合わせてガルバニ電池をつくり,その平衡電圧を測定して求める方法である.水素電極は取り扱いが面倒であるので,キンヒドロン電極,アンチモン電極などを用いる方法もあるが,ガラス電極を用いる方法が広く用いられている.比色測定法の場合には,水素イオン濃度既知の標準液をいくつか用意し,これらを同体積の試験管に等量ずつ入れ,指示薬を等量加えて比色標準液をつくる.一方,被検液にも同一条件で指示薬を加え,その呈色を標準液と比較して水素イオン濃度を決定する.正確に行うには比色計を用いる.簡単にはpH試験紙を用い,その呈色を標準と比較する.指示薬法の場合には,酸誤差,塩誤差,アルカロイド誤差,タンパク誤差などを考えないと誤差がいちじるしく大きくなるおそれがある.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「水素イオン濃度」の意味・わかりやすい解説
水素イオン濃度
すいそイオンのうど
hydrogen ion concentration
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
最新 地学事典 「水素イオン濃度」の解説
すいそイオンのうど
水素イオン濃度
hydrogen ion concentration
水溶液中で水素を含む物質の解離により生じる水素イオンの濃度。溶液の酸性度の指標で,ふつう,次式で定義されるpHで表される。pH=-log[H+]。ただし,[H+]は水素イオンの活量。pHは被検液中に浸したガラス電極と参照電極との間の起電力の測定から得られる。25℃の純水のpHは7(中性)であるが,高温では水の解離定数が大きくなるため高温における純水のpHはもっと小さくなる。地殻を構成する鉱物は弱酸と反応して含水鉱物になるので,pHはこれらの安定領域を決める重要な要素である。水素イオンはプロトンとしてよりは水和形のヒドロニウムイオン(H3O+)として存在する。
執筆者:日下部 実
出典 平凡社「最新 地学事典」最新 地学事典について 情報
百科事典マイペディア 「水素イオン濃度」の意味・わかりやすい解説
出典 株式会社平凡社百科事典マイペディアについて 情報
改訂新版 世界大百科事典 「水素イオン濃度」の意味・わかりやすい解説
水素イオン濃度 (すいそイオンのうど)
→pH(ピーエッチ)
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
世界大百科事典(旧版)内の水素イオン濃度の言及
【湖沼】より
…また海水の侵入する湖を汽水湖と呼ぶ。(a)水素イオン濃度(pH) 湖水のpHはナクル湖(ケニア)の12や潟沼(鳴子)の2前後のように極端なものを除いて,だいたい6~8の中性のものが大部分である。強酸性の湖水は,火山が起源の硫酸による。…
【pH】より
…XはX=pH=-log10CHのようにも書きなおされる。厳密には,水素イオン濃度ではなく,有効濃度ともいうべき水素イオンの活量(または活動度)aHで定義される。すなわち,pH=-log10aHである。…
※「水素イオン濃度」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...