精選版 日本国語大辞典 「沸点上昇」の意味・読み・例文・類語
ふってん‐じょうしょう‥ジャウショウ【沸点上昇】
- 〘 名詞 〙 不揮発性の溶質が溶けこむと、溶媒だけのときよりも沸点が上昇する現象。
改訂新版 世界大百科事典 「沸点上昇」の意味・わかりやすい解説
沸点上昇 (ふってんじょうしょう)
elevation of boiling point
純粋な液体はその物質固有の一定温度(沸点)で沸騰するが,それに不揮発性の溶質を溶解させるとその沸点が上昇する。この現象を沸点上昇という。これは溶解した第2成分が純溶媒の蒸気圧を降下させるために起こることで,同じ原因がその液体の凝固点降下となっても表れる。沸点上昇の大きさ⊿Tは加えた溶質の量に比例することが熱力学的に導かれる。
⊿T=Kbn=Kbw/M
nは溶媒1kgに加えた溶質の物質量(単位mol)である。Kbはその液体の沸点や蒸発熱の大きさによって決定される溶媒固有の定数で,モル上昇molar elevationあるいは分子上昇molecular elevationと呼ばれる。wは溶媒1kgに溶かした溶質の質量,Mはその分子量である。Kbの値は,たとえば水の場合0.51となる。すなわち,水1kgにショ糖1mol(約342g)を加えた水溶液の沸点は100.51℃になることを示す。グルコース(分子量約180)でもナフタレン(分子量約128)でも同じ1molならば同じ沸点上昇を示し,束一的性質と呼ばれるゆえんである。この性質のため,未知物質の一定質量wをKb既知の溶媒に溶かして沸点上昇⊿Tを求めれば,未知物質の分子量Mを決定することができる。この方法は沸点法ebullioscopy(boiling point method)と呼ばれ,凝固点降下を利用した氷点法とともに,よく分子量決定に用いられてきた。ただし,食塩NaClなどの塩類は水中でイオンに解離するので,この式は成立せず,一般に⊿Tは計算値より大きくなる。また,溶媒と溶質の間に特殊な相互作用が存在する場合にも成立しない。溶質が揮発性のときには,必ずしも沸点が上昇するとは限らず,降下する例もある。
執筆者:菅 宏
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「沸点上昇」の意味・わかりやすい解説
沸点上昇
ふってんじょうしょう
elevation of boiling point
boiling point rise
不揮発性物質を溶かした溶液の沸点が溶媒の沸点より上昇する現象をいう。略号BPR。融点の場合には、溶液の融点が溶媒の融点より低くなる(これを凝固点降下という)が、両者とも溶液と溶媒の蒸気圧曲線の差から説明できる。すなわち、溶媒の蒸気圧をp1、溶液のそれをp2とすると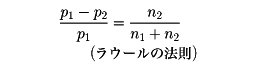
ここで、n1、n2はそれぞれ溶媒・溶質のモル数であり、式の右辺は溶質のモル分率を与える。溶媒の蒸気圧は不揮発性物質が溶解することによって低下する。沸点は蒸気圧が大気圧になったときの温度であるから、溶媒ではT1、溶液ではT2となる。T2とT1との差が沸点上昇になる。式に示したように、この上昇の割合は溶質の濃度に比例する。ΔT=Kbn。ここでKbを分子上昇といい、溶媒1000グラムに溶質1モルを溶かしたときの溶媒に固有な値である。
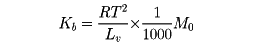
ここで、Lvは蒸発熱、M0は分子量である。たとえば、水のKbは0.515、ベンゼンは2.67、アセトンは1.19である。
[下沢 隆]
百科事典マイペディア 「沸点上昇」の意味・わかりやすい解説
沸点上昇【ふってんじょうしょう】
→関連項目凝固点降下|沸点|分子量
出典 株式会社平凡社百科事典マイペディアについて 情報
化学辞典 第2版 「沸点上昇」の解説
沸点上昇
フッテンジョウショウ
elevation of boiling point
溶液の沸点と純溶媒の沸点との差をいう.溶媒1 kg に物質量mの溶質を含む溶液の沸点上昇ΔTは,mに比例する.すなわち,
ΔT = Kbm
であって,ここで,Kb はモル沸点上昇である.この関係を利用して,希薄溶液でのΔTから溶質の分子量を求めることができる.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「沸点上昇」の意味・わかりやすい解説
沸点上昇
ふってんじょうしょう
elevation of boiling point
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「沸点上昇」の解説
沸点上昇
世界大百科事典(旧版)内の沸点上昇の言及
【沸騰】より
…純粋液体では,圧力が一定であれば沸騰中の温度は一定に保たれるが,溶液の場合は気化の結果として濃度が変化するのに応じて沸点が移動する。溶媒の沸点は,不揮発性の溶質を溶かすと上昇するが,この現象を沸点上昇という。沸点上昇は,同じ溶媒の希薄溶液では,溶質の種類によらず同じモル濃度に対しては同一である。…
【分子】より
…この溶質の挙動は気体分子の運動と同じように考えて,アボガドロの法則を適用し,浸透圧から分子量を求めることができる。 古くから用いられている分子量の測定法に,溶液の沸点上昇と凝固点降下がある。水は0℃で凍るが,海水は0℃になっても凍結せず,また砂糖水も0℃では凍らない。…
※「沸点上昇」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

