酸化マンガン (さんかマンガン)
manganese oxide
酸化数Ⅱ,Ⅲ,Ⅳ,Ⅶのマンガンの酸化物と,ⅡとⅢの両方およびⅡとⅣの両方を含む酸化物が知られている。
酸化マンガン(Ⅱ)
化学式MnO。天然には緑マンガン鉱として産出。炭酸マンガン(Ⅱ)MnCO3などを空気を断って加熱するか高級酸化物を水素などで還元すると得られる。緑色粉末。比重5.43~5.46,融点1650℃,モース硬さ5~6。低温で反強磁性。酸素を吸着しやすく組成はMnO1 13まで変化する。酸素中で加熱すると酸化マンガン(Ⅲ)を生ずる。水素と1200℃以上に熱すると金属に還元される。水に不溶。酸に溶けて相当するマンガン(Ⅱ)塩を生ずる。塩化アンモニウムNH4Clの熱濃溶液に溶けアンモニアを発生して塩化マンガン(Ⅱ)MnCl2となる。
13まで変化する。酸素中で加熱すると酸化マンガン(Ⅲ)を生ずる。水素と1200℃以上に熱すると金属に還元される。水に不溶。酸に溶けて相当するマンガン(Ⅱ)塩を生ずる。塩化アンモニウムNH4Clの熱濃溶液に溶けアンモニアを発生して塩化マンガン(Ⅱ)MnCl2となる。
酸化マンガン(Ⅲ)マンガン(Ⅱ)
四酸化三マンガンともいう。化学式Mn3O4(MnⅡMnⅢ2O4)。天然にはハウスマン鉱(黒マンガン鉱)として産する。金属マンガンあるいはマンガンの化合物を空気中または酸素中,約1000℃に強熱すれば得られる。黒色結晶。格子はひずんだスピネル型構造。比重4.718,融点1705℃。水に不溶,塩酸,硫酸に溶ける。
酸化マンガン(Ⅲ)
化学式Mn2O3。α型とγ型の2変態がある。天然にはα型がブラウン鉱(Mn,Si)2O3(Mn:Si=7:1)として産する。α型はβ-MnO2を空気中で650℃に加熱すると得られ,γ型はγ-MnO(OH)を減圧下で長時間加熱,脱水して得られる。真空中で500℃に48時間加熱するとγ→αの転移が起こる。黒色固体。比重4.81。空気中で940℃以上に加熱するとMn3O4になる。酸に溶け,条件によりマンガン(Ⅲ)塩あるいはマンガン(Ⅱ)塩と酸化マンガン(Ⅳ)とを生ずる。
酸化マンガン(Ⅳ)マンガン(Ⅱ)
化学式Mn5O8(MnⅡ2MnⅣ3O8)。Mn3O4を窒素-酸素混合物中250~550℃で加熱するか,β-MnO(OH)を同じ温度で熱分解すると得られる。結晶構造はCd2Mn3O8と同型。
酸化マンガン(Ⅳ)
化学式MnO2。二酸化マンガンともいう。多数の変態がある。天然にはパイロルース鉱(軟マンガン鉱)として産する。不定比化合物で酸素が不足しており,沈殿で得たものは水を含む。β型は硝酸マンガン(Ⅱ)Mn(NO3)2を空気中で150~190℃で長時間加熱すると得られる。γ型は硫酸マンガン(Ⅱ)MnSO4を硫酸酸性で電解酸化すれば得られる。黒色粉末,比重5.026。強熱すると酸素を放ってMn3O4になる。水,硝酸,硫酸に不溶。塩酸には塩素を発生してゆっくり溶ける。過酸化水素あるいはシュウ酸の存在で硫酸あるいは硝酸に溶ける。過酸化水素および塩素酸カリウムを接触的に分解する。マンガンおよびその化合物の原料,マンガン鋼,酸化剤,乾電池の減極剤,ガラスの着色剤,陶磁器のうわぐすり,染料,顔料,ペンキとワニスの乾燥剤など,用途が広い。
酸化マンガン(Ⅶ)
化学式Mn2O7。過マンガン酸カリウムKMnO4を濃硫酸に加えると得られる。緑色光沢をもつ暗褐色油状液体。比重2.4。-5℃まで安定であるが,0℃で酸素を放ちはじめ,10℃で激しく分解して酸化マンガン(Ⅳ)になる。水に溶けて過マンガン酸を生ずる。濃硫酸,リン酸に可溶。可燃性物質に触れると爆発的に反応する。
執筆者:近藤 幸夫
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
Sponserd by 
酸化マンガン
さんかまんがん
manganese oxide
マンガンと酸素の化合物で、マンガンの酸化状態により次のものが普通に知られる。
(1)酸化マンガン(Ⅱ) 一酸化マンガンともいう。天然に緑マンガン鉱(りょくまんがんこう)として産出。高級酸化物を水素で還元すると得られる。灰緑色粉末または緑黄色結晶で、岩塩型構造。塩基性酸化物で、酸に溶けてピンク色のマンガン(Ⅱ)塩を生じる。
(2)酸化マンガン(Ⅳ)二マンガン(Ⅱ) 四酸化三マンガンともいう。ハウスマン鉱として産出。ほかのマンガン酸化物を空気中で約1000℃に熱して得られる。黒色金属光沢のある結晶。正方晶系、ひずんだスピネル型構造で、Mn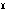 2Mn
2Mn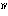 O4にあたる。化学式Mn3O4、式量228.8。塩酸と熱すると塩素を発して塩化マンガン(Ⅱ)となる。
O4にあたる。化学式Mn3O4、式量228.8。塩酸と熱すると塩素を発して塩化マンガン(Ⅱ)となる。
(3)酸化マンガン(Ⅲ) 三酸化二マンガンともいう。ブラウン鉱として産出。酸化マンガン(Ⅳ)またはマンガン(Ⅱ)塩を空気中で600~800℃に熱すると得られる。黒色、立方晶系と正方晶系のものがある。
(4)八酸化三マンガン(Ⅳ)二マンガン(Ⅱ) 四酸化三マンガンを窒素‐酸素混合気体中で250~550℃に熱すると得られる。黒色晶。水に不溶。Mn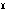 2Mn
2Mn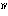 3O8に相当する。
3O8に相当する。
(5)酸化マンガン(Ⅳ) 二酸化マンガンともいう。各種の変態が知られており、天然にはα(アルファ)型が硬マンガン鉱として、β(ベータ)型がパイロルース鉱(軟マンガン鉱)として産出。硝酸マンガン(Ⅱ)を焼いてつくる。灰色から灰黒色の粉末。正方晶系でルチル型構造。水に溶けず、両性酸化物であるが、希酸やアルカリに作用しにくい。冷濃塩酸に溶けて暗緑色の溶液(MnCl62-)を生じるが、熱すると分解して塩化マンガン(Ⅱ)と塩素を発する。熱濃アルカリ溶液に溶けて3価(おそらくMn(OH)63-)と5価(MnO43-)を含む紫色溶液を生じる。γ(ガンマ)型が乾電池の減極剤に用いられる。ガラスの色消、触媒、マッチの原料、その他酸化剤としての用途が広い。
(6)酸化マンガン(Ⅶ) 七酸化二マンガンともいう。冷濃硫酸と過マンガン酸カリウムの反応によって得られる。化学式Mn2O7、式量221.9。暗緑褐色の油状液で、きわめて爆発しやすく危険。有機物と接触すると爆発する。水に溶けて過マンガン酸の紫色溶液を生ずる。融点5.9℃。比重2.4(20℃)。
Mn2O7+H2O―→2HMnO4
[守永健一・中原勝儼]
酸化マンガン(データノート1)
さんかまんがんでーたのーと
酸化マンガン(Ⅱ)
MnO
式量 70.9
融点 1650℃
沸点 ―
比重 5.43~5.46
結晶系 立方
屈折率 (nD) 2.16
酸化マンガン(データノート2)
さんかまんがんでーたのーと
酸化マンガン(Ⅲ)
Mn2O3
式量 157.9
融点 ―
沸点 ―
比重 4.81
出典 小学館 日本大百科全書(ニッポニカ)日本大百科全書(ニッポニカ)について 情報 | 凡例
Sponserd by 
酸化マンガン
サンカマンガン
manganese oxide
MnO,Mn3O4,Mn2O3,MnO2およびMn2O7などが知られている.酸化状態の低いMnOは塩基性酸化物,酸化状態の高いMn2O7は酸性酸化物で,中間のMnO2などは両性酸化物である.【Ⅰ】酸化マンガン(Ⅱ):MnO(70.94).一酸化マンガンともいう.天然には緑マンガン鉱として産出する.炭酸マンガンを水素または窒素中で焼くか,二酸化マンガンをヒドラジンで還元すると得られる.灰緑色の粉末.塩化ナトリウム型構造.密度5.18 g cm-3.融点1650 ℃.水素還元を受けにくい.塩基性酸化物で,塩酸,硝酸,硫酸などに溶けて,マンガン(Ⅱ)の塩を与える.触媒,陶磁器,乾電池,媒染剤,磁性材料の原料などに用いられる.[CAS 1344-43-0]【Ⅱ】酸化マンガン(Ⅲ):Mn2O3(157.87).三酸化二マンガンともいう.α形とγ形の2変態がある.α形はMnO2を酸素中で550~900 ℃ に加熱すると得られる.天然にはブラウン鉱として産出する.黒色の立方晶系結晶.密度4.81 g cm-3.γ形はMnO(OH)を真空中で250 ℃ に加熱して得られる.正方晶系の黒色の粉末.不安定型で加熱によりα形にかわりγ形に戻らない.空気中で940 ℃ 以上に加熱すると O2 を放出してMn3O4となる.ガラス工業,窯業用着色剤などに用いられる.[CAS 1317-34-6]【Ⅲ】酸化二マンガン(Ⅲ)マンガン(Ⅱ):Mn3O4(228.81).四酸化三マンガンともいう.天然には,ハウスマン鉱として産出する.金属マンガンまたはマンガン化合物を空気中で940 ℃ 以上に強熱すると得られる.黒色の結晶.密度4.72 g cm-3.融点1564 ℃.酸素を吸収しやすく,組成は非化学量論的である.濃塩酸に溶けて塩素を発生して MnⅡを生じる.熱濃硫酸には酸素を発生して溶け MnⅡとなる.鉄鋼添加剤に用いられる.[CAS 1317-35-7]【Ⅳ】酸化マンガン(Ⅳ):MnO2(86.94).二酸化マンガンともいう.[CAS 1313-13-9]【Ⅴ】酸化マンガン(Ⅶ):Mn2O7(221.87).七酸化二マンガンともいう.冷濃硫酸に過マンガン酸カリウムの粉末を少量ずつ加えて得られる緑色溶液に,注意して冷水を加えると,暗褐色の油状液として得られる.密度2.4 g cm-3.液体空気で冷やすと暗緑色の結晶となる.このものは-5 ℃ までは安定であるが,0 ℃ では酸素を発して分解する.常温では爆発的に分解し,MnO2 + O2 となる.有機物に触れると爆発する危険物質である.[CAS 12057-92-0]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
Sponserd by 
酸化マンガン
さんかマンガン
manganese oxide
酸化数2,3,4,7の化合物がある。酸化マンガン (II) MnO は緑マンガン鉱,四酸化二マンガン (III) マンガン (II) Mn3O4 は黒マンガン鉱,酸化マンガン (III) ,三酸化二マンガン Mn2O3 は水マンガン鉱,酸化マンガン (VI) ,二酸化マンガン MnO2 は軟マンガン鉱として天然に産出する。これらの酸化物のうち,特に重要なのは二酸化マンガンで,黒褐色の粉末である。加熱すると酸素を発生し,四酸化三マンガンを残す。塩酸を除く酸には難溶。塩酸と反応して塩素を発生し,塩化マンガンとなる。強烈な酸化剤で,有機物,硫黄,硫化物などと加熱したり,摩擦したりすると爆発し危険。酸化剤,マンガン鋼の製造,乾電池,陶磁器用絵具,紫色ガラスの製造,顔料,染色,電子工業などに広範な用途がある。
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
Sponserd by 
世界大百科事典(旧版)内の酸化マンガンの言及
【酸化マンガン】より
…酸化数II,III,IV,VIIのマンガンの酸化物と,IIとIIIの両方およびIIとIVの両方を含む酸化物が知られている。
[酸化マンガン(II)]
化学式MnO。天然には緑マンガン鉱として産出。…
【酸化マンガン】より
…酸化数II,III,IV,VIIのマンガンの酸化物と,IIとIIIの両方およびIIとIVの両方を含む酸化物が知られている。
[酸化マンガン(II)]
化学式MnO。天然には緑マンガン鉱として産出。…
【酸化マンガン】より
…酸化数II,III,IV,VIIのマンガンの酸化物と,IIとIIIの両方およびIIとIVの両方を含む酸化物が知られている。
[酸化マンガン(II)]
化学式MnO。天然には緑マンガン鉱として産出。…
※「酸化マンガン」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
Sponserd by 
 13まで変化する。酸素中で加熱すると酸化マンガン(Ⅲ)を生ずる。水素と1200℃以上に熱すると金属に還元される。水に不溶。酸に溶けて相当するマンガン(Ⅱ)塩を生ずる。塩化アンモニウムNH4Clの熱濃溶液に溶けアンモニアを発生して塩化マンガン(Ⅱ)MnCl2となる。
13まで変化する。酸素中で加熱すると酸化マンガン(Ⅲ)を生ずる。水素と1200℃以上に熱すると金属に還元される。水に不溶。酸に溶けて相当するマンガン(Ⅱ)塩を生ずる。塩化アンモニウムNH4Clの熱濃溶液に溶けアンモニアを発生して塩化マンガン(Ⅱ)MnCl2となる。

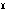 2Mn
2Mn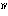 O4にあたる。化学式Mn3O4、式量228.8。塩酸と熱すると塩素を発して塩化マンガン(Ⅱ)となる。
O4にあたる。化学式Mn3O4、式量228.8。塩酸と熱すると塩素を発して塩化マンガン(Ⅱ)となる。