翻訳|barium
精選版 日本国語大辞典 「バリウム」の意味・読み・例文・類語
バリウム
改訂新版 世界大百科事典 「バリウム」の意味・わかりやすい解説
バリウム
barium
周期表の第ⅡA族に属するアルカリ土類金属元素の一つ。単体の形では産出しないが,地殻中にカルシウム鉱物に伴って広く分布し,主要な鉱石は重晶石BaSO4と毒重石BaCO3である。バリウムを含む重晶石が重いことから,ギリシア語のbarys(重い)をとって命名された。1809年,H.デービーが電気分解によってアマルガムとして取り出したが,純粋なバリウムは1901年になって初めてガンツA.A.Guntzの水素化バリウム分解によって得られた。
性質・用途
軟らかい銀白色の金属。モース硬度2。線膨張率1.81~2.10×10⁻5/deg(0~300℃),比抵抗2.5×104Ω・cm(18℃)。体心立方格子の構造で,原子半径2.18Å。キセノンと同構造の原子の芯の外側に2個の6s電子があり,これをたやすく失って半径1.36Å(6配位のとき)のバリウムイオンBa2⁺になる。このイオン化傾向は同族元素のカルシウムやストロンチウムより強いので,バリウムの化学反応性はこれらの元素に似ているが,さらに激しい。空気中で燃えて酸化バリウムになるが,その中にはいくらか過酸化バリウムBaO2も含まれる。前者を500℃に熱すると後者になるが,後者を800℃に熱すると前者にもどる。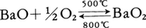
金属バリウムは水と反応して水素を発生し,水酸化バリウムBa(OH)2となる。
Ba+2H2O─→Ba(OH)2+H2
またエチルアルコールとも同様に反応して,バリウムアルコラートBa(C2H5O)2となる。バリウムイオンは無色,有毒である。硫酸バリウムは白色できわめて水に溶けにくいから,Ba2⁺の検出や定量に利用され,白色顔料ともなる。また体内に入っても安全なのでX線の造影剤になる。そのほか炭酸塩,クロム酸塩,シュウ酸塩なども難溶だが,酸には溶ける。ハロゲン化物,硝酸塩などは水に可溶であるが,一般にカルシウム塩のように吸湿・潮解性はない。水酸化物も可溶で強アルカリ性。塩類は緑色の炎色反応を示す。
製法
重晶石を炭素とともに600~800℃に熱して硫化バリウムBaSとする。
BaSO4+2C─→BaS+2CO2
これを塩酸で分解して塩化バリウムBaCl2に変える。
BaS+2HCl─→BaCl2+H2S
この塩化バリウムの水溶液を水銀を陰極として電解すると,バリウムと水銀の合金(バリウムアマルガム)が生ずる。これを真空中で蒸留して水銀を除くと金属バリウムが得られる。あるいは,炭酸バリウムBaCO3を炭素とともに強熱して酸化バリウムBaOとし
BaCO3+C─→BaO+2CO
この酸化バリウムを真空中でアルミニウムまたはケイ素と1200℃に熱して還元してもよい。
3BaO+2Al─→3Ba+Al2O3
2BaO+Si─→2Ba+SiO2
執筆者:曾根 興三
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「バリウム」の意味・わかりやすい解説
バリウム
ばりうむ
barium
周期表第2族に属し、アルカリ土類金属元素の一つ。化学的に活性であるため遊離して存在することはなく、重晶石BaSO4、毒重石BaCO3などとして産出する。またカルシウムに伴って広く地殻中に分布するが、その量ははるかに少ない。
[鳥居泰男]
歴史
今日、重晶石bariteとよばれる硫酸バリウムの鉱石は、17世紀初めイタリアのボローニャで発見されている。比重4.5で、通常塩類の鉱石の2倍ぐらい重いので、「重い」のギリシア語barysにちなんで名づけられた。一方、スウェーデンのK・W・シェーレは1774年に、軟マンガン鉱MnO2の中に酸化バリウム(barytaとよばれた)が含まれることをみいだしている。1808年、イギリスのH・デービーは、酸化水銀と酸化バリウムの湿った混合物を電解してバリウムのアマルガムを得、蒸留によって水銀を除去して金属バリウムを単離することに成功した。水銀をまったく含まない純粋なものは、1901年、ガンツA. A. Guntzによって水素化バリウムの熱分解を通して初めて得られた。元素としての名称バリウムは、バライトbariteあるいはバライタbarytaの成分であることに由来している。
[鳥居泰男]
製法
金属バリウムを電解法で直接的に得ることは困難であるので、主として蒸留冶金(やきん)によって製造される。すなわち、酸化バリウムを真空中約1200℃でアルミニウムやフェロシリコンで還元する。バリウムは蒸気となって出てくるので、これを冷却、凝縮させ、アルゴン気流中で再溶融する。塩化バリウムの水溶液を電解する方法もあるが、この場合でも陰極に水銀を用い、アマルガムの形で取り出す。これを減圧蒸留して大部分の水銀を除去したのち、水素気流中で加熱して水素化バリウムに変え、これを加熱分解して純粋な金属を得る。
[鳥居泰男]
性質
銀白色の軟らかい金属で、体心立方格子の構造をとる。アルカリ土類金属中でもっとも高い沸点をもっている。化学的性質はカルシウム、ストロンチウムとよく類似しているが、それらよりは活性である。空気中で熱すれば燃焼して酸化バリウムと少量の過酸化バリウムを生ずる。窒素に対する親和力はアルカリ土類金属元素中もっとも大きく、空気中の燃焼生成物にもかならず窒化物が含まれる。純粋な窒素気流中で熱すればBa3N2の組成の窒化物が生成する。加熱により水素と直接化合し、かなり安定な水素化物BaH2を与える。水と激しく反応して水酸化バリウムを与え、水素を発生する。また、アルコールとも反応し、バリウムアルコラートを生ずる。
Ba+2H2O→Ba(OH)2+H2
Ba+2C2H5OH→Ba(C2H5O)2+H2
黄緑色の炎色反応を示す。
[鳥居泰男]
用途
アルミニウムまたはマグネシウムの合金として真空管のゲッターに、ニッケルの合金として自動車の点火栓に、またカルシウム‐鉛の合金として車両用の軸受に使用される。なお、バリウムイオンは生体内では有毒であるから取扱いに注意を要する。また、X線造影剤として用いられるバリウム塩は硫酸バリウムである。
[鳥居泰男]
バリウム(データノート)
ばりうむでーたのーと
バリウム
元素記号 Ba
原子番号 56
原子量 137.33
融点 725℃
沸点 1640℃
比重 3.5(測定温度20℃)
結晶系 立方
元素存在度 宇宙 4.7(第41位)
(Si106個当りの原子数)
地殻 425ppm(第13位)
海水 2μg/dm3
化学辞典 第2版 「バリウム」の解説
バリウム
バリウム
barium
Ba.原子番号56の元素.電子配置1s22s22p63s23p63d104s24p64d105s25p66s2の周期表2族元素.原子量137.33.7種の安定同位体(138Ba,137Ba,136Ba,135Ba,134Ba,132Ba,130Ba)と13種の放射性同位体が知られている.1809年H. Davy(デイビー)が電解によりアマルガムとして得たが,1901年A.A. Guntzにより水素化バリウムを分解してはじめて金属が遊離された.1774年K.W. Scheele(シェーレ)は鉱物BaSO4を“Schwerspaterde”とよんだが,密度の高いことからギリシア語の“重い”βαρυ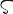 (barys)からbaryte(日本語名:重晶石)と名称がかわり,Davy提案の元素名bariumのもととなった.
(barys)からbaryte(日本語名:重晶石)と名称がかわり,Davy提案の元素名bariumのもととなった.
天然には,重晶石BaSO4,毒重石BaCO3などの形で産出する.地殻中の存在度250 ppm.酸化バリウムをアルミニウムで真空中1200 ℃ で還元すると得られる.銀白色の軟らかい金属.体心立方格子構造.格子定数a = 0.501 nm.密度3.5 g cm-3(20 ℃).融点725 ℃,沸点1640 ℃.炎色反応は緑色.化学的性質はカルシウム,ストロンチウムに似るが作用はよりはげしい.水とはげしく反応して水素と水酸化バリウムを生じる.高温では水素,酸素,窒素と直接化合する.またハロゲン,炭素,ケイ素,ホウ素とも直接化合する.二酸化炭素とは高温で反応し炭素と炭化物を生じる.高温ではガラス,磁器を侵す.酸と反応して水素を発生し,その酸の塩を生じる.バリウムイオンは体内で有毒である.
金属の脱酸剤,特殊合金として真空管のゲッター,車両用の軸受などに用いられる.化合物中ではつねに酸化数2の陽イオンとして存在する.おもな化合物には,水素化物,ハロゲン化物,水酸化物,酸化物,過酸化物,過塩素酸塩,硫酸塩,炭酸塩,硝酸塩などがあり,一般に無色のイオン結晶で,水に難溶のものが少なくない.硫酸塩は水に難溶で Ba2+ の検出や定量分析に利用され,クロム酸塩,シュウ酸塩,炭酸塩も水に難溶.硫酸塩以外は酸に溶ける.可溶性の塩は潮解性も吸湿性もない.[CAS 7440-39-3]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「バリウム」の意味・わかりやすい解説
バリウム
barium
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「バリウム」の意味・わかりやすい解説
バリウム
出典 株式会社平凡社百科事典マイペディアについて 情報
栄養・生化学辞典 「バリウム」の解説
バリウム
世界大百科事典(旧版)内のバリウムの言及
【バーリ】より
…イタリア南部,プーリア州の州都で同名県の県都。古称バリウムBarium。人口33万8949(1994)。…
※「バリウム」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...



