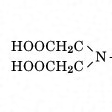日本大百科全書(ニッポニカ) 「キレート滴定」の意味・わかりやすい解説
キレート滴定
きれーとてきてい
chelatometric titration
金属イオンが多座配位子で囲まれて安定な錯化合物を生成するとき、その化合物をキレートというが、多くの金属イオンと安定なキレートを生成するEDTA(エチレンジアミン四酢酸)およびその類縁化合物のアミノポリカルボン酸類を滴定試薬として用いる滴定法をキレート滴定という。古くは単座配位子あるいは多座配位子の錯生成平衡に基づく滴定法を錯滴定compleximetric titrationといっていたが、スイスのシュバルツェンバハGerold Schwarzenbach(1904―1978)により1945年に創始されたキレート試薬の開発と利用法が確立して、現在ではアミノポリカルボン酸類を滴定試薬として用いる滴定法をさすようになった。
EDTAの構造をに示す。
キレート試薬としてEDTAがもっともよく用いられるが、その特徴は次のとおりである。
(1)六座配位子として働き、水溶液中で多くの金属イオンと速やかに安定なキレートを生成する。
(2)金属イオンの電荷に関係なく、ほとんどの金属イオンと1:1錯体を生成する。
(3)EDTAおよび生成したキレートは通常のpH(水素イオン指数)領域では水溶性である。
(4)EDTAの水溶液は無色であり、大部分のキレートも無色である。わずかに着色するキレートとしてCo赤色、Cu青色、Ni青色、Pd黄色が知られている。
(5)高純度の試薬が得られる。現在入手可能なEDTA・2Na塩の純度は99.5%以上である。
現在では高純度のEDTAが入手でき、乾燥後水に溶かして標準液とすることもできるが、通常は容量分析の一次標準である金属銅や金属亜鉛を溶解して調製した標準液を用いて、EDTAの力価を定める。この操作を標定standardizationという。このように調製、標定したEDTA溶液を滴定剤として用いれば金属イオンの絶対量を測定することができる。
[成澤芳男]
キレート滴定法の分類
通常は、EDTAを滴定液とする直接法が用いられるが、金属イオンあるいは指示薬の関係で、逆滴定法、置換滴定法も用いられる。
[成澤芳男]
直接滴定法
もっとも一般的な滴定法であり、滴定液にキレート試薬液を用い、試料液中の金属イオンを滴定する。
[成澤芳男]
逆滴定法
試料液中の金属イオンに対し、過剰量のキレート試薬を加え、その過剰量を適当な金属イオンで滴定する。逆滴定法は、(a)目的とする金属イオンに対する適当な指示薬がない場合、(b)滴定pHにおいて、目的とする金属イオンが水酸化物の沈殿を生じるような場合、(c)キレート生成速度が遅い場合によく用いられる。たとえばアルミニウムイオンの場合には、過剰のEDTAを加え、弱酸性(pH3)とし、沸騰するまで加熱してまずキレートを生成させる。室温まで冷却し、過剰のEDTAを亜鉛標準液で滴定する。
[成澤芳男]
置換滴定法
逆滴定における(a)、(b)のような場合に用いることができる滴定法である。たとえばMg‐EDTAキレートの溶液に、試料の金属イオンMn+が加わると、次の置換反応がおこる。ここでYはEDTAを表す。
MgY2-+Mn+ MYn-4+Mg2+
MYn-4+Mg2+
K'M,Y≫K'Mg,Yのとき、遊離したMg2+を、pH10でBT(エリオクロムブラックT)を指示薬として、EDTAで滴定することにより、間接的にMn+の濃度を求めることができる。ここでK'M,Y、K'Mg,YはM‐EDTAとMg‐EDTAの条件生成定数で、溶液の条件にあうようにキレート生成定数から計算することができる。
[成澤芳男]
キレート滴定における終点決定法
電気的決定法
当量点近傍でおこる金属イオン濃度の急激な変化をイオン選択制電極や金属電極で測定して終点を決定する。金属イオン濃度と比例関係にある拡散電流の変化を測定したり、電気伝導度の変化を測定する方法もある。
[成澤芳男]
指示薬決定法
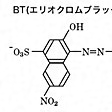
金属キレートと指示薬との色調変化を利用する金属指示薬法、酸化還元電位の変化により変色する酸化還元指示薬法がある。キレート滴定では金属指示薬法が一般的である。代表的な金属指示薬としてBTを示す。BTはナフトール性ヒドロキシ基(-OH)2個とスルホン基(-SO3H)1個をもつ三塩基酸(H3I)である(参照)。
Mg‐EDTAキレートの条件生成定数(K')は、pH10でlogK'=8.2であり、10-2M程度のMg2+イオンの溶液であれば、当量点でも定量的にキレートを生成している。にBT指示薬の存在種、色調およびBTキレートの色調とpHの関係を示した。
pH9.7から12は、滴定が定量的に行われる範囲を計算によって求めたものである。pH10付近で滴定すれば、当量点ではMg2+とEDTAは定量的に反応し、しかも、当量点近傍で次の反応がおこり、MgIの赤色からHI2-の青色への変化がおこるので、この点を終点とすればよい。
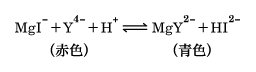
[成澤芳男]
『上野景平著『キレート滴定』(1989・南江堂)』▽『河合聡著『定量分析化学』第3版(1992・丸善)』▽『田中稔他著『分析化学演習』(1993・三共出版)』▽『奥谷忠雄他著『基礎教育 分析化学』(1995・東京教学社)』▽『木村優・中島理一郎著『分析化学の基礎』(1996・裳華房)』▽『井村久則他著『基礎化学コース 分析化学1』(1996・丸善)』▽『宇野文二他著『定量分析化学』第5版(2001・丸善)』
改訂新版 世界大百科事典 「キレート滴定」の意味・わかりやすい解説
キレート滴定 (キレートてきてい)
chelatometry
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
百科事典マイペディア 「キレート滴定」の意味・わかりやすい解説
キレート滴定【キレートてきてい】
→関連項目滴定
出典 株式会社平凡社百科事典マイペディアについて 情報
化学辞典 第2版 「キレート滴定」の解説
キレート滴定
キレートテキテイ
chelatometric titration
キレートメトリー(chelatometry),コンプレクソンメトリーともいう.水溶液中で金属イオンとキレート試薬とのキレート生成反応を利用して行う定量分析法で,終点の決定には金属指示薬,pH変化の測定,電位差法,光度法などがある.G. Schwarzen-bachらにより開発されたEDTA試薬による Ca2+,Mg2+ を滴定する方法は代表的なものである.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
世界大百科事典(旧版)内のキレート滴定の言及
【滴定】より
…一般に滴定法が可能となるためには,当量点においてなんらかの量が急変することが条件となる。上では沈殿滴定の例をみてきたが,酸と塩基の反応を利用する中和滴定ではプロトンの濃度(pH),酸化還元滴定では電子を授受する化学種の濃度(電位に関係),キレート滴定では金属イオンまたはそれと錯体をつくる化合物(配位子)の濃度などが大きく変わる。それに伴う測定物理量から分類すると,電位差滴定,光度滴定,伝導度滴定,温度滴定,電流滴定などがある。…
※「キレート滴定」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...