日本大百科全書(ニッポニカ) 「チオ尿素」の意味・わかりやすい解説
チオ尿素
ちおにょうそ
thiourea
チオ炭酸のジアミド、あるいは尿素の酸素を硫黄(いおう)で置換した(チオは硫黄を示す接頭語で、チオ尿素の名はこのことに由来する)とみなすことができる化合物。チオカルバミドともいう。シアナミドH2NCNと硫化水素H2Sを反応させるか、あるいはチオシアン酸アンモニウムNH4SCNを170~180℃に加熱して異性化させて合成される。無色の結晶。水、エタノール(エチルアルコール)にはよく溶けるが、エーテルにはほとんど溶けない。水溶液は中性である。金属塩と錯体をつくる。酸またはアルカリで加水分解すると、アンモニア、硫化水素および二酸化炭素に分解する。ホルムアルデヒドと縮合してチオ尿素樹脂(ユリア樹脂)をつくる。染料や医薬の原料として用いられるほか、分析化学では金属の比色定量および沈殿分離用の試薬として利用される。強誘電体である。
[務台 潔]
改訂新版 世界大百科事典 「チオ尿素」の意味・わかりやすい解説
チオ尿素 (チオにょうそ)
thiourea
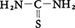
尿素の酸素原子を硫黄原子で置換した構造の化合物。チオカルバミドthiocarbamideともいう。ウェーラーF.Wöhlerの尿素合成と同じように,チオシアン酸アンモニウムの転位反応を利用して1869年に合成された。
NH4SCN⇄H2NCSNH2
しかし,この反応は可逆反応で,チオ尿素の平衡組成が低いため合成の目的には向かない。アンモニアの存在でシアナミドに硫化水素を作用させることにより効率よく合成できる。
H2NCN+H2S─→H2NCSNH2
融点180℃の無色の結晶。水,エチルアルコールに可溶。エーテルにはほとんど溶けない。溶液を160~170℃に加熱すると,速やかに転位してチオシアン酸アンモニウムになる。過マンガン酸塩で酸化すると尿素になる。各種の金属と付加化合物をつくる性質を利用して,ビスマス,テルルの比色分析,タリウム,鉛の分離,セレンの検出など分析試薬として用いられる。また,染料や医薬品の製造原料としても使われる。
執筆者:小林 啓二
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「チオ尿素」の解説
チオ尿素
チオニョウソ
thiourea
CH4N2S(76.12).S=C(NH2)2.チオカルバミドともいう.シアナミドと硫化水素との反応,またはチオシアン酸アンモニウムを加熱することにより得られる.無色の針状または斜方状結晶.融点180 ℃.密度1.406 g cm-3.減圧下150~160 ℃ で昇華する.水,エタノールに可溶,エーテルに不溶.金属塩および酸と付加物をつくる.ホルムアルデヒドとチオ尿素樹脂をつくり,また染料,医薬品の合成中間体としても用いられる.分析用には,Bi,Th,Te,Pd,As,Pb,Cd,Se,Ag,HgⅠ,CuⅠなどの塩の定性,および定量に用いられる.金属の防錆剤,加硫促進剤にも用いられる.LD50 1 mg/kg(マウス,経口).[CAS 62-56-6]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「チオ尿素」の意味・わかりやすい解説
チオ尿素
チオにょうそ
thiourea
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「チオ尿素」の意味・わかりやすい解説
チオ尿素【チオにょうそ】
出典 株式会社平凡社百科事典マイペディアについて 情報
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

