精選版 日本国語大辞典 「硫酸鉄」の意味・読み・例文・類語
りゅうさん‐てつリウサン‥【硫酸鉄】
- 〘 名詞 〙 鉄の硫酸塩。硫酸第一鉄と硫酸第二鉄とがある。〔舎密開宗(1837‐47)〕
改訂新版 世界大百科事典 「硫酸鉄」の意味・わかりやすい解説
硫酸鉄 (りゅうさんてつ)
iron sulfate
酸化鉄の硫酸塩で,鉄の酸化数ⅡおよびⅢと,両方の酸化数の鉄を含む化合物が知られている。
硫酸鉄(Ⅱ)
化学式FeSO4。無水和物および1,4,5,7水和物が得られている。7水和物は鉄(Ⅱ)塩中最も重要な化合物で,緑礬(りよくばん)/(ろうは)と呼ばれ,すでに13世紀にマグヌスA.Magnusによって記載されている。無水和物は水和物を水素気流中で300℃に加熱すると得られる。淡緑色結晶。斜方晶系。比重3.346(20℃)。強熱するとSO2を発生して酸化硫酸鉄(Ⅱ)になる。湿った空気中では7水和物になる。水に対する溶解度26.6g/100g(20℃)。鉄を希硫酸に溶かした溶液から64℃以上で1水和物,56℃以上で4水和物,56℃以下で7水和物が得られ,硫酸鉄(Ⅱ)溶液を過剰の硫酸とともに真空中で蒸発すると5水和物が得られる。7水和物は青みをおびた淡緑色の結晶。ふつう単斜晶系。斜方晶系の変態もある。比重1.895(25℃)。空気中に放置すると表面に黄褐色の鉄(Ⅲ)の塩基性塩を生ずる。水に対する溶解度32.8g/100g(0℃)。水溶液はゆっくり酸化される。NOを吸収して不安定な化合物FeSO4・NOをつくり褐色を呈するので,NO3⁻およびNO2⁻の検出に使われる(褐輪反応)。若干の1価金属MⅠの硫酸塩とMⅠ2SO4・FeSO4・6H2Oのようなタットン塩をつくり,とくに(NH4)2SO4との複塩はモール塩として著名である。べんがら,黒色インキ,顔料の製造,還元剤,青写真感光剤,媒染剤,試薬,医薬等に用いられる。
硫酸鉄(Ⅲ)鉄(Ⅱ)
化学式FeSO4・Fe2(SO4)3。水和物は天然にレーメライト石römeriteおよびビリナイトbiliniteとして産する。硫酸鉄(Ⅱ)と酸性硫酸鉄(Ⅲ)の混合物を空気にさらすと14水和物が得られる。赤褐色粉末。水に容易に溶け,硫酸鉄(Ⅱ)を析出して分解する。
硫酸鉄(Ⅲ)
化学式Fe2(SO4)3。無水和物および多数の水和物が得られている。水和物には天然に鉱物として産するものが多い。無水和物は水和物を注意して加熱,脱水すると得られる。白色ないし黄白色の粉末。潮解性。斜方晶系と菱面体晶系の2変態がある。比重3.097(18℃)。加熱すると約480℃でSO3を発生しFe2O3になる。硫酸鉄(Ⅱ)溶液を硝酸などで酸化すると硫酸鉄(Ⅲ)水溶液となり,これから室温で9水和物,高温で7水和物,6水和物等が得られる。9水和物は黄色ないし白色粉末。六方晶系。比重2.116(16.2℃)。98℃で5分子,125℃で8分子の水を失い,175℃で無水和物になる。水およびエチルアルコールに可溶。水溶液を熱すると加水分解して塩基性塩ないし水酸化鉄(Ⅲ)を生じ赤褐色の沈殿をつくる。水溶液はMⅠ2SO4(MⅠ=K,NH4,Rb,Cs,TlIなど)と鉄ミョウバンMⅠFe(SO4)2・12H2Oをつくる。媒染剤,顔料,医薬品等に用いられる。
執筆者:近藤 幸夫
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「硫酸鉄」の意味・わかりやすい解説
硫酸鉄
りゅうさんてつ
iron sulfate
鉄の硫酸塩。次の3種類のものが知られている。
(1)硫酸鉄(Ⅱ) 無水和物FeSO4、式量151.92(硫酸第一鉄ともいう)のほか一、四、五、七水和物がある。このうち一、五、七水和物は天然にも存在する。七水和物は緑礬(りょくばん)melanteriteともよばれ、もっとも重要なものである。鉄を希硫酸に溶解するか、水で湿らせた黄鉄鉱FeS2を空気酸化することによって得られる水溶液を、56℃以下で結晶化すると七水和物が得られる。56℃以上では四水和物が、64℃以上では一水和物が晶出する。この水溶液を過剰の硫酸とともに真空中で蒸発濃縮すれば五水和物が得られる。無水和物は淡緑色の結晶で、湿った空気中に放置すると七水和物となる。無水和物は20℃の水100グラムに26.6グラム溶ける。七水和物は緑色の結晶で、空気中に放置すると酸化されて赤褐色の塩基性硫酸鉄(Ⅲ)に変わる。水溶液は緑色で、きわめてゆっくりと酸化されるが、アルカリ性溶液、エタノール(エチルアルコール)溶液中では加速される。一酸化窒素と不安定な褐色の化合物をつくるので硝酸イオンや亜硝酸イオンの検出に利用される。べんがら、黒色インキ、顔料(プルシアンブルー、鉄黒(てつぐろ))の製造、還元剤、媒染剤、防腐剤などに用いられる。
(2)硫酸鉄(Ⅲ) 無水和物Fe2(SO4)3、式量399.9(硫酸第二鉄ともいう)のほか三、六、七、7.5、九、十、12水和物がある。このうちあとの5種は天然にも存在する。硫酸鉄(Ⅱ)の水溶液を酸化し、蒸発濃縮すると、水和物の結晶が得られるが、結晶化の条件によって結晶水の数が異なってくる。水和物を注意して加熱、脱水すると無水和物が得られる。無水和物は白色ないし淡黄色の粉末。潮解性。加熱により約480℃で分解し酸化鉄となる。水にわずかに溶けるが、加水分解の結果溶液は褐色を呈し、温めるとただちに塩基性硫酸鉄(Ⅲ)または酸化水酸化鉄(Ⅲ)の赤褐色沈殿を生ずる。鉄ミョウバンおよびプルシアンブルーの製造に用いられるほか、媒染剤、医薬としての用途もある。
(3)硫酸鉄(Ⅲ)鉄(Ⅱ) 化学式Fe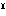 Fe
Fe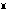 2(SO4)4、式量551.81(硫酸第二鉄第一鉄ともいう)。天然に各種の水和物として存在する。硫酸鉄(Ⅱ)と酸性硫酸鉄(Ⅲ)の混合物を空気にさらすと得られる。赤褐色の粉末。
2(SO4)4、式量551.81(硫酸第二鉄第一鉄ともいう)。天然に各種の水和物として存在する。硫酸鉄(Ⅱ)と酸性硫酸鉄(Ⅲ)の混合物を空気にさらすと得られる。赤褐色の粉末。
[鳥居泰男]
硫酸鉄(データノート)
りゅうさんてつでーたのーと
硫酸鉄
硫酸鉄(Ⅱ)七水和物
FeSO4・7H2O
式量 278.0
融点 64℃
沸点 ―
比重 1.895(測定温度25℃)
結晶系 単斜
溶解度 32.8g/100g(水0℃)
化学辞典 第2版 「硫酸鉄」の解説
硫酸鉄
リュウサンテツ
iron sulfate
【Ⅰ】硫酸鉄(Ⅱ):FeSO4(151.91).無水物は淡緑色の結晶.密度3.35 g cm-3.湿った空気中で七水和物になる.水に易溶.七水和物は天然には緑バン(ロウハ)として産出し,鉄(Ⅱ)塩類中でもっとも重要な化合物である.鉄を希硫酸に溶かすと56 ℃ 以下で得られる.青緑色の結晶.[Fe(H2O)6]2+ を含む無臭のイオン結晶.密度1.898 g cm-3.吸湿性で,大気中で徐々に風化して水和水の一部を失い,また酸化されて黄褐色の水酸化硫酸鉄(Ⅲ)を生じる.水に易溶.水溶液はNOを吸収して濃褐色の付加物を生成する(褐輪反応).べんがら,インキ,顔料,磁性材料,消毒剤,浄水剤,媒染剤,青写真,医薬品,分析試薬などに用いられる.[CAS 7720-78-7:FeSO4][CAS 17375-41-6:FeSO4・H2O][CAS 7782-63-0:FeSO4・7H2O]【Ⅱ】硫酸鉄(Ⅲ)鉄(Ⅱ):FeSO4・Fe2(SO4)3(551.80).各種の水和物がある.一般に赤褐色の粉末.水に溶けて分解し,硫酸鉄(Ⅱ)を析出する.【Ⅲ】硫酸鉄(Ⅲ):Fe2(SO4)3(399.89).無水物は白~黄白色の潮解性粉末.無水硫酸鉄(Ⅱ)を濃硫酸中で煮沸すると得られる.密度3.10 g cm-3.光をさえぎって保存する.冷水に微溶,加水分解して褐色を示し,煮沸すると各種の塩基性塩が沈殿する.水和物は水に易溶で,加熱すると加水分解する.媒染剤,顔料,鉄ミョウバンの製造,土壌調整剤,凝集剤,消毒剤,医薬品に用いられる.[CAS 10028-22-5:Fe2(SO4)3][CAS 13520-56-4:Fe2(SO4)3・9H2O][CAS 15244-10-7:Fe2(SO4)3・nH2O]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「硫酸鉄」の意味・わかりやすい解説
硫酸鉄
りゅうさんてつ
iron sulfate
(2) 硫酸鉄 (III) ,硫酸第二鉄 Fe2(SO4)3 。硫酸第一鉄水溶液を硝酸または過酸化水素で酸化すると,室温で9水塩,高温で6,7水塩が析出する。無水塩は無色ないし黄白色の粉末。加熱すると約 480℃で酸化鉄になる。媒染剤,鉄ミョウバンの製造に用いられる。
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「硫酸鉄」の意味・わかりやすい解説
硫酸鉄【りゅうさんてつ】
出典 株式会社平凡社百科事典マイペディアについて 情報
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

