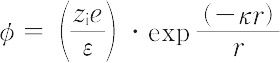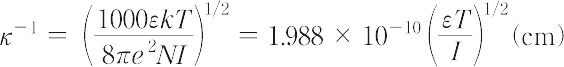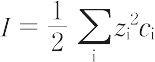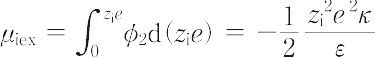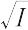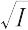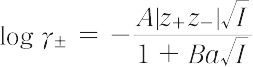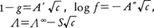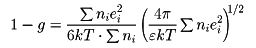デバイ-ヒュッケルの理論
デバイヒュッケルノリロン
Debye-Hückel's theory
強電解質溶液の熱力学的諸性質を説明するため,1923年P.J.W. Debye(デバイ)とE. Hückel(ヒュッケル)により立てられた理論.強電解質は溶液中で完全に電離しており,電離により生じたイオンは連続体とみなされる溶媒中に浮いている点電荷で,互いに静電的相互作用をしながら熱運動をしていると仮定される.溶液中のあるイオンiのまわりには,クーロン力によって反対符号の電荷をもつイオンが引き寄せられ,同符号の電荷をもつイオンは遠ざけられる.一方,これらのイオンは熱運動により均一になろうとする傾向をもち,平衡状態では,これら二つの効果が釣り合っている.このようにして,zie(zi はイオン価,eは電気素量)の電荷をもつ中心イオンiのまわりに- zieの電荷が球対称的に分布することになる.これをイオン雰囲気とよぶ.イオン雰囲気中の電位の分布は,イオン分布に対してボルツマン分布則を仮定し,電位と電荷密度との間に成立するポアソンの方程式を解いて求める.中心イオンからrの距離にある点の電位φは,次のように表される.
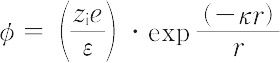
ただし,
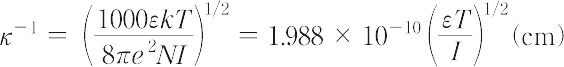
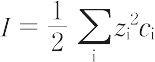
ここで,Nはアボガドロ数,kはボルツマン定数,Tは絶対温度,εは溶媒の比誘電率,ci はiイオンの容量モル濃度,Iは溶液のイオン強度である.また,κ-1 はデバイ長さ(半径)とよばれる.希薄電解質溶液におけるイオンの電気化学ポテンシャルは理想溶液におけるそれとはイオン間の静電的相互作用による過剰エネルギー μiex だけ異なる.
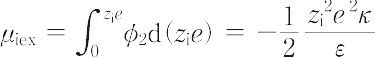
この過剰エネルギーとイオンの活量係数γi との間の関係
μiex = RT lnγi
から
log γi = - Azi2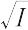
A = 1.8246 × 106 (εT)-3/2 (mol-1/2 L1/2)
が得られる.したがって,z+-z-型電解質の平均イオン活量係数 γ± は,次のように表される.
log γ± = -A|z+z-|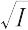
この関係式は,活量係数に対するデバイ-ヒュッケルの極限法則とよばれている.この極限則は,きわめて希薄な溶液でしか成立しない.たとえば,1-1型電解質の水溶液の場合には,I = 0.001で約3% の誤差を生じることが指摘されている.さらに高濃度まで成立する式は,イオンの大きさを考慮に入れて,次のように求められた.
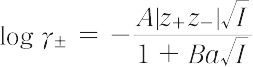
ただし,
B = 50.29 × 108 (εT)1/2 (cm-1 mol-1/2 L1/2)
ここで,a(cm)はイオンの最近接距離で,実際には半経験的に決定される量である.上式の成立範囲は,1-1または2-1型電解質の水溶液ではI = 0.1までといわれている.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
Sponserd by 
デバイ=ヒュッケルの理論 (デバイヒュッケルのりろん)
Debye-Hückel's theory
1923年にドイツのP.J.W.デバイとヒュッケルErich Armand Arthur Joseph Hückel(1896-1980)が提出した理論で,強電解質溶液論の基礎として重要なものである。電解質溶液の蒸気圧,浸透圧,電気伝導率などの性質を説明するために提出されたアレニウスの電離説では,すべての電解質が溶液中では電離平衡の状態にあると考えた。この理論は,弱電解質では成功したが,強電解質の性質を説明することはできなかった。事実,塩化カリウムのような結晶はイオン格子構造のものであるから,それを水のような溶媒に溶かせば100%イオンに解離すると考えるほうが自然である。そこで,デバイらは,溶液中で強電解質は完全に電離していると仮定し,イオン相互の間に静電的なクーロン力が働くことを考慮して,それがイオンの熱力学的な性質や移動速度などにどのような影響を及ぼすかを定量的に検討した。この理論に従って個々のイオンのまわりの他のイオンの分布を計算すると,個々のイオンは,全体としてそれと反対の電荷をもつイオンの集団,いわゆるイオン雰囲気ionic atmosphereでとり囲まれているような挙動をすることがわかる。
この理論によると,たとえば,溶液中における強電解質の浸透係数g,活動度係数f,モル導電率Λがそれぞれ次式で与えられる。
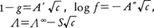
ここで,cは電解質のモル濃度,Λ∞は無限希釈におけるモル導電率,A′,A″およびSは,溶液の温度,誘電率,粘性率,電解質の電荷型などで決まる理論係数である。これらの理論式は,従来知られていた実験式とよく一致するが,理論に含まれている仮定や近似のために,ごく希薄な溶液にしか適用できない。
執筆者:玉虫 伶太
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
Sponserd by 
デバイ‐ヒュッケルの理論
でばいひゅっけるのりろん
Debye-Hückel's theory
強電解質溶液の解離(電離)現象に関する理論。1923年にオランダのデバイとドイツのヒュッケルにより共同発表された。
スウェーデンのアレニウスが1887年に提出した電離説によれば、電解質は溶液の中でイオンに解離するが、これらは中性分子と電離平衡にあるとされた。電離度αは溶液の電気伝導度の測定から求められたが、さらにイオン解離の大きさを考慮して電離定数Kを導き、種々の溶液について測定値と比較したところ、弱酸・弱塩基についてはよい一致を示すが、強電解質では一致が悪いことがわかった。
デバイとヒュッケルは、強電解質では中性分子は完全にイオンに電離していると考え、溶媒を誘電体とし、イオン間にはクーロン力が働くとして理論式をたてた。溶液の浸透圧Pと理想溶液のそれP0との比をgと置き、これを浸透圧係数g=P/P0とすれば、
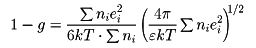
ここで、niは1cc中のイオンの数、eiはイオンの電荷、Tは絶対温度、kはボルツマン定数、εは溶媒の誘電率である。この理論を基として、溶液の性質に関する理論が発展した。コールラウシュの法則(電気伝導率の理論)、濃度と当量伝導度の関係を示したオンサーガーの式などがその例である。
[下沢 隆]
出典 小学館 日本大百科全書(ニッポニカ)日本大百科全書(ニッポニカ)について 情報 | 凡例
Sponserd by 
デバイ=ヒュッケルの理論
デバイ=ヒュッケルのりろん
Debye-Hückel theory
強電解質溶液に関する理論で P.デバイと E.ヒュッケルによって導かれた (1923) 。強電解質溶液は完全に電離していると仮定し,この仮定と実際に測定される溶液の特性とのずれの原因はイオン間の相互作用によるものとした。すなわち1個のイオンはそのまわりに平均して球対称状に分布した他のイオン (イオン雰囲気) のポテンシャルの場にあるとして静電気的理論から,イオンの活量,溶液の電気伝導度を導いた。これは希薄溶液によく適用される。この理論は電解質溶液の反応速度を考察するうえで重要である。 (→オンサーガー方程式 )
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
Sponserd by