日本大百科全書(ニッポニカ) 「アルカリ土類金属」の意味・わかりやすい解説
アルカリ土類金属
あるかりどるいきんぞく
alkaline earth metals
周期表第2族のうちカルシウム、ストロンチウム、バリウム、ラジウムの4元素の総称。これにベリリウム、マグネシウムを加えた6元素をいうこともある。ラジウムは放射性元素である。
古くはアルカリ(アルカリ金属の水酸化物など)となる金属と「土(ど)earth」類(アルミニウムの酸化物など、水に溶けず火にも強いもの)金属との中間的な性質を示すことから、このようによんでいた。ベリリウムおよびラジウムを除いては比較的多量に存在する。マグネシウム、カルシウムは、地殻を構成する8元素(元素の存在度1%以上)に入り、また、生物体中にも存在し、広く分布する。単体はすべて銀白色または灰白色の金属で、空気中ではしだいにさびて光沢を失う。融点、沸点ともアルカリ金属よりも高く、密度も大きい。ラジウムを除いてすべて軽金属に属する。アルカリ金属に次いで陽性が著しく、つねに2価陽イオンとしての化合物をつくりやすい。またイオン化傾向は大きく、化学的性質は活発である。金属は一般に水素、窒素、酸素、塩素などとは直接化合する。水とはベリリウム、マグネシウムは徐々に、カルシウム以下は原子番号が大きいほど激しく反応して水素を発生し、水酸化物となる。水酸化物は一般に強塩基で、アルカリ金属に次ぐが、水酸化ベリリウムのみは両性である。ベリリウムおよびマグネシウムの水酸化物は難溶性であるがカルシウム以下はしだいに溶解度が大きくなる。化合物の性質はそれぞれよく似ているが、ベリリウムは例外で、むしろアルミニウムによく似ている。多くの酸と塩をつくるが一般に無色。塩化物、臭化物、ヨウ化物、硝酸塩などは水に溶ける。フッ化物、リン酸塩、炭酸塩などは難溶性である。水酸化物、炭酸塩、硝酸塩は熱すると酸化物になる。一般に安定な錯化合物はつくりにくいが、エチレンジアミン四酢酸などとは安定なキレート化合物をつくるため、それらはマグネシウム、カルシウムなどの定量に用いられる。炎色反応はカルシウムは橙(だいだい)色、ストロンチウムは深紅色、バリウムは黄緑色、ベリリウムとマグネシウムは無色である。
[中原勝儼]
『高本進・稲本直樹・中原勝儼・山崎昶編『化合物の辞典』(1997/普及版・2010・朝倉書店)』▽『J・A・コーワン著、小林宏・鈴木春男監訳『無機生化学』(1998・化学同人)』▽『F・A・コットン、G・ウィルキンソン、P・L・ガウス著、中原勝儼訳『基礎無機化学』(1998・培風館)』▽『内田希・小松高行・幸塚広光・斎藤秀俊・伊熊泰郎・紅野安彦著『無機化学』(2000・朝倉書店)』
改訂新版 世界大百科事典 「アルカリ土類金属」の意味・わかりやすい解説
アルカリ土類金属 (アルカリどるいきんぞく)
alkali(ne) earth metals
周期表第Ⅱ族(第ⅡA族)に属するベリリウムBe,マグネシウムMg,カルシウムCa,ストロンチウムSr,バリウムBa,ラジウムRaの6種の金属元素の総称。ベリリウムと放射性のラジウム以外の元素は地球上に広く存在し,とくにマグネシウムとカルシウムは水圏,岩石圏,生物圏中に大量に分布し,多数の重要な造岩鉱物の主要成分である。単体は融解ハロゲン化物の電解で得られ,銀白色で比較的軟らかく延性があり,電気を導く。空気中ではしだいに酸化して光沢を失う。融点,沸点はアルカリ金属より高く,比重も大きいが,比重はラジウムで5~6,バリウムでは3.5の軽金属である。アルカリ金属に次いでイオン化傾向が大きいため化学的に活発で,つねに希ガス原子と同じ構造の2価の無色の陽イオンとして化合物をつくる。ベリリウムとマグネシウムの化合物は他の4元素のものとは性質がやや異なり,とくにベリリウムには単体としても化合物としてもアルミニウムに似た性質がしばしば現れる。たとえば水酸化物の塩基性はバリウムではきわめて強いが,ストロンチウムやカルシウムではやや弱くなり,マグネシウムの水酸化物は弱塩基性,ベリリウムでは両性になる。また炭酸塩,硫酸塩,リン酸塩,シュウ酸塩,クロム酸塩,フッ化物などは一般に水に難溶ないし不溶であるが,マグネシウムの硫酸塩,クロム酸塩は可溶性であり,ベリリウムではフッ化物やシュウ酸塩も可溶性になる。一般に錯体をつくりにくいが,エチレンジアミン四酢酸(EDTA)のようなキレート試薬とは安定な錯体をつくる。カルシウム~バリウムの塩類はそれぞれ特有の炎色反応(Ca赤黄,Sr深紅,Ba黄緑)を示す。マグネシウムは軽合金,写真用フラッシュ,テルミットなどに利用され,また陶磁器,セメント,ガラスなど鉱物質を原料とする工業製品はほとんどアルカリ土類金属の化合物とみてよい。ラジウムはその放射能を利用して医療用に用いられる。
執筆者:曽根 興三
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「アルカリ土類金属」の解説
アルカリ土類金属
アルカリドルイキンゾク
alkaline earth metals
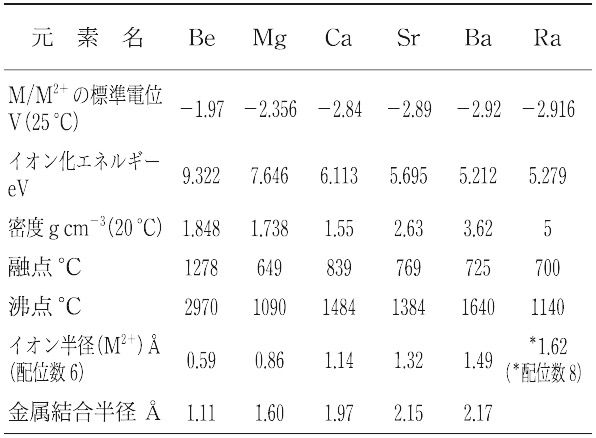
周期表2族元素のうち,性質が類似したCa,Sr,Ba,Raの4元素の総称.さらに,これらにBe,Mgを加えた6元素全部(ベリリウム族)をさすこともあるが,Be,Mgはほかの4元素とやや性質が異なり,化学的に安定である.これら4元素の金属は,塩化物や水酸化物の融解塩電解によって得られる.遊離金属はいずれもアルカリ金属と同じく反応性に富み,空気中で酸化され,水とはげしく反応して水素を発生して水酸化物となる.ただし,反応性は隣接する各アルカリ金属よりはやや小さい.金属の密度や硬度もより大きく,融点,沸点も高い.EDTA,クラウンエーテル,クリプタンドとは安定な錯体を形成する.水酸化物は強塩基,塩はイオン結晶で,塩では二価の陽イオンとして存在するが,これは原子が最外電子殻に2個のs電子をもち,これらを離しやすいためである.塩のうち,ハロゲン化物は水に溶けやすいが,硫酸塩,炭酸塩は溶けにくい.各元素の性質を比較して表に示す.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「アルカリ土類金属」の意味・わかりやすい解説
アルカリ土類金属
アルカリどるいきんぞく
alkaline earth metal
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「アルカリ土類金属」の意味・わかりやすい解説
アルカリ土類金属【アルカリどるいきんぞく】
出典 株式会社平凡社百科事典マイペディアについて 情報
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...