翻訳|ozone
精選版 日本国語大辞典 「オゾン」の意味・読み・例文・類語
オゾン
改訂新版 世界大百科事典 「オゾン」の意味・わかりやすい解説
オゾン
ozone
酸素の同素体で,化学式O3。ニンニク様の臭気をもつ気体。この特有のにおいからギリシア語のozein(におう)にちなんで,1839年にドイツのC.F.シェーンバインによって命名された。オゾンは,化学反応,光化学反応,電解反応などでも生成するが,放電反応(無声放電)によってつくられることが最も多い。この場合のオゾン濃度は比較的低く1~10%である。大気中では,酸素に紫外線があたると光化学反応を起こして生成する。濃度が比較的高いところは,地上約20~25kmの高度に,厚さ約20kmにわたって分布し,オゾン層と呼ばれている。紫外線に富む高山,森林,海岸などの空気中にも存在するが,塵埃(じんあい)などで分解されやすく,地表付近の濃度はきわめて低い。
気体は微青色で反磁性,液体は黒青色,固体は暗紫色。融点-193℃,沸点-112℃,気体の密度2.144g/l(0℃),液体の比重1.149(-183℃),臨界圧92.3気圧,臨界温度-5℃。気体は水に難溶で,溶解度は49ml/100gH2O(0℃)。液体窒素,四塩化炭素,クロロホルムに可溶。図のような二等辺三角形構造をもつ。常温で自然分解して酸素分子O2となる。強力な酸化剤で,酸素が反応しないような条件でも多くの物質と反応して酸化物をつくる。ゴム,コルクなどは直ちに侵される。ヨウ化カリウム溶液KIと反応してヨウ素I2を遊離する。
O3+2KI+H2O─→I2+O2+2KOH
この反応はオゾンの定量に用いられる。エチレン結合をもつ不飽和有機化合物に作用させると,二重結合の部分にオゾン1分子が付加する。生成物をオゾニド(オゾン化物)という。これを還元剤の存在下で加水分解するとアルデヒドやケトンを生ずる。生じた物質を判定し,もとのアルケンの構造を決定することが行われている。
オゾンはこれらの天然物の構造研究や,上水道の殺菌,廃水処理,香料の合成,脱臭などに用いられる。その強い酸化力によって生体にも種々の作用をし,猛毒である。敏感な人は0.02ppmで特異なにおいを感じ,0.2~0.3ppmで粘膜が刺激され,視力障害を起こし,0.6ppm以上では呼吸器に刺激症状があらわれる。大気中に排出された窒素酸化物は紫外線により分解し,オゾンが発生する。
NO2+hν(紫外線)─→NO+O
O+O2─→O3(速い反応)
大気中に炭化水素が存在するとこの反応は進みやすくなることが知られている。光化学オキシダントの大部分はオゾンであり,そのほか有機過酸化物等の発生も加わって大気汚染の原因となっている。
執筆者:漆山 秋雄
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「オゾン」の意味・わかりやすい解説
オゾン
おぞん
ozone
酸素の同素体。特有なにおいをもつことから、ギリシア語のozein(におう)にちなんで命名された。大気中には、雷雨の発生や光化学反応の結果生じたオゾンが0.02ppm程度含まれている。紫外線に富む高山、海岸、森林などの空気中に存在し、さわやかな感じのもととなっている。ただし、多量に存在するときは、かえって不快感を感じさせる。なお、成層圏には地表の250倍もオゾンを含むオゾン層が存在し、これが太陽光のうち高エネルギーの部分を吸収し、地表への到達を妨げるため生物の生存にたいせつな役割を果たしている。
乾いた酸素や空気中で高圧放電に際して生じるほか、黄リンが空気中でゆっくり酸化するとき、水をフッ素で分解するとき、紫外線やX線、陰極線などが空気中を通過するとき、また硫酸の電解などに際しても生じる。多量につくるには、放電を利用したオゾン発生器などを用いる。
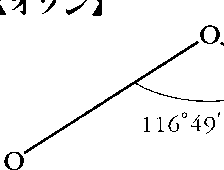
気体では独特のにおいをもつ淡青色、液体では青色、固体では暗紫色である。気体の分子構造は二等辺三角形で、二つの構造の共鳴として表される。
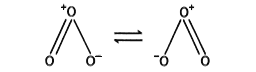
水には酸素よりもよく溶け、常温では徐々に分解して酸素となるが、二酸化マンガンや白金粉末は分解を促進する。酸化力が強く、銀、水銀も常温で酸化され、過酸化銀Ag2O2および酸化水銀Hg2Oとなる。また、ヨウ化カリウム水溶液からヨウ素を遊離する。これらの反応は、オゾンの検出や定量に使われる。有機色素は脱色され、ゴム、コルクなどは侵される。細菌、ウイルスの除去のため、空気の浄化、上水道の殺菌、廃水処理に用いるほか、香料の合成、脱臭、有機物の構造決定などに用いる。吸入により呼吸器が冒されるので注意が必要である。毒性が強く、微量でも長時間吸入すると中毒するので、きわめて危険である。
[守永健一・中原勝儼]
オゾン(データノート)
おぞんでーたのーと
オゾン
分子式 O3
式量 48.00
融点 -193℃
沸点 -112℃
密度 2.144g/L(0℃,1気圧)
(比重) 液体 1.57(測定温度 -183℃)
溶解度 49.4mL/100mL(0℃,1気圧)
化学辞典 第2版 「オゾン」の解説
オゾン
オゾン
ozone
O3(47.9982).酸素の同素体で,常温で特異臭をもつ無色の気体.液体は暗青色,固体は黒青色.空気または酸素の紫外線・放射線照射,放電により生成するので,大気中に存在することもある.融点-192.7 ℃,沸点-111.9 ℃,臨界温度-12.10 ℃.第一イオン化エネルギー1209 kJ mol-1(12.53 eV).水に対する溶解度は低く,100 mL に対する溶解度は49 mL(0 ℃).液体窒素には可溶であるが,液体酸素とはほとんどまじらない.分子は二等辺三角形型で頂角116.79°.等しい二辺の原子間距離O-O 0.127 nm.常温で徐々に分解して酸素となる.二酸化マンガン,白金粉末などは分解を速める.酸化力が強く常温で銀,水銀を酸化して過酸化銀,酸化水銀とする.ヨウ化カリウム溶液に通じるとヨウ素を遊離する.この反応で生成するヨウ素濃度を吸光光度法で決定して,オゾン定量に用いる(ヨウ化カリウム法,JIS B 7957).酸化力が強いため,漂白,飲料水・下水などの処理,化学合成上などで用いられる.空気中に1~2 ppm 含まれていても2時間呼吸すると,頭痛や胸痛をもたらす.眼は刺激しない.動物実験により50~60 ppm で短時間でも人体に危険とされている.労働安全衛生法・同施行令により,「労働者に健康障害を生ずるおそれのある物」で,譲渡し,または提供する相手方に「名称等を通知すべき危険物及び有害物」に指定されている.大気中の微量オゾンの定量には,エテンとの反応による化学発光法と紫外線吸収法(254 nm)が用いられる.大気中に含まれるオゾン全量の推定は,地表に到達する太陽からの紫外光を分光光度計により分光して,オゾンによる吸収強度の波長依存性をオゾンの吸収波長強度比と比較して行う.[CAS 10028-15-6][別用語参照]光化学オキシダント,光化学スモッグ
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「オゾン」の意味・わかりやすい解説
オゾン
→関連項目オキシダント|オキシドール|オゾン層破壊|光化学スモッグ|酸素|シェーンバイン
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「オゾン」の意味・わかりやすい解説
オゾン
ozone
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
最新 地学事典 「オゾン」の解説
オゾン
ozone
酸素の同素体,O3。融点-193℃,沸点-112℃,気体は微青色で刺激臭がある。酸化力を利用して殺菌剤等に利用される。地表近くのO3は,放電(雷)や硫黄酸化物等の大気汚染物質に太陽光が作用して発生するほかに,紫外光の作用でO2から生成する。このために比較的紫外線の強い海辺では濃度が高い。成層圏では,紫外光の作用による生成と分解の収支から,対流圏に比べO3濃度の高い層(オゾン層)が形成されている。オゾン層は,有害紫外線のフィルターとして生物を保護しているが,フロン等による破壊が進行している。
執筆者:立川 涼
出典 平凡社「最新 地学事典」最新 地学事典について 情報
栄養・生化学辞典 「オゾン」の解説
オゾン
世界大百科事典(旧版)内のオゾンの言及
【光化学スモッグ】より
…光化学スモッグとは,光化学オキシダントが大気中で生成し,逆転層の形成や風が弱く太陽光線が適度に強く気温が高いなどの気象条件によって,地表での光化学オキシダント濃度が高くなる現象をいう。光化学オキシダントoxidantは酸素よりも酸化力が強く中性ヨードカリ溶液中のヨードカリを酸化してヨードを遊離させる大気中物質を総称する呼名で,その大部分はオゾンO3であり,パーオキシアセチルナイトレートperoxyacetilnitrate(PAN),パーオキシベンゾイルナイトレートperoxybenzoylnitrate(PBzN)などの過酸化物も微量含まれている。オゾンは,一酸化窒素NOや二酸化窒素NO2(双方合わせてNOxと表す)が炭化水素と複雑な光化学反応を行って,放出される。…
※「オゾン」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...