精選版 日本国語大辞典 「チオ硫酸ナトリウム」の意味・読み・例文・類語
チオりゅうさん‐ナトリウムチオリウサン‥【チオ硫酸ナトリウム】
改訂新版 世界大百科事典 「チオ硫酸ナトリウム」の意味・わかりやすい解説
チオ硫酸ナトリウム (チオりゅうさんナトリウム)
sodium thiosulfate
化学式Na2S2O3。市販品Na2S2O3・5H2Oは俗に誤って次亜硫酸ソーダsodium hyposulfite,略してハイポhypoと呼ばれているが,これは形式上の1水和物Na2S2O3・H2Oを次亜硫酸水素ナトリウム(正しくはスルホキシル酸水素ナトリウム)NaHSO2とみなした誤解に由来する名称で,亜二チオン酸ナトリウムNa2S2O4(いわゆる次亜硫酸ナトリウム)と混同されやすく,正しい名称ではない。
性質
5水和物は無色単斜晶系柱状晶。48.2℃で結晶水に溶解して融解する。比重1.71。結晶は大気中で安定であるが,乾いた暖かい空気中では風解し,冷たい空気中では弱い潮解性を示す。水に溶解する際,吸熱により著しく温度が低下する。水100gへの溶解度74.7g(0℃),301.8g(60℃)。エチルアルコールに微溶,液体アンモニアに可溶。2水和物との転移温度48.2℃,2水和物と無水和物との転移温度68.5℃。無水和物は無色単斜晶系の結晶性粉末。比重1.667。220℃で分解する。水100gへの溶解度50g(0℃),231g(80℃)。空気中で熱すると酸化されて硫酸ナトリウム,二酸化硫黄,水に分解する。空気を断って強熱すると,硫酸ナトリウム,硫化ナトリウム,硫黄を生ずる。水溶液は低温で空気に触れなければ安定であるが,アルカリ性では容易に空気酸化されて硫酸塩になる。酸で分解し,二酸化硫黄と硫黄を遊離する。亜硫酸ナトリウムが共存すると弱酸性でも比較的安定である。ヨウ素と定量的に反応し,ヨウ素の定量に利用される。
2Na2S2O3+I2─→2NaI+Na2S4O6
水溶液は塩素を吸収するので塩素の除去に用いられる。
Na2S2O3+4Cl2+5H2O─→2NaCl+2H2SO4+6HCl
ハロゲン化銀と作用して水溶性のチオスルファト銀錯塩をつくるので,写真の定着に用いられる。
AgX+2Na2S2O3─→Na3[Ag(S2O3)2]+NaX
製法
硫化染料製造の際に硫化ナトリウムの酸化による副産物として生成する。亜硫酸ナトリウム水溶液に硫黄を加えて煮沸するか,炭酸ナトリウム水溶液に硫化ナトリウムを加え二酸化硫黄を通ずる方法,または,水酸化ナトリウムの水溶液に硫黄華を加えて熱し,五硫化ナトリウムNa2S5の溶液をつくり,冷却後,硫化物の反応がなくなるまで亜硫酸水素ナトリウムを加えてろ(濾)液を冷却する,などの方法で5水和物が得られる。無水和物は5水和物を80℃で乾燥して得られるが,硫化水素ナトリウムNaHSを100~150℃に熱しても得られる。
用途
写真定着剤,塩素廃ガスの中和剤,パルプや木綿などの漂白後の脱塩素剤,媒染剤に用いられる。また麦わら,毛,象牙の漂白に用いるが,誤用すると危険であるため,食品の漂白に使用してはならない。テトラエチル鉛,チオグリコール酸,染料中間物などの製造用とされ,実験室ではヨウ素滴定の二次標準試薬に用いられる。ヒ素,水銀,鉛中毒などの万能解毒剤となる。
執筆者:藤本 昌利
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「チオ硫酸ナトリウム」の解説
チオ硫酸ナトリウム
チオリュウサンナトリウム
sodium thiosulfate
Na2S2O3(158.11).IUPACの認める慣用名.特性基置換命名法ではスルフロチオ酸ナトリウム(sodium sulfurothioate).市販品は五水和物または無水塩.写真定着用のハイポ(hypo)は旧誤称の次亜硫酸ソーダ(sodium hyposulfite)から.Na2SO3水溶液に硫黄を加えて煮沸,濾過,濃縮すると五水和物の結晶が析出する.また,NaOH水溶液にSを反応させて得たNa2S水溶液に,SO2を通じても得られる.五水和物を加熱すると,48 ℃ で二水和物になり,68 ℃ で無水塩となる.五水和物は単斜晶系.無水塩は高温ではβ,γ形になるが,室温で安定なα形は単斜晶系.223 ℃ でNa2SO4とNa2S5に分解する.イオン結晶で,[S2O3]2- が存在する.S-O1.47 Å,S-S2.01 Å.五水和物,無水物ともに無色の結晶.五水和物は乾いた空気中では風解し,湿った空気中では潮解する.水に可溶.溶ける際にいちじるしい温度降下がみられる.水溶液はほぼ中性を示す.水溶液は空気に触れるとしだいに酸化され,加熱で促進され,硫黄を析出する.I2 と反応して,テトラチオ酸塩になる.
I2 + 2Na2S2O3 → 2Na2S4O6 + 2NaI
Cl2 と反応して,硫酸水素塩になる.
4Cl2 + Na2S2O3 + 5H2O → 2NaHSO4 + 8HCl
ハロゲン化銀を錯体にして溶かす([Ag(S2O3)]-)ので,銀塩写真の定着液に使われる.そのほかのいくつかの金属とも錯体をつくる.アルカリを加えた水溶液は空気に触れると酸化されて,SO42-を生じる.水溶液に酸を加えると,
Na2S2O3 + 2HCl → 2NaCl + H2O + S + SO2
などの反応で分解する.水溶液の塩素除去処理用,鉱石から銀の抽出,繊維の染色やなせんの媒染剤,クロム酸塩染色の還元剤,骨,ゾウゲ,油脂などの漂白剤,分析試薬,医薬品(シアンの解毒剤)などに用いられる.[CAS 7772-98-7]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
日本大百科全書(ニッポニカ) 「チオ硫酸ナトリウム」の意味・わかりやすい解説
チオ硫酸ナトリウム
ちおりゅうさんなとりうむ
sodium thiosulfate
チオ硫酸のナトリウム塩。チオ硫酸ソーダともいう。化学式Na2S2O3、式量158.1。五水和物は俗にハイポとよばれるが、これはチオ硫酸塩が古くは次亜硫酸塩hyposulfiteとよばれたことに由来する。亜硫酸ナトリウムの水溶液に粉末硫黄(いおう)を加えて煮沸し反応させたのち、加熱濃縮すれば五水和物として析出する。硫化ナトリウムと二酸化硫黄との反応、多硫化ナトリウムと亜硫酸水素ナトリウムとの反応によっても得られる。五水和物結晶は空気中では安定であるが、冷たい空気中ではいくぶん潮解し、乾燥した空気中では風解する。48.2℃で結晶水の中に溶けて液状となる。水に溶けやすく、その際多量の熱(11kcal/mol)を吸収する。チオ硫酸ナトリウムは容易に酸化されて硫酸塩やポリチオン酸塩に変わる性質があるので、強い還元剤として働く。たとえばヨウ素と次の式に従って定量的に反応するので、ヨウ素滴定法の試薬となる。
I2+2Na2S2O3→2NaI+Na2S4O6
また、ハロゲン化銀と反応して水溶性の銀錯塩をつくるので、写真現像の際の定着剤として用いられる。水溶液は塩素を吸収する。
Na2S2O3+4Cl2+5H2O→2NaCl+2H2SO4+6HCl
そのほかメチレンブルーなどの染料の原料、高級紙の脱塩素剤、クロムなめしにおける重クロム酸塩の還元剤、また重金属中毒、妊娠中毒などの解毒剤として用いられる。
[鳥居泰男]
チオ硫酸ナトリウム(データノート)
ちおりゅうさんなとりうむでーたのーと
チオ硫酸ナトリウム五水和物
Na2S2O3・5H2O
式量 248.2
融点 48.45℃
沸点 ―
比重 1.1715(測定温度27℃)
結晶系 単斜
屈折率 (n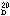 ) 1.4886
) 1.4886
溶解度 74.7g/100g(水0℃)
301.8g/100g(水60℃)
ブリタニカ国際大百科事典 小項目事典 「チオ硫酸ナトリウム」の意味・わかりやすい解説
チオ硫酸ナトリウム
チオりゅうさんナトリウム
sodium thiosulfate
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「チオ硫酸ナトリウム」の意味・わかりやすい解説
チオ硫酸ナトリウム【チオりゅうさんナトリウム】
→関連項目ダゲレオタイプ|定着液
出典 株式会社平凡社百科事典マイペディアについて 情報
栄養・生化学辞典 「チオ硫酸ナトリウム」の解説
チオ硫酸ナトリウム
関連語をあわせて調べる
ドンド焼き,サイト焼き,ホッケンギョウなどともいう。正月に行われる火祭の行事で,道祖神の祭りとしている土地が多い。一般に小正月を中心に 14日夜ないし 15日朝に行われている。日本では正月は盆と同様魂...

