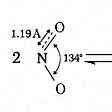精選版 日本国語大辞典 「二酸化窒素」の意味・読み・例文・類語
にさんか‐ちっそニサンクヮ‥【二酸化窒素】
- 〘 名詞 〙 =さんかちっそ(酸化窒素)④
日本大百科全書(ニッポニカ) 「二酸化窒素」の意味・わかりやすい解説
二酸化窒素
にさんかちっそ
nitrogen dioxide
窒素と酸素の化合物。過酸化窒素ということもあるが、過酸化物ではないので、これは誤称である。一酸化窒素と酸素の混合気体(体積2対1)を寒剤で冷却、液化してつくるか、硝酸鉛(Ⅱ)を熱して発生する気体を寒剤で冷やして酸素と分離してつくる。工業的には、アンモニアの接触酸化反応ガスから大規模に製造される。常温で赤褐色気体、液体は黄色、固体は無色。固体では会合して四酸化二窒素N2O4として存在する。気体および液体では、二酸化窒素と四酸化二窒素はのような平衡が存在していて、つねに共存している。平衡状態での混合気体中のNO2の体積%は、27℃で33.3%、50℃で57.1%、154℃で100.0%であり、さらに高温になると一酸化窒素に解離する。二酸化窒素は褐色、常磁性であるが、四酸化二窒素は無色、反磁性である。酸化作用が強く、炭素、リンなどはこの気体中で燃焼する。液相中ではN2O4 NO++NO3-のように解離し、導電性があり多くの物質を溶かす。濃硫酸、濃硝酸に溶け、ニトロシル塩となる。水に溶けて硝酸と亜硝酸を生じる。二酸化窒素は刺激臭があり、きわめて有毒である。大気中100ppm以上の濃度では連続して吸入すると死に至る。硝酸製造の原料となるほか、液体はロケット燃料、有機合成のニトロ化剤、金属硝酸塩無水物の調製に用いられる。
NO++NO3-のように解離し、導電性があり多くの物質を溶かす。濃硫酸、濃硝酸に溶け、ニトロシル塩となる。水に溶けて硝酸と亜硝酸を生じる。二酸化窒素は刺激臭があり、きわめて有毒である。大気中100ppm以上の濃度では連続して吸入すると死に至る。硝酸製造の原料となるほか、液体はロケット燃料、有機合成のニトロ化剤、金属硝酸塩無水物の調製に用いられる。
[守永健一・中原勝儼]
二酸化窒素(データノート)
にさんかちっそでーたのーと
二酸化窒素
NO2
式量 46.0
融点 -9.3℃
沸点 21.3℃
比重 固体 1.896(測定温度-79℃)
化学辞典 第2版 「二酸化窒素」の解説
二酸化窒素
ニサンカチッソ
nitrogen dioxide
NO2(46.01).一酸化窒素と酸素を混合すると生成する褐色の気体.二量体である四酸化二窒素と平衡状態にあり,固体はほとんど純粋なN2O4.液体も沸点21.1 ℃ で約1% のNO2を含むだけであるが,気体は温度の上昇とともにNO2が増し,27 ℃,1 atm で27%,150 ℃ ではほとんど純粋なNO2となる.構造は図に示すような折れ線形で,非局在の不対電子1個をもち常磁性を示す.酸化力が強く,炭素,硫黄,リンなどはこのなかで燃える.水に作用させると硝酸と亜硝酸を生じる.600 ℃ 以上の高温で,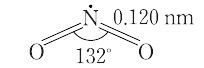
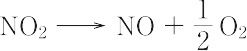
のように分解する.硝酸の製造,硝化剤,酸化剤,アクリレートの重合禁止剤として用いられる.毒性が強く,吸入すると肺がおかされ,200 ppm 程度でも死に至るおそれがある.[CAS 10102-44-0][別用語参照]大気汚染,窒素酸化物
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「二酸化窒素」の意味・わかりやすい解説
二酸化窒素【にさんかちっそ】
→関連項目環境基準|酸化窒素|ディーゼル排出ガス公害
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「二酸化窒素」の意味・わかりやすい解説
二酸化窒素
にさんかちっそ
nitrogen dioxide
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「二酸化窒素」の解説
二酸化窒素
世界大百科事典(旧版)内の二酸化窒素の言及
【酸化窒素】より
…融点は-163.6℃,沸点-151.8℃,水に対する溶解度7.35ml/100ml(0℃)。酸素にふれると速やかに酸化されて褐色の二酸化窒素となる。 2NO+O2―→NO2ニトロシルイオンNO+がたやすく生成し,NO+HSO4-,NO+ClO4-,NO+BF4-,NO+MoF6-,NO+SbCl6-などの化合物がある。…
【窒素酸化物】より
…窒素酸化物NOxとは窒素の酸化物の総称であるが,大気中の窒素酸化物の大部分を占めるのは一酸化窒素NOと二酸化窒素NO2であり,また,これらは炭化水素との共存下で太陽光線の作用により光化学スモッグを生成するところから,一般にはNOとNO2の総和を窒素酸化物と呼ぶ。窒素酸化物の発生源としては,雷,土壌中の微生物の作用など自然現象に由来するものもあるが,近年,工業の発達とともに自動車および工場設備からの発生量が急速に増大し,光化学スモッグによる公害問題を引き起こすに至っている。…
※「二酸化窒素」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...