安定度定数
あんていどていすう
stability constant
錯体の水溶液中における安定度を示す定数。通常、錯体の生成定数をもって表すので錯生成定数ともよばれる。たとえば、金属イオンMと配位子L(それぞれ電荷は省略)との間に、次のような錯体を逐次生成するとき、次式のようになる。

このときk1, k2, ……, knを、それぞれの段階での逐次安定度定数といい、すべての逐次安定度定数の積Kを、全安定度定数または単に安定度定数という。すなわち、
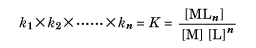
である。ただし水溶液中での反応であるから、正しくは濃度のかわりに活量(活動度)を用いなくてはならないが、すべての場合に活量を求めるのは容易ではないので、各種濃度での測定を行い、無限希釈に補外(外挿)して活量係数1の場合の値として求めている。一般にはこのKを安定度定数といっているが、通常はこの値の常用対数をとって表すことのほうが多い。
安定度定数は、水溶液中に存在するアクア金属イオンが配位子と反応して、どの程度置換しているかということを示すものであるから、水溶液での金属イオンの挙動を知るうえできわめて重要なものである。たとえば[Ni(NH3)6]2+イオンでは、logK=8.01であり、したがって水溶液中でのニッケル(Ⅱ)のアクアイオンに十分のアンモニアを反応させると、圧倒的にアンミン錯イオンができていることがわかる。また安定度定数を活量を用いて求めた値は、とくに熱力学的安定度定数ということがあり、これからエントロピー変化、エンタルピー(熱含量)変化、自由エネルギー変化のような熱力学的定数を求めることができるので重要である。
安定度定数は単座配位子だけでなく、多くの多座配位子のつくるキレート化合物についても測定されている。キレート配位子のつくる錯体の安定度定数は、そのキレート配位子と対応する単座配位子での安定度定数と比べると、つねにかなり高い値をとる。たとえば、[Ni(en)3]2+のKではlogK=13.82で、対応する[Ni(NH3)6]2+でのKの105.8倍も安定であることになる(enはエチレンジアミン)。このような効果をキレート効果といっている。
錯体の安定な度合いを考えるために、生成定数ではなく、解離定数をとる考え方もあり、これはちょうど安定度定数の逆数となり、不安定度定数とよばれる。
[中原勝儼]
出典 小学館 日本大百科全書(ニッポニカ)日本大百科全書(ニッポニカ)について 情報 | 凡例
Sponserd by 
安定度定数
アンテイドテイスウ
stability constant
ある化学種の安定度(stability)には,熱力学的安定度(thermodynamic stability)と速度論的安定度(kinetic stability)の2種類がある.熱力学的安定度は,化学反応系が平衡に達したときの系に含まれる化学種の量の尺度であり,反応系と生成系のギブズ自由エネルギーによる.また速度論的安定度とは,変換が起こる速度に関するもので,活性化自由エネルギーによっている.熱力学的安定度について,ある化学種が生成するときの平衡定数を生成定数(formation constant)または安定度定数とよび,解離するときの平衡定数を解離定数という.金属イオンMと単座配位子Lを含む溶液中で,可溶性単核錯体のみが生成するときには,平衡にある系は次のように表される.
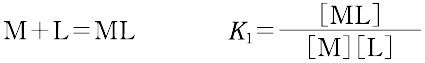
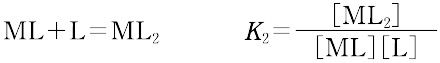
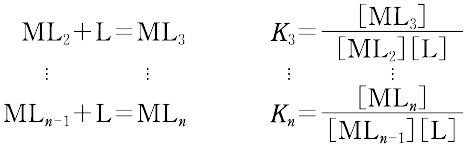
錯形成は逐次的に進行し,平衡は存在する錯体の数n個の平衡定数によって表される.nは金属イオンMに配位する配位子 Lの最大の配位数を示しており,配位子によって異なる.また,平衡関係を表すのに次のような方法もある.
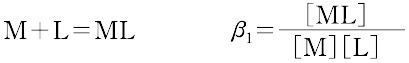
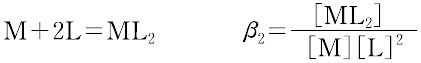
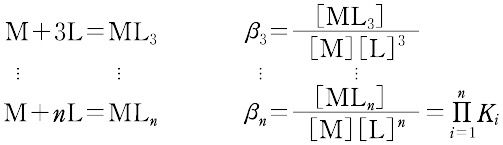
ここで,Ki を逐次安定度定数,βi を全安定度定数という.[ ]は mol L-1 で表した化学種の濃度で,Ki は濃度定数(concentration constant)で,ある特定のイオン強度(多くはI = 0.1)に対してのみ適用できる.真の熱力学的定数(I = 0における値)を得るためには,すべての濃度に活量係数を乗じなければならない.または,いろいろなイオン強度で得られる濃度定数をI = 0へ外挿して得られる.d0 または d10 の中心金属イオンでは,中心イオンの荷電が大きく,イオン半径の小さいものほど,配位子の孤立電子対を強く引きつけるので,log K1 は大きくなる.d電子をもつ錯体ではこの関係は成り立たない.第一遷移系列の二価イオンでは,log K1 は,
Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ > Zn2+
(アービング-ウィリアムスの系列)
となる.Ki の値は,一般にiの値が大きくなるとともに徐々に低下する.塩基性の強い(pKa 値の大きい)配位子は中心イオン(ルイス酸)と結合が強く,log K1 が大きい.また,キレート環を含まない系の錯体と,それと同種で,一つ以上のキレート環を含む系の錯体についてlog βを比較すると,後者のほうが大きい.これをキレート効果という.[別用語参照]レービル錯体
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
Sponserd by 
安定度定数 (あんていどていすう)
stability constant
錯生成定数complex formation constantともいう。溶液中における錯体の生成しやすさを表す尺度で,平衡状態にある錯体の活動度(活量)aMLと錯体を構成する金属イオン(場合によってはプロトンも含む)の活動度aMおよび配位子の活動度aLとの関連を示す量である。金属イオンMと配位子Lが反応して錯体を生ずるとき,
M+L⇄ML,ML+L⇄ML2,
……,MLn-1+L⇄MLn
の反応に対して,それぞれの錯体の逐次安定度定数kは,各温度,圧力において
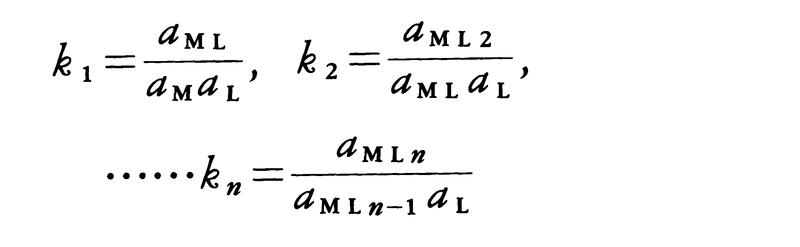
と定義される。溶液が十分に希薄(イオン強度I=0)か,あるいは反応に無関係とみなされる一定濃度の塩(しばしば過塩素酸ナトリウムNaClO4や硝酸ナトリウムNaNO3が用いられる)を加え,その溶液中では反応する各化学種の活動度係数がそれらの化学種の濃度によらないとみなしうるときには,活動度の代りに濃度([ ]で示す。単位はしばしばmol/dm3が用いられる)を用いることができる。すなわち,
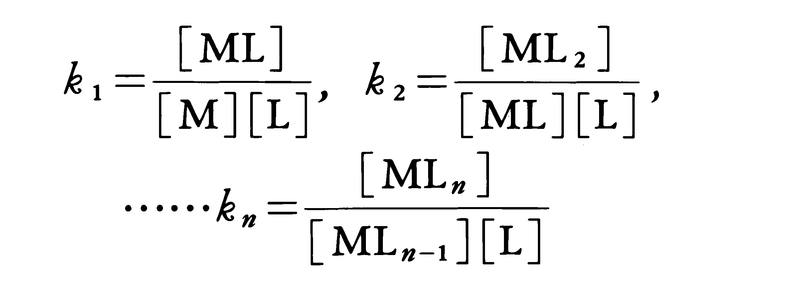
この場合,kの値は加えた塩の種類や溶液のイオン強度によって異なる。また安定度定数の値は溶媒によって大きく異なる。錯体の生成を
M+L⇄ML,M+2L⇄ML2,
……,M+nL⇄MLn
と書き表せば,錯体の全安定度定数β(Kと書くこともある)は
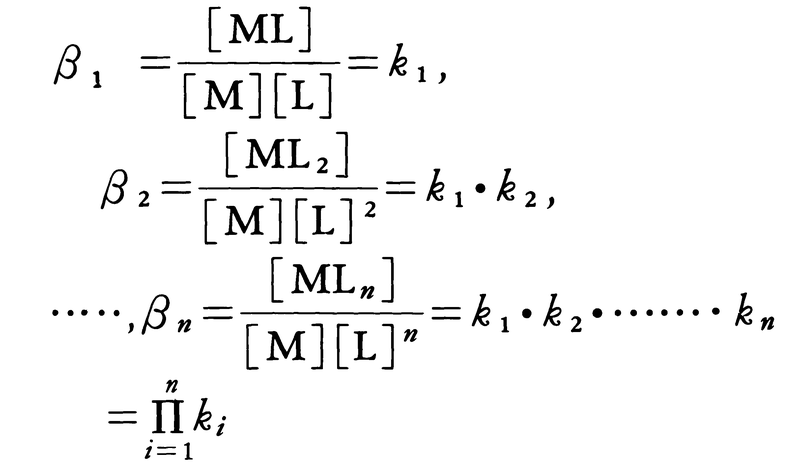
で与えられる。
執筆者:大瀧 仁志
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
Sponserd by 
安定度定数
あんていどていすう
stability constant
錯体の安定度を示す平衡定数。金属イオン M と配位子 A が段階的に反応して MAn のような錯体を生成するとき,それぞれのモル濃度 (mol/l) [ ]によって,各段の平衡定数は,
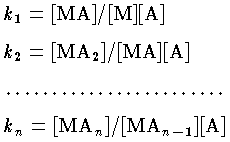 となり,k1,k2,…,kn を逐次安定度定数という。また,
となり,k1,k2,…,kn を逐次安定度定数という。また,
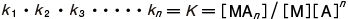 として,K を全安定度定数という。錯体の生成しやすさを示す尺度で,大きい値ほど安定性が高い。電位差法,分光光度法,ポーラログラフ法,イオン交換法,溶媒抽出法などを利用して測定される。
として,K を全安定度定数という。錯体の生成しやすさを示す尺度で,大きい値ほど安定性が高い。電位差法,分光光度法,ポーラログラフ法,イオン交換法,溶媒抽出法などを利用して測定される。
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
Sponserd by 

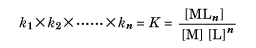


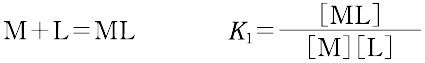
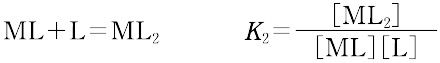
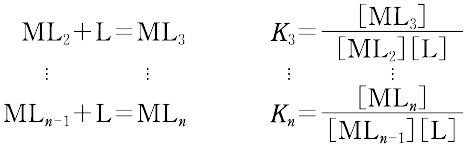
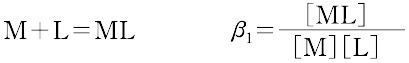
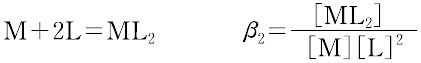

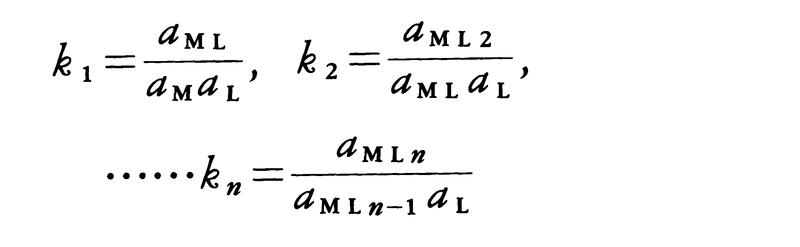
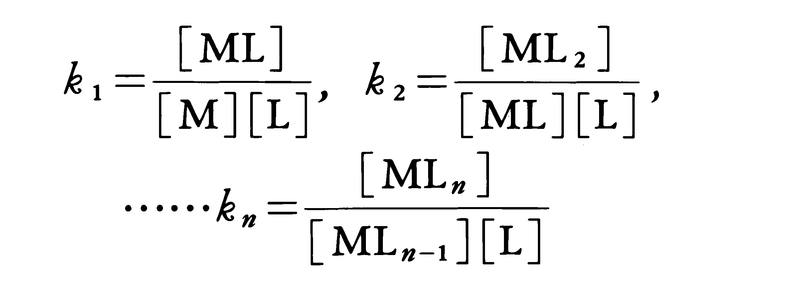
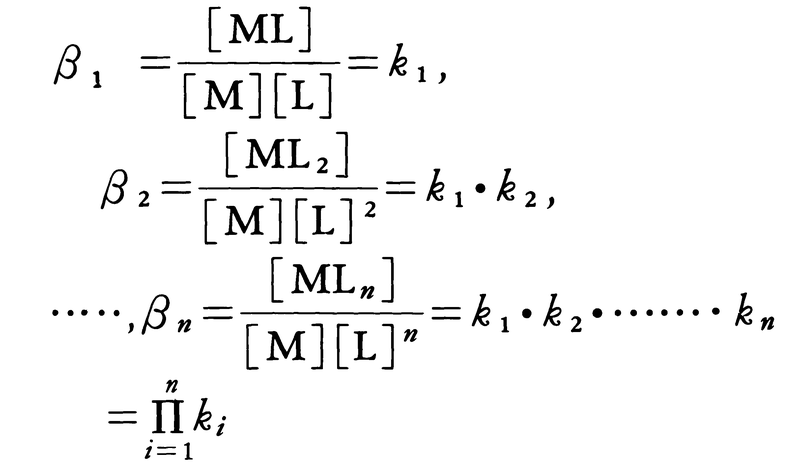
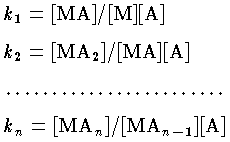 となり,k1,k2,…,kn を逐次安定度定数という。また,
となり,k1,k2,…,kn を逐次安定度定数という。また,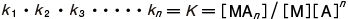 として,K を全安定度定数という。錯体の生成しやすさを示す尺度で,大きい値ほど安定性が高い。電位差法,分光光度法,ポーラログラフ法,イオン交換法,溶媒抽出法などを利用して測定される。
として,K を全安定度定数という。錯体の生成しやすさを示す尺度で,大きい値ほど安定性が高い。電位差法,分光光度法,ポーラログラフ法,イオン交換法,溶媒抽出法などを利用して測定される。