翻訳|activity
精選版 日本国語大辞典 「活動度」の意味・読み・例文・類語
かつどう‐どクヮツドウ‥【活動度】
- 〘 名詞 〙 ⇒かつりょう(活量)
改訂新版 世界大百科事典 「活動度」の意味・わかりやすい解説
活動度 (かつどうど)
activity
溶液の一種の実効濃度で,活量ともいう。実在系に対する熱力学理論の展開において,G.N.ルイス(1907)により導入された概念である。溶液の性質はその組成によるが,蒸気圧,沸点,凝固点など多くの性質は組成と必ずしも簡単な関係をもたない。これは,各成分分子間の相互作用によって,それらの存在状態が影響を受けるためである。溶液中の成分iの存在状態は熱力学的に化学ポテンシャルμiで表されるが,μiと濃度との関係を
μi=μi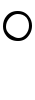 +RTlnai
+RTlnai
と書き,活動度aiが定義される。ここでRは気体定数,Tは絶対温度,lnは自然対数を表し,μi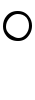 はai=1のときの化学ポテンシャルで,標準化学ポテンシャルという。十分希薄な溶液では活動度は濃度(モル分率xi)に等しくなる。濃度との不一致の程度は,ai=fixiとおき,活動度係数fiを定義し,これで表すことができる。多くの場合,濃度が高くなるほどfiは1より小さくなり,成分間の相互作用が大きいほど著しい。電解質溶液の場合にはイオンの活動度が定義されるが,かなり低濃度でもイオンの活動度係数は1よりはずれる。これは陽イオン,陰イオン間の静電的相互作用のためであり,P.J.W.デバイとヒュッケルW.K.F.B.Hückelにより理論的に取り扱われた。
はai=1のときの化学ポテンシャルで,標準化学ポテンシャルという。十分希薄な溶液では活動度は濃度(モル分率xi)に等しくなる。濃度との不一致の程度は,ai=fixiとおき,活動度係数fiを定義し,これで表すことができる。多くの場合,濃度が高くなるほどfiは1より小さくなり,成分間の相互作用が大きいほど著しい。電解質溶液の場合にはイオンの活動度が定義されるが,かなり低濃度でもイオンの活動度係数は1よりはずれる。これは陽イオン,陰イオン間の静電的相互作用のためであり,P.J.W.デバイとヒュッケルW.K.F.B.Hückelにより理論的に取り扱われた。
→化学ポテンシャル →デバイ=ヒュッケルの理論
執筆者:妹尾 学
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「活動度」の意味・わかりやすい解説
活動度
かつどうど
activity
反応の平衡や速度を議論するときに使われる濃度の有効値のことで、通常は活量という。一般に化学反応において反応する程度は、反応する物質相互の濃度に直接比例するものではなく活動度がきいてくる。気体反応の場合、圧力(または濃度)が小さい間の平衡定数は、温度のみに依存する定数で、各成分の濃度(モル濃度)によらないが、圧力が数十気圧から数百気圧になると、それぞれのモル濃度に、ある補正係数を掛けないと平衡定数が一定値にならなくなる。これは、各成分の間の相互作用のため、理想気体の挙動から外れるためである。また溶液の場合も溶質の濃度が薄い間は、溶液の挙動(ヘンリーの法則など)や、起電力などは、溶かした溶質の濃度そのものを用いれば、理論式によく合致する。しかし濃度が高くなれば、しだいにあわなくなり、活動度を考えることが必要になる。これらはいずれも各成分間の相互作用が大きくきいてくるからであり、その不一致の程度を補正するものを活動度係数あるいは活量係数といっている。
[戸田源治郎・中原勝儼]
化学辞典 第2版 「活動度」の解説
活動度
カツドウド
activity
[別用語参照]活量
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「活動度」の意味・わかりやすい解説
活動度
かつどうど
「活量」のページをご覧ください。
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
世界大百科事典(旧版)内の活動度の言及
【質量作用の法則】より
…その後,彼らが用いた反応速度式(2),(3)は一般的には成り立たないことが明らかになったが,(1)の関係がつねに成り立つことは熱力学により証明された。(1)式でより厳密には濃度の代りに活動度(活量)が用いられる。活動度は物質の活性を表す熱力学的濃度とみなされる量で,十分希薄な溶液では活動度は濃度に等しい。…
※「活動度」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
[名](スル)二つ以上のものが並び立つこと。「立候補者が―する」「―政権」[類語]両立・併存・同居・共存・並立・鼎立ていりつ...

