日本大百科全書(ニッポニカ) 「イオン積」の意味・わかりやすい解説
イオン積
いおんせき
ion product
プロトン(陽子)性溶媒は自己を極性溶媒とみなしてカチオン(陽イオン)とアニオン(陰イオン)とに電離する。たとえば、液体アンモニアは
2NH3 NH4++NH2-
NH4++NH2-
と電離し、溶媒にプロトンが結合したカチオンと溶媒からプロトンが引き抜かれたアニオンになり、平衡となる。溶媒カチオンが酸であり、溶媒アニオンが塩基である。水の場合は分かりやすい。水は
2H2O H3O++OH-
H3O++OH-
に電離する。すなわち溶媒の水にプロトンが付加したカチオンと、溶媒からプロトンが引き抜かれたアニオンに電離して平衡となり、H3O+が酸であり、OH-が塩基である。このようにカチオンとアニオンのイオン濃度の積(厳密には両者の活量の積)を自己プロトリシス定数といい、広義にはこれをイオン積という。なおH3O+をヒドロニウムイオンというが、化学ではこれを単にH+と書き、溶液中の水素イオンを表す習慣がある。
これに対して狭義には、純水および希薄溶液における水素イオンH+と水酸化物イオンOH-の活量(活動度)または濃度の積をいう。温度が高いほど大きくなる。活量をそれぞれa(H+)、a(OH-)、a(H2O)と表すと、水の電離平衡
H2O H++OH-
H++OH-
の平衡定数Kは、
K=a(H+)・a(OH-)/a(H2O)
と表される。単体の活量は単位1に等しいと定義されているので、水の活量a(H2O)は1とみなせるから、
K=a(H+)・a(OH-)
となる。活量は濃度と活量係数の積で表されるので、水素イオンおよび水酸化物イオンの濃度をそれぞれ[H+]、[OH-]で表し、活量係数をそれぞれf(H+)、f(OH-)と表すと、平衡定数Kは
K=f(H+)・f(OH-)[H+][OH-]
となる。濃度で表した平衡定数をKwとすると
Kw=[H+][OH-]
であるから、
K=f(H+)・f(OH-)・Kw
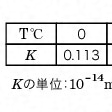
となる。このKwを水のイオン積または単にイオン積ということがある。各温度(T℃)における水のイオン積Kの値をに示す。
一般に溶液中のイオン活量係数fは1より小さいので、Kwは真の平衡定数Kよりやや大きい。厳密な議論でなければ、Kの値をKwとして用いてよい。すなわち温度25℃において
Kw=1.008×10-14mol2dm-6
である。イオン積は導電率測定、濃淡電池(濃度の異なる相と相の間の物質移動を生ずる電池)の起電力測定、塩の加水分解度測定から求めることができる。なお難溶性塩の溶解度積を表すイオン濃度の積をイオン積ということもある。
[成澤芳男]
『玉虫伶太著『電気化学』第2版(1991・東京化学同人)』▽『田中稔・渋谷康彦・松下隆之・増田嘉孝著『分析化学演習』(1993・三共出版)』
化学辞典 第2版 「イオン積」の解説
イオン積
イオンセキ
ionic product
純粋な水あるいは希薄溶液における水素イオンと水酸化物イオンの活量または濃度の積.
Kw = aH+ × aOH-,
あるいは近似的に
Kw = cH+ × cOH-.
この積は一定温度では一定値であり,25 ℃ において
Kw = 1.008×10-14 mol2 L-2(×10-8 mol2 m-6).
温度が高いほど大きくなる.純水の電気伝導率,または一次電池の起電力測定から求められる.上式より常温では
cH+ = cOH- = 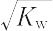 = 10-7 mol L-1
= 10-7 mol L-1
= 10-4 mol m-3.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「イオン積」の意味・わかりやすい解説
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...