精選版 日本国語大辞典 「状態方程式」の意味・読み・例文・類語
じょうたい‐ほうていしきジャウタイハウテイシキ【状態方程式】
改訂新版 世界大百科事典 「状態方程式」の意味・わかりやすい解説
状態方程式 (じょうたいほうていしき)
equation of state
熱平衡にある物質の状態量の間には,ある種の関係式が成り立つ。これを状態方程式,あるいは単に状態式という。物質は非常に多数の分子から構成されるので,微視的な立場からみると変数は非常に多いが,熱平衡状態における物質の熱力学的な性質は,通常,物質の状態のみによって定まる巨視的な量である状態量と呼ばれる少数の量で記述される。状態量として圧力p,体積V,絶対温度Tをとった場合,ふつうp,V,Tの間の関係式を状態方程式と呼んでいる。
状態方程式の歴史は古く,17世紀の半ばごろまでさかのぼることができる。すなわち,イギリスの物理学者R.ボイルは,1662年,一定温度のもとで,一定量の気体の体積はその圧力に反比例すること(ボイルの法則)を明らかにした。それから1世紀ほどたって,フランスの物理学者J.シャルルは,1787年,一定圧力の場合,気体の体積は絶対温度に比例すること(シャルルの法則,またはゲイ・リュサックの法則という)を見いだした。現在では,この両者の法則を合わせて,ボイル=シャルルの法則という。この法則によると,一定量の気体に対し,pV∝Tの関係が成立する。とくに1molの気体の場合,この関係式を,
pV=RT ……(1)
と書く。ここでRは気体定数と呼ばれる。
(1)は,厳密にいうと分子間に力が働かないような気体(理想気体)に対して成り立つ状態方程式である。現実の気体でも,それが常温,常圧であれば,十分な精度で(1)が正しいと考えてよい。しかし,低温になったり,あるいは高圧の場合には(1)は必ずしも正確とはいえない。とくに,(1)の状態方程式は気体が適当な条件下で液体になるという現象(液化)の説明にはまったく無力である。これらの欠陥を改良するため,オランダの物理学者ファン・デル・ワールスは,1873年,1molの気体に対する状態方程式として,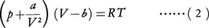
という式を提唱した。ただし,a,bは気体の種類によって決まる定数で,とくにa=b=0とおけば(2)は(1)に帰着する。(2)をファン・デル・ワールスの状態方程式という。この方程式は,(1)と異なり,臨界点の存在とか,液体の状態方程式を定性的に与える。
気体は,液体や固体と違って分子間の相互作用の影響が小さく,このため気体の状態方程式は統計力学における一つの重要な課題として理論的な研究がなされてきた。実在の気体は,理想気体ではなく,分子間に力が働いているのでこれを不完全気体ということもある。不完全気体の統計力学は,現在,確立された理論体系であるが,これによるとnmolの不完全気体の状態方程式は,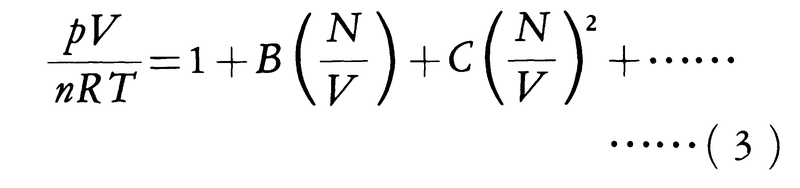
と表される。ただし,Nは気体中の分子数,BやCは温度の関数で,Bを第2ビリアル係数,Cを第3ビリアル係数という。分子間力がわかっていればBやCを計算することができる。また,(3)のようなN/V(すなわち単位体積当りの分子数)に関するべき展開をビリアル展開という。実際には,BやCを温度の関数として実験的に測定し,それから分子間力が求められている。
状態方程式という概念は,気体だけでなく,液体や固体にも適用されるが,場合によってはもう少し広い意味で使われることもある。例えば,鉄やニッケルなどの強磁性体の温度を上げるとキュリー温度Tcに達したとき,強磁性が消失し常磁性への相転移が起こるが,Tc近傍の物性に対しても一種の状態方程式が成立する。すなわち,体系に加えられる磁場の強さをH,磁化をM,また無次元の温度tをt=(T-Tc)/Tcで定義すると,Tc近傍で,
という形の状態方程式が成り立つ。ただし,βやδは臨界指数と呼ばれる定数,またfは物質の種類にあまり依存しない関数でスケーリング関数と呼ばれる。現在,臨界指数,スケーリング関数などの理論的,実験的な研究が活発に行われている。このほか,プラズマ状態にある体系の状態方程式なども論じられている。
→臨界現象
執筆者:阿部 龍蔵
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「状態方程式」の意味・わかりやすい解説
状態方程式
じょうたいほうていしき
equation of state
圧力、温度、体積を三つの変数として物体の状態を表す式。状態式ともいう。したがって気体、液体、固体のそれぞれについて状態式があるが、通常は気体の場合が多く、そのなかでも理想気体の状態式PV=nRTがよく知られている。ここにP、V、Tはそれぞれ圧力、体積、温度を、nはモル数、Rは気体定数を示す。普通はn=1すなわち1モルの式を状態式ということが多い。ボイル‐シャルルの法則(ボイル‐ゲイ・リュサックの法則)から導かれる式である。実際に存在する気体については、分子がある大きさをもっていることや、分子間の引力や反発力があるために、理想気体のような簡単な式では表せず、適当な補正項を加えなければならない。補正項に関しては数多くの人々が条件に応じて経験的あるいは理論的に考え、多くの関係式がみいだされているが、そのなかでもオランダの物理学者ファン・デル・ワールスの状態方程式がもっともよく知られている。
[戸田源治郎・中原勝儼]
実際の気体では気体分子間に作用しあっている力や気体分子の大きさを無視することができないので、それらを考慮してなるべく正確に表そうとしたのが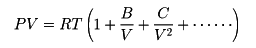
の形の式であり、ビリアルの式とよばれている。ここでB、C、……は温度Tのみの関数であり、第2、第3、……ビリアル係数とよばれる。通常、Bは低温では負、温度が上がると増加して正となり、極大を経てさらに高温になるとゆっくり減少するものであり、B=0となる温度はボイル温度とよばれる。もっと簡単な近似式としてよく知られているのはファン・デル・ワールスの状態方程式であり、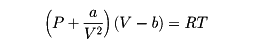
と書かれる。ここでaおよびbはそれぞれ分子間引力および分子の大きさに関係した定数であり、それぞれの気体について定まるものである。
P、V、Tをそれぞれ直角座標軸にとれば、状態方程式は一つの曲面で表されるが、普通は一つの変数を一定とし、他の二つの間の関係を平面上に示す方法がとられる。Tを一定としてPとVの関係を描いたものは等温曲線とよばれる。多くの温度に対する等温曲線を描けば、P、V、Tの間の関係を詳しく示すことができる。
[平野賢一]
百科事典マイペディア 「状態方程式」の意味・わかりやすい解説
状態方程式【じょうたいほうていしき】
→関連項目シャルルの法則|分子量|ボイル=シャルルの法則|理想気体
出典 株式会社平凡社百科事典マイペディアについて 情報
最新 地学事典 「状態方程式」の解説
じょうたいほうていしき
状態方程式
equation of state
熱力学的な平衡での,状態量である温度・圧力・体積の間に成り立つ一定の関係式。最も簡単なものは1成分の気体の温度・圧力・密度(比容)を表す式。地球内部については,圧力・密度・弾性定数の間の関係を示す式。最も広く用いられるMurnaghan-Birchの式は,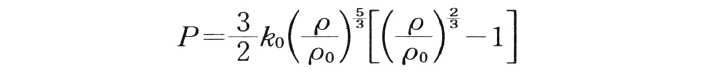
ここで,Pは圧力,ρは密度,k0, ρ0は各0気圧での非圧縮率,密度。この式は地球内部の熱力学的状態をきわめてよく表す。
執筆者:金森 博雄・松葉谷 治
参照項目:気体の状態方程式
出典 平凡社「最新 地学事典」最新 地学事典について 情報
法則の辞典 「状態方程式」の解説
状態方程式【equation of state】
ブリタニカ国際大百科事典 小項目事典 「状態方程式」の意味・わかりやすい解説
状態方程式
じょうたいほうていしき
「状態式」のページをご覧ください。
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
世界大百科事典(旧版)内の状態方程式の言及
【気体】より
…分子間の相互作用が0であるような理想的な気体を理想気体という。
[状態方程式]
一定量の気体の圧力p,体積V,絶対温度Tの間には一定の関係が成り立つ。これを気体の状態方程式という。…
※「状態方程式」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

