翻訳|magnesium
精選版 日本国語大辞典 「マグネシウム」の意味・読み・例文・類語
マグネシウム
- 〘 名詞 〙 ( [英語] magnesium [ドイツ語] Magnesium )
- ① 軽金属元素の一つ。元素記号 Mg 原子番号一二。原子量二四・三〇五。展延性に富む銀白色の金属。地球上に広く存在し、可溶性塩類の形で海水の主要成分となっている。薄い箔や粉末は空気中で強熱すると閃光を発して燃える。還元剤、断熱材、合金材料、フラッシュなどに用いられる。マグネシア。〔遠西医方名物考補遺(1834)〕
- ② フラッシュ。
- [初出の実例]「記念にバウムの写真を撮り度いと思って、町へマグネシウムを買ひに出ましたら」(出典:先生への通信(1910‐11)〈寺田寅彦〉ゲッチンゲンから)
日本大百科全書(ニッポニカ) 「マグネシウム」の意味・わかりやすい解説
マグネシウム
まぐねしうむ
magnesium
周期表第2族に属し、アルカリ土類金属元素の一つ。
歴史
化合物としては硫酸塩七水和物すなわちエプソム塩が、1695年にN・グルーによって単離されており、また1707年にはバレンチンM. B. Valentineが、チリ硝石を処理したあとの母液から塩基性炭酸マグネシウムを取り出している。これはマグネシアアルバmagnesia albaの名で万能薬として用いられていた(アルバは白いを意味する)。マグネシアmagnesiaということばは小アジアの王国リディアの一古代都市の名称で、元素名としてのマグネシウムの語源と考えられるが、古くはいくつかの異なった物質の名称に冠せられていたようである。マグネシアは今日では酸化マグネシウムをさすが、これとても1755年にイギリスのJ・ブラックが明らかにするまでは石灰すなわち酸化カルシウムと混同されていた。1808年イギリスのH・デービーは、酸化マグネシウムの電解によってマグネシウムアマルガムを得、これを蒸留して金属を単離している。さらに1831年にフランスのビュッシーAntoine-Alexandre Bussy(1794―1882)は、塩化マグネシウムをカリウムで還元することによって、ほぼ純粋な金属を塊状で得ることに成功した。1833年にはイギリスのM・ファラデーが、また、1852年にはドイツのブンゼンが、塩化マグネシウムの融解電解によって金属マグネシウムを得ているが、1886年にドイツでカーナル石KCl・MgCl2・6H2Oの融解電解に成功して以来、工業的に生産されるようになった。
[鳥居泰男]
存在
天然に遊離状態では産出しないが、地球上に広く多量に分布している。菱苦土(りょうくど)石、カーナル石、苦灰石(ドロマイト)、滑石、蛇紋(じゃもん)石、石綿などが主要な鉱石であるが、輝石、角閃(かくせん)石などにも含まれる。また可溶性塩類として海水、鉱泉などにも存在している。海水からの効率的・経済的な抽出法が考案されたことにより、マグネシウムの供給は事実上無限と考えられる。また、植物の葉緑素の中にはクロロフィルとして含まれ、動物の生理にも重要な役割を果たしている。
[鳥居泰男]
製法
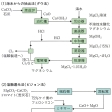
工業的には無水塩化マグネシウムの融解塩電解法と、炭素による高温還元あるいはカーバイド、フェロシリコンなどによる還元法がある。無水塩化マグネシウムは、カーナル石、にがりあるいは海水から直接とるが、酸化マグネシウムを塩素化してつくることもある。また、クロール法によるチタン製造の際の副生塩化マグネシウムも使われる。電解浴はMgCl2・NaCl・KClあるいはMgCl2・2NaClなどの形で660~750℃で電解する。電解槽は鉄または耐火れんが張りで、陽極は黒鉛、陰極は鉄製である。
フェロシリコンによる還元法は、発明者の名にちなんでピジョン法とよばれている。ドロマイトMgCO3・CaCO3を焼成したものに75%ケイ素のフェロシリコン(ケイ素鉄)を加えてブリケット(団鉱)とし、耐熱鋼のレトルトの中に入れて1200℃で熱還元する。これを水銀柱0.001ミリメートル程度の真空で蒸留し、マグネシウムを留出させる。この方法で純度99.7%程度のものが得られる。
炭素による還元は1900~2400℃で行い、生成したマグネシウム蒸気と一酸化炭素を大量の水素ガスで急冷し、得られたマグネシウム粉末を蒸留し、融解してインゴットとする(純度約90%)。この方法は操作が危険で純度もあまりよくないので、現在ではほとんど行われていない。
電解マグネシウムの純度は99.90~99.97%程度で、不純物は銅、マンガン、鉄、ケイ素、鉛などである。これらを除去するため、比較的低温で真空蒸留すると99.99%の製品が得られる。
[鳥居泰男]
性質
銀白色の軽い金属で、かなりの展延性があり、薄い箔(はく)や細い針金にすることができる。空気中では表面に酸化物の薄い被膜ができるので光沢がしだいに鈍くなるが、それが内部を保護することになるので比較的安定である。したがって通常の金属マグネシウムは冷水とは反応せず、熱水で初めて反応する。
Mg+H2O―→MgO+H2
アマルガムにすると冷水とも激しく反応し、また粉末状のものは熱水中で水素を発生して水酸化マグネシウムを生ずる。
Mg+2H2O―→Mg(OH)2+H2
通常、希薄な酸には水素を発生して溶ける。濃硫酸とは二酸化硫黄(いおう)、硫化水素を発生して反応し、濃硝酸とは酸化窒素と少量の窒素、一酸化二窒素、水素を発生して反応し、硝酸アンモニウムをも生成する。希硝酸には水素と二酸化窒素を発生して溶ける。アルカリ水溶液には溶けないが、アンモニウム塩が共存すると溶解する。水銀とアマルガムをつくるほか、多くの金属と合金をつくる。エーテル溶液中で多くの有機ヨウ素化合物と反応し、ヨウ化アルキルマグネシウムをつくる。
薄い箔または粉末を空気中で強熱するとまばゆい光を放って燃え、酸化マグネシウムを生じ、一部は窒化マグネシウムとなる。窒素とは高温で直接反応する。そのほか適当な温度を与えれば、ハロゲン元素、硫黄、炭素、ケイ素、ホウ素などとも直接反応する。
[鳥居泰男]
用途
マグネシウムリボンあるいはマグネシウム粉末としてフラッシュランプ、ゲッター、断熱材などに用いられることはよく知られている。また、チタン、ジルコニウム、ベリリウムなどの純金属製造用還元剤、電気防食などにも使われる。各種マグネシウム合金は実用合金のなかでもっとも軽いので、その特徴を生かして広く使われている。グリニャール試薬としての用途もある。
[鳥居泰男]
人体とマグネシウム
マグネシウムは、人体に約25グラム含まれ、骨にその60~65%が存在し、残りは筋肉、脳、神経、体液などに分布している。生理作用は、骨や歯を形成し、多くの酵素の形成成分として糖質・脂質の代謝などにおける酵素作用の活性化、体内でのタンパク質の合成などに必要である。カルシウムと似た作用があり、とくに骨格においてはカルシウムと拮抗(きっこう)性があることが知られている。食品には動植物全体に分布し、普通の食事から必要な量がほぼとれている。欠乏症は血中脂質の上昇、食欲不振、筋肉痛などがある。腎(じん)機能障害によって過剰症が発症することがある。「日本人の食事摂取基準」(厚生労働省)により、食事からとるべき量については目安量や推奨量が、また、通常の食品以外からの摂取量の上限量が設定されている。
[河野友美・山口米子]
『日本マグネシウム協会マグネシウム技術便覧編集委員会編『マグネシウム技術便覧』(2000・カロス出版)』▽『根本茂著『初歩から学ぶマグネシウム――一番軽い金属構造材』(2002・工業調査会)』▽『糸川嘉則編『ミネラルの事典』(2003・朝倉書店)』▽『日本塑性加工学会編『マグネシウム加工技術』(2004・コロナ社)』▽『外須美夫編『マグネシウムの基礎と臨床 日常診療および周術期における役割』(2005・真興交易医書出版部)』▽『三宅洋左著『知っておきたいマグネシウムの役割 骨粗鬆症・心疾患(虚血性)・肥満予防のための食事』増補(2005・けやき出版)』▽『菱田明・佐々木敏監修『日本人の食事摂取基準2015年版――厚生労働省「日本人の食事摂取基準」策定検討会報告書』(2014・第一出版)』
マグネシウム(データノート)
まぐねしうむでーたのーと
マグネシウム
元素記号 Mg
原子番号 12
原子量 24.305
融点 648.8℃
沸点 1090℃
比重 1.738(測定温度20℃)
結晶系 六方
元素存在度 宇宙 1.050×106(第7位)
(Si106個当りの原子数)
地殻 2.33%(第7位)
海水 1.29×106μg/dm3
改訂新版 世界大百科事典 「マグネシウム」の意味・わかりやすい解説
マグネシウム
magnesium
周期表の第ⅡA族に属するアルカリ土類金属の一つ。天然には炭酸塩,硫酸塩,ケイ酸塩,塩化物などの形のマグネシウム鉱物として広く分布する。海水や鉱泉水中にも可溶性塩類として含まれる。とくに海水1kg中に1.27g程度も含まれ,マグネシウム資源としては重要である。生体中にもつねに存在し,とくに植物の葉緑体中のクロロフィルはマグネシウムを含む複雑な有機錯体で,光合成の中心的役割を果たしている。
性質
銀白色の軽い金属で,モース硬度2.6。半径1.61Åのマグネシウム原子が六方最密充てん(塡)となった構造で,展延性に富み,箔や針金に加工できる。高温ではさらに軟化して変形しやすくなる。原子はネオン原子と同じ電子配列の芯のまわりに2個の3s電子をもつ構造をしており,この3s電子を失ってネオンと同じ構造のMg2⁺になりやすいので,イオン化傾向が高い。このため単体金属は反応性に富み,湿った空気中では徐々に光沢を失い,表面から酸化する。また赤熱以上の温度では強く発光して燃え,酸化物MgOとなるが,この際一部は窒素とも化合して窒化物Mg3N2となる。塩素とは激しく反応して塩化物MgCl2となり,その他のハロゲン,硫黄,リン,ヒ素などとも容易に反応し,つねにMg2⁺イオンを含むイオン性化合物をつくる。また水と煮沸すると徐々に反応し,水酸化マグネシウムMg(OH)2となり,水素を発生する。
Mg+2H2O─→Mg(OH)2+H2
酸には容易に溶けて水素を発生し,その酸の塩になる。
製法
製錬に用いられるおもな原料はドロマイトMgCO3・CaCO3,マグネサイトMgCO3および海水である。ドロマイトは茨城県,栃木県,大分県などから産出されるが,マグネサイトは日本には存在しない。これらは耐火物としても利用される。マグネシウムはイオン化傾向が大きく,水溶液から析出されない。また酸化物を炭素で還元するのにも種々困難を伴うため,現在工業的に用いられているマグネシウム還元方法は電解法とフェロシリコン還元法である。電解法では,マグネシウム塩化物MgCl2を塩化カリウムKClと食塩NaClの溶融塩に溶かし(MgCl2:KCl:NaCl=6:2:2),陽極に黒鉛,陰極に鋳鉄を用いて,730~750℃で電解する。陰極にMg,陽極にCl2が発生する。消費電力はマグネシウム1t当り約1万8000kWhである。マグネシウムは陰極室の表面に浮かぶので,これを採取する。陽極で発生する塩素は酸化マグネシウムMgOと反応させMgCl2とするのに利用される。フェロシリコン還元法の原料は海水からの酸化マグネシウム,またはドロマイトを焼成した酸化マグネシウムである。十分に脱水および炭酸ガスを除いた原料にフェロシリコンの粉末を加えて団鉱とし,これを耐熱鋼製のレトルトに入れ,真空下で約1150℃に加熱する。マグネシウムは還元され,揮発してレトルトの炉の外に出ている部分に凝着,純度の高いマグネシウムとして回収される。この方法は発明者の名前にちなんでピジョンPidgeon法ともいわれる。
用途
実用金属のなかで最も軽いので,軽合金として航空機,車両,カメラなどの材料とされる。欠点は耐食性が悪く,燃えやすいことである。またチタン製錬の際の還元材,ノジュラー鋳鉄用添加剤,アルミニウム合金の添加剤,鉄鋼の防食用などにされる。また燃焼の際の発光を利用してフラッシュランプに,酸素と窒素と化合する性質を利用して高真空をつくるためのゲッターにも用いられる。
執筆者:曽根 興三+後藤 佐吉
生体とマグネシウム
マグネシウムは生体にとってきわめて重要な必須微量元素の一種で,ヒトでは約25g(体重の0.05%)存在する。多種多様な生理作用をもつ。植物では,葉や種子に含まれ,光合成に必須な葉緑素,クロロフィルの中心金属である。欠乏すると葉が白化する。動物では,大部分が骨格中に化合物として存在する。体液では,その約80%がイオンとして存在する。動物では,欠乏すると痙攣(けいれん)や刺激に過敏になるなどの症状を示す。アルコール依存症患者はマグネシウム欠乏症になりやすい。マグネシウムは多種の酵素反応に必須なイオンとして,代謝に与える影響が大きい。とくに,解糖系酵素やATP依存性酵素の必須因子である。ヘキソキナーゼやエノラーゼなどの糖代謝に関する酵素や,DNAポリメラーゼなどの核酸の合成や分解に関する酵素,脂肪酸酸化におけるアセチルCoA合成酵素,コレステロール合成におけるメバロン酸キナーゼなどの脂質代謝に関する酵素や,グルタミン合成酵素などのアミノ酸代謝に関与する酵素などがある。
執筆者:柳田 充弘
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「マグネシウム」の解説
マグネシウム
マグネシウム
magnesium
Mg.原子番号12の元素.電子配置1s22s22p63s2の周期表2族元素.原子量24.305.3種類の安定同位体(24Mg,25Mg,26Mg)と3種類の放射性同位体が存在する.1808年H. Davy(デイビー)が酸化マグネシウムを電解してアマルガムとして得たが,1829年A.A.B. Bussyが塩化マグネシウムをカリウムで還元してはじめて金属を遊離した.炭酸マグネシウム鉱物は錬金術師にmagnesia albaとよばれており,Davyはこれをもとに元素名magniumを提案したが,magnesiumが定着した.宇田川榕菴は天保8年(1837年)出版の「舎密開宗」のなかで,麻倔涅叟母(マクネシウム)タルク,メタールと記載している.
天然には,りょう苦土石,白雲石,滑石,蛇紋石,石綿などの鉱石中に塩の形で産出する.地殻中の存在度32000 ppm.鉱泉,海水中にも1.29 g dm-3 含まれている.マグネシウムのハロゲン化物の融解電解で得られる.また,酸化マグネシウムを還元しても得られる.真空蒸留により精製する.銀白色の展性のある軟らかい金属.六方最密格子構造.格子定数a = 0.321,c = 0.521 nm.密度1.74 g cm-3(20 ℃).融点649 ℃,沸点1090 ℃.湿った空気中では光沢を失う.強熱するとせん光を放って燃え酸化物を生じる.高温で窒素,ヨウ素,臭素,硫黄,セレン,リン,ヒ素,アンチモン,炭素,ケイ素,ホウ素と直接化合する.塩素とは常温ではげしく反応する.赤熱状態で一酸化炭素,二酸化炭素,酸化窒素,二酸化硫黄を還元し,また多くの金属酸化物を還元して金属を遊離する.冷水には酸化皮膜を生じるのみで反応は進まないが,熱水中では水素を発生し水酸化マグネシウムを生じる.酸には水素を発生して溶け,その酸の塩を生じる.水銀とアマルガムをつくり多くの金属と合金をつくる.エーテル中で有機ハロゲン化合物RXと化合しグリニャール試薬RMgXを生じる.イオンはEDTA滴定により容量分析ができる.
フラッシュランプ,ゲッター,保温材,ベリリウムやチタンなど多くの純金属製造用還元剤などに用いられる.アルミニウムより軽く,アルミニウム,その他との合金は自動車,航空機,ミサイルなどに用いられる.2001年にわが国で超伝導臨界温度が39 K であることが見いだされた二ホウ化マグネシウムMgB2は,金属系高温超伝導体として注目されている.[CAS 7439-95-4]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「マグネシウム」の意味・わかりやすい解説
マグネシウム
出典 株式会社平凡社百科事典マイペディアについて 情報
食の医学館 「マグネシウム」の解説
マグネシウム
マグネシウムはカルシウム以上に不足しがちなミネラルです。とくに、ストレスの多い人、加工食品やお酒の好きな人、外食の機会が多い人は、積極的に摂取するべき。また、マグネシウムはカルシウムとの摂取比率がたいせつで、Ca対Mg=2対1の比率が理想的とされます。
マグネシウムはコンブ、ホウレンソウ、ヒジキなどに多く含まれており、成人1日あたりの推奨量は男性320~370mg、女性270~290mgです。
ブリタニカ国際大百科事典 小項目事典 「マグネシウム」の意味・わかりやすい解説
マグネシウム
magnesium
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
漢方薬・生薬・栄養成分がわかる事典 「マグネシウム」の解説
マグネシウム【magnesium】
栄養・生化学辞典 「マグネシウム」の解説
マグネシウム
世界大百科事典(旧版)内のマグネシウムの言及
【海水】より
…これらのイオンは,周囲に水分子を強く引きつけ溶液中に単独で安定に存在している。 2価のイオン,例えばマグネシウムイオンMg2+と硫酸イオンSO42-になると,溶液中で単独の水和イオンとして存在するとともに,イオン間に引きあう力が働いて接近し,見かけ上,電荷をもたない硫酸マグネシウムMgSO40となっている部分ができる。これをイオン対と呼んでいる。…
【軽金属工業】より
…金属工業のうち,比重の比較的小さい金属,すなわち軽金属を扱う工業。軽金属には,アルミニウム,マグネシウム,チタン,ベリリウム,リチウムなどがあるが,とくにアルミニウムは鉄に次いで生産量が多く,軽金属の代表であるので,ここではアルミニウム工業を中心に述べる。
[アルミニウム]
原鉱石(ボーキサイトなど)からアルミナAl2O3を製造する化学的工程と,その電解工程(アルミ1t当り約1万5000kWhを要する)の2過程を要する高度な電気化学工業で,その発達には苛性ソーダ,フッ化物,電力など関連工業の発達,高品位の原鉱石ボーキサイト(Al2O350%以上含有)と,豊富で安価な発電地帯を有することが条件となる。…
※「マグネシウム」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...