セシウム(その他表記)caesium
精選版 日本国語大辞典 「セシウム」の意味・読み・例文・類語
セシウム
改訂新版 世界大百科事典 「セシウム」の意味・わかりやすい解説
セシウム
caesium
cesium
周期表第Ⅰ族に属するアルカリ金属元素の一つ。セシウムの名は,発光スペクトル輝線の青色を意味するラテン語caesiusに由来する。1860年R.W.ブンゼンとG.R.キルヒホフが,ドイツのデュルクハイムの鉱泉水のアルカリ部分から,発光スペクトルによって発見した。単体は82年,ブンゼン研究室のセッターベルクC.Setterbergがシアン化セシウムとシアン化バリウムの混合物の溶融電解で単離した。他のアルカリ金属元素に随伴して,微量ながら広く産出する。セシウム鉱物としてはポルサイトpollucite Cs1-xNaxAlSi2O6が知られている。リチウム鉱物リシア雲母やカリウム鉱物カーナライトに少量随伴する。鉱泉水,温泉水の中にも含まれることがあり,日本では新潟県瀬波温泉,兵庫県有馬温泉がよく知られている。植物灰の中にもカリウムに随伴して微量含まれる。
性質
銀白色の軟らかい金属。硬度0.2。体心立方格子(格子定数a=6.05Å)。比熱0.06cal/deg・g。昇華熱18.83cal/mol(25℃)。比抵抗2.1×10⁻6Ωcm(19.4℃)。高純度のセシウム塩は空青色の炎色反応を示す。陽性の最も強い元素で,単体の反応性はアルカリ金属のうちで最も大きい。常温の空気中でただちに酸化されて酸化物Cs2Oを与え,過剰の酸素と反応すると超酸化物CsO2を生ずる。ハロゲンXと反応してハロゲン化物CsXを,水素と反応して食塩型水素化物CsHを与える。水と激しく反応し,水素を発生して発火し,水酸化物CsOHとなる。酸,エチルアルコールには水素を発生して溶解し,それぞれ対応する酸のセシウム塩またはエトキシドCsOC2H5を与える。液体アンモニアに溶解し,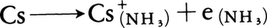
生じた溶媒和電子の光吸収にもとづく青色を与える。イオン化ポテンシャル3.893eV,酸化電位E°=3.02V。電気陰性度0.7。単体は空気との接触による酸化を避けるために,石油,パラフィン油中に浸して保存する。セシウム塩の多くは水に可溶であるが,セシウムミョウバン,塩化白金酸塩,種々のヘテロポリ酸塩などの難溶性塩を与えるため,セシウム塩の分別精製や,可溶性セシウム塩を用いる沈殿分離に利用される。酸化セシウムと銀から成る陰極,またはアンチモンとセシウムの合金は外部光電効果に対する量子効率が大きい。セシウム塩は人体に有害であり,カリウム塩の共存しない場合は植物に有毒である。原子炉内の核分裂生成物,核爆発実験の放射性降下物の主成分の一つである放射性核種セシウム137 137Csは,半減期30年のβ⁻放射体で,体内に入るとカリウムと挙動をともにし,筋肉等に集まる。その体外への排出速度は大きいが,娘核の137mBa(半減期2.6分。mは準安定核の意)が体内でγ線を放出するため,影響は全身に及び,はなはだ危険である。とくに生殖器官に対して重大な影響がある。
137mBa─→137Ba+γ
製法
クロム酸セシウムCs2CrO4または二クロム酸セシウムCs2Cr2O7をジルコニウムで還元する方法および塩化セシウムをバリウムまたはカルシウムで還元する方法があるが,最近はクロム酸セシウムをケイ素またはアルミニウムで還元して金属セシウムがつくられる。
用途
合金はセシウム光電管として広く用いられている。人工放射性核種137Csは核燃料再処理の副産物として安価に多量生産されるので,γ線源として工業,医療に利用される。
執筆者:藤本 昌利
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「セシウム」の意味・わかりやすい解説
セシウム
せしうむ
cesium
周期表第1族に属し、アルカリ金属元素の一つ。1860年ドイツのキルヒホッフとブンゼンは、アルカリ金属の発光スペクトルを研究中、デュルクハイム鉱泉水の残留物の中に、青色領域に未知の輝線を示す新しい元素が含まれていることを発見し、ラテン語の青色caesiusにちなんでセシウムと名づけた。その後、1882年にドイツのセッテルベルグC. Setterbergが、シアン化セシウムとシアン化バリウムの混合物を電解することによって金属単体を取り出すことに成功した。
[鳥居泰男]
存在
自然界に広く分布し、他のアルカリ金属に伴って産出するが、その量はきわめて少ない。鉱物としてはポルサイトCaAlSi2O6やロジサイトなどがあるが、紅雲母(べにうんも)、緑柱石、カーナル石などにも含まれる。鉱泉や温泉(日本では有馬(ありま)温泉など)にも含まれることがある。
[鳥居泰男]
製法
酸化物、水酸化物、塩化物、各種塩類たとえばクロム酸セシウムなどを、ナトリウム、アルミニウムなどの金属類、ケイ素などで還元して蒸気として取り出し、凝縮させる方法が一般に行われる。なかでも無水塩化物を真空中700~800℃で金属カルシウムで還元する方法が優れている。
[鳥居泰男]
性質
銀白色の軟らかい金属で、融点が低いため常温付近で液状を呈することもある。化学的活性がきわめて大きく、たとえば、水和イオンとなる傾向の尺度である標準電極電位はあらゆる金属中もっとも大きい。酸素や水と激しく反応するので、金属ナトリウムのように石油中に保存することをせず、アンプル中に不活性気体とともに封入しておく必要がある。水と反応すれば水酸化物を与える。通常、1価の陽イオンとして化合物をつくる。炎色反応は青紫色である。
[鳥居泰男]
用途
金属セシウムは光照射によって電子を放射しやすいので光電管の材料として用いられる。質量数137(半減期30年)の放射性同位体は核分裂生成物の一つとして原子炉の中で生成され、核燃料再処理の副産物として得られるが、γ(ガンマ)線源、トレーサー、放射能標準として利用される。
[鳥居泰男]
人体への影響
セシウムはカリウムと化学的性質がよく似ている。飲食物、空気などから人体に入ったセシウム137は、カリウムと挙動をともにし、筋肉などに集まる。体外への排出の速度は大きいが、娘核のバリウム137(半減期2.6分)がγ線を放出するので、その影響は全身に及ぶ。とくに生殖器官に対する遺伝的影響が重大視されている。
[鳥居泰男]
セシウム(データノート)
せしうむでーたのーと
セシウム
元素記号 Cs
原子番号 55
原子量 132.9054
融点 28.40℃
沸点 678.4℃
比重 1.873(測定温度20℃)
結晶系 六方
元素存在度 宇宙 0.367(第60位)
(Si106個当りの原子数)
地殻 3ppm(第41位)
海水 0.4μg/dm3
化学辞典 第2版 「セシウム」の解説
セシウム
セシウム
caesium, cesium
Cs.原子番号55の元素.電子配置1s22s22p63s23p63d104s24p64d105s25p66s1の周期表1族元素.原子量132.91.安定同位体は 133Cs だけであるが,ほかに18種の放射性同位体が知られている.1860年R.W.E. Bunsen(ブンゼン)とG.R. Kirchhoffが鉱泉水の分光分析で美しい青色の発光スペクトル線を見いだし,ラテン語の青空色“cæsius”から元素名caesiumを提案した.1881年C. Setterbergが融解電解によりはじめて単離した.天然にはポルサイトとして,また,ほかのアルカリ金属資源に随伴して産出する.地殻中の存在度1 ppm.セシウム塩をカルシウム,アルミニウムなどと熱して還元してつくる.銀白色の軟らかい金属.体心立方格子構造.格子定数a = 0.605 nm.融点28.4 ℃,沸点678 ℃.密度1.876 g cm-3(20 ℃).炎色反応は青色.アルカリ金属のうち反応性はもっとも大きい.空気中でただちに酸化される.ハロゲン,水素と直接化合し,水とはげしく反応して水素と水酸化セシウムとを生じる.水銀とアマルガムをつくり,ほかの金属と合金をつくる.イオン化電位3.893 eV.全元素中最小でもっとも陽性が強い.光があたると電子を放出しやすい.つねに酸化数1のイオンとして塩をつくり,塩は構造,性質ともにカリウム塩に似ている.多くの塩は水に可溶.炭酸塩はエタノールに可溶でルビジウムと区別される.人体に有害である.アンチモンとの合金は光電管,ストロボ放電管に用いられる.137Cs はβ放出体でγ線源,トレーサー,放射能標準などに利用される.133Cs 原子の基底状態に属する二つの超微細エネルギー準位間の電子遷移に伴い放出されるマイクロ波の振動周期は,セシウム原子時計として時間の単位である秒の定義に用いられている.[CAS 7440-46-2]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「セシウム」の意味・わかりやすい解説
セシウム
→関連項目放射能汚染|ラムゼー
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「セシウム」の意味・わかりやすい解説
セシウム
caesium
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「セシウム」の解説
セシウム
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...



