翻訳|molybdenum
精選版 日本国語大辞典 「モリブデン」の意味・読み・例文・類語
モリブデン
- 〘 名詞 〙 ( [ドイツ語] Molybdän ) 金属元素の一つ。元素記号 Mo 原子番号四二。原子量九五・九四。銀白色の硬い金属で、輝水鉛鉱、水鉛鉱などとして産出。特殊鋼の合金材料や電子機器材料などに用いる。水鉛。〔稿本化学語彙(1900)〕
改訂新版 世界大百科事典 「モリブデン」の意味・わかりやすい解説
モリブデン
molybdenum
周期表第ⅥA族に属するクロム族元素の一つ。モリブデンという名称は,その原鉱である輝水鉛鉱MoS2(英名molybdenite)に由来する。古くギリシア語でmolybdosは鉛を意味し,鉛の鉱石特に方鉛鉱をラテン語でmolybdaenaと称したが,それに外観の似た黒色の石墨や輝水鉛鉱なども含めて呼ぶようになった。1778年,スウェーデンのK.W.シェーレは石墨と輝水鉛鉱を区別し,後者を硝酸で分解し,無色の酸化物MoO3を得て,これをterra molybdaenae(モリブデン土)あるいはterre du plomb d'eau(水鉛土)と名づけたが,その後そのもとの輝水鉛鉱をmolybdeniteというようになった。かつて鉛と考えられていたものがモリブデンに転化し,現在でも水鉛の語が用いられている。初めて酸化物を炭素で還元して単体金属をとり出したのは82年スウェーデンのイエルムP.J.Hjelm(1746-1813)で,同時にmolybdenumという名称を提案した。
比較的広く存在するが量はあまり多くない。主として輝水鉛鉱として産し,主産地はアメリカで,そのほかチリ,カナダ,中国,日本(島根県)などにも産する。銅鉱山から硫化銅鉱とともに産出されることが多く,したがって銅の市況によってモリブデンの生産量も左右される。古くはモリブデン鉛鉱PbMoO4なども原料鉱石として用いられたことがある。海水,動物の体液,土壌中にも少量ずつ分布している。
性質
焼結あるいは融解したものは銀白色金属。極低温から高温まで機構的に強い。弾性率は高く,熱伝導率は通常の耐熱合金の数倍大きい。線膨張率は小さい。熱すると酸素,塩素,硫黄,リン,炭素,ケイ素などと直接反応する。常温では空気に侵されないが,水蒸気と熱すると反応して酸化物となり,冷時徐々に青色の酸化物のモリブデン青(組成は明確でない)を生ずる。塩酸,希硫酸などとは煮沸しても反応しないが,熱濃硫酸,硝酸,王水には溶ける。アンモニア水には空気に触れているとパラモリブデン酸アンモニウム(NH4)6[Mo7O24]・4H2Oを生じて溶ける。
製法
製錬原料は輝水鉛鉱が主で,硫化モリブデンMoS2として0.5%程度含んでいる。銅と共存する場合にはさらに品位は低くなる。浮遊選鉱によって銅鉱物,脈石と分離され,MoS285%以上の精鉱とし,フェロアロイ,酸化モリブデン,金属モリブデンの原料とされる。精鉱は空気中で焼くとMoO3となり,600℃から昇華しはじめるので,融点(795℃)以下の温度で焼いてMoO3を昇華回収する。金属モリブデンはMoO3をさらに昇華法により精製し,アンモニアに溶かして不溶性物を分離し,液を蒸発してパラモリブデン酸アンモニウムとして析出させる。これを加熱分解し,さらに650~750℃で水素で還元して金属粉末とし,粉末を圧縮成形後2400℃前後の高温で焼結して金属とする。フェロモリブデンは粗MnO3をフェロシリコンおよびアルミニウムを還元剤としてテルミット法で還元するか,生石灰およびスクラップを配合して炭素で還元する。後者では高炭素(C5%)のものが得られる。
用途
日本刀にも少量含まれているが,鋼に少量加えることにより,焼入れ性,靱性(じんせい)を増し,強度を高めるなどの働きがあるので,工具鋼,高速度鋼,ステンレス系特殊鋼,耐熱鋼,高張力鋼などに用いられる。鉄鋼用にはフェロモリブデン(Mo65~70%),酸化モリブデンブリケット(Mo57%以上)の形で用いられる。金属モリブデンは超耐熱合金(スーパーアロイ),電球,電子管の陽極,グリッド,支持線などに,またコイル状タングステンの支持棒としても消費される。二硫化モリブデンは高速回転部の潤滑材に使用される。
執筆者:中原 勝儼+後藤 佐吉
生体とモリブデン
モリブデンは生体中に微量に存在するが,遊離状態での生理作用は不明で,おもに酵素の補欠因子として見いだされる。微生物では窒素固定菌類(根粒菌など)のニトロゲナーゼ,カビや大腸菌では硝酸塩を還元する硝酸レダクターゼなどの酵素に結合している。動物ではキサンチンオキシダーゼ,アルデヒドオキシダーゼなどの酵素に含まれる。植物ではモリブデンが欠乏すると葉の白化が起こる。
執筆者:柳田 充弘
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「モリブデン」の解説
モリブデン
モリブデン
molybdenum
Mo.原子番号42の元素.電子配置[Kr]4d55s1の周期表6族遷移金属元素.原子量95.94(2).天然に質量数92(14.77(31)%),94(9.23(10)%),95(15.90(9)%),96(16.68(1)%),97(9.56(5)%),98(24.19(26)%),100(9.67(20)%)の同位体が存在する.100Mo は半減期7.3×1018 y で二重β崩壊して 100Ru になる放射性核種.このほか,質量数83~115の放射性核種が知られている.1778年にC.W. Scheele(シェーレ)が,当時,鉛の鉱石と思われていた輝水鉛鉱(molybdenite)中に鉛のかわりに発見し,1781年にP-J. Hjelmが分離した.化学的に純粋な金属モリブデン(99.98%)は1895年になってはじめて,H. Moissan(モアッサン)によって電気炉中の炭素による還元で得られた.元素名は鉛を意味するギリシア語μολυβδο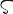 (molybdos)からScheeleが命名した.宇田川榕菴は天保8年(1837年)出版の「舎密開宗」で,莫列貌達紐母(モレイフターニウム)と記載している.
(molybdos)からScheeleが命名した.宇田川榕菴は天保8年(1837年)出版の「舎密開宗」で,莫列貌達紐母(モレイフターニウム)と記載している.
地殻中の存在度1000 ppm.おもな鉱物は,輝水鉛鉱MoS2であるが,黄鉛鉱PbMoO4,パウエル鉱Ca(Mo,W)O4などモリブデン酸塩鉱物としても産出する.世界の確認埋蔵量1900万t 中,中国44%,アメリカ28%,チリ13%,産出量(187千 t,2007年)はアメリカ31%,中国25%,チリ22% でともに世界の約8割を占める.わが国のおもな輸入先はチリ,メキシコ,カナダ,中国.わが国の需要の約90% が鉄鋼部門で消費される.産業上,きわめて重要なレアメタルとして,国家備蓄制度の対象鉱種の一つとなっている.製錬は,まずMoS2をMoO3の昇華温度以下の650 ℃ でばい焼して,工業用(85~90%)三酸化モリブデンMoO3に転換する.鋼合金用にはこのまま,あるいは鉄との合金フェロモリブデンの形で炉中に投入する.フェロモリブデンは電気炉でMoS2を炭素,鉄と還元するか,アルミニウム,鉄,フェロシリコンとテルミット法で還元すると得られる.化学的な用途には,工業用三酸化モリブデンを1200 ℃ 以上で昇華して高純度(99.95%)MoO3に精製後,アンモニア水に溶かしてモリブデン酸アンモニウム(NH4)2MoO4とする.金属は,高純度MoO3または(NH4)2MoO4を電気炉またはマッフル炉中で水素気流により還元すると得られる.粉末は灰色,銀白色の金属(体心立方格子).融点2617 ℃,沸点4612 ℃ できわめて高い.密度10.22 g cm-3(20 ℃).抵抗率5.2×10-8 Ω m.第一イオン化エネルギー7.099 eV.標準電極電位 Mo3+/Mo-0.2 V.0.915 K 以下で超伝導を示す.酸化数-2,0~6が知られているが,通常は1~6.化学的に不活性で,耐酸性がきわめて強く,フッ化水素酸,塩酸,希硫酸とは反応しない.濃硝酸とは反応するが,不動態が生成する.王水,熱濃硫酸,濃硝酸とフッ化水素酸の混合物に可溶.融解KNO3-NaOHまたはNa2O2のような酸化融解剤にはただちに侵される.アンモニア水には空気の存在下で溶ける.窒素とは反応しないが,リン,ヒ素,炭素,ケイ素,ホウ素とは赤熱状態で反応する.酸素,硫黄に対しては常温では安定であるが,赤熱状態では酸化されてMoO3,MoS2となる.フッ素とは室温でも反応してMoF6となる.塩素,臭素,ヨウ素とは赤熱状態で反応し,MoCl5,MoBr4,MoI2となる.
モリブデンは生物化学的に活性な遷移元素の一つで,ヒトにとって必須微量元素である.鋼に添加すると硬度および強度が増加するので,ほとんどすべての特殊鋼はモリブデンを含む.構造用合金鋼,高張力鋼,耐熱鋼板,合金工具鋼はMo含有量0.15~1.5重量%,ステンレス鋼,高速度鋼では0.5~9.5重量% 程度で,構造用合金鋼は機械部品(軸受,歯車,圧力容器,ボルトなど)に,高張力鋼は高い強度を要する航空機部品用材料,エンジン部品,自動車に,高速度鋼は工具や金型,耐熱鋼は構造用材,蒸気・ガスタービン,ボイラー,高温圧力容器・熱交換器に,ステンレス鋼は化学工業から家庭用器具まで使用される.石油精製(水素化脱硫)・石油化学用酸化触媒にも添加される.無機薬品としては,高温用潤滑剤の硫化モリブデンMoS2や塗料・顔料にも使われる.金属モリブデンは,照明器具,電子管陰極,電子レンジ用マグネトロンの部品に,IT関連でも携帯電話用などの半導体素子に使用される.わが国の需要の約90% は鉄鋼分野向けである.「モリブデン及びその化合物」はPRTR法・第一種指定化学物質で経口慢性毒性3,水質基準0.07 mg/L.[CAS 7439-98-7][別用語参照]モリブデン触媒
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
日本大百科全書(ニッポニカ) 「モリブデン」の意味・わかりやすい解説
モリブデン
もりぶでん
molybdenum
周期表第6族に属するクロム族元素の一つ。原子番号42、元素記号Mo。古代ギリシア・ローマのころから鉛のような輝きをもつ柔らかい鉱物をモリブドスmolybdosとよんでおり、鉛や黒鉛との区別が不明瞭(ふめいりょう)であったが、1778年にスウェーデンのシェーレによって独立の元素であることがわかり、その原鉱石モリブデナイトmolybdenite(輝水鉛鉱MoS2)からモリブデンと命名された。
地殻には広く存在するが、存在度は高くはない。輝水鉛鉱のほか、モリブデン鉛鉱PbMoO4が主要な鉱物である。海水、動物の体液、土壌にも少量ではあるが含まれる。
三酸化モリブデンMoO3を900~1000℃で水素還元すると灰色の粉末として得られる。融解あるいは焼結したものは白色光沢をもつ。酸化モリブデンをアンモニア水に溶かして得られるパラモリブデン酸アンモニウムを焼いて三酸化モリブデンとし、これを昇華精製したものを原料とすると高純度の金属モリブデンを得る。
金属モリブデンは広い温度範囲にわたって機械的強度に富み、ステンレス合金、耐火合金などに使用され、モリブデン化合物は電子材料、顔料、触媒、潤滑剤などに使われる。酸化数+Ⅱから+Ⅵまでの各酸化数の化合物が多く知られている。
[岩本振武]
生体とモリブデン
生体に必要な数少ない重金属の一つである。モリブデンが植物の生育に不可欠な要素であることは古くから知られていたが、動物にとって必須(ひっす)かどうかははっきりしていなかった。近年、動物でも数種類の酵素の活性発現に必要なことがわかり、人でも微量必須元素とされるようになったが、ふつうの食事で十分摂取できるので、欠乏症の心配は事実上ない。植物では窒素代謝に必要な元素であり、微量栄養元素の一つ。窒素固定細菌であるアゾトバクターや、マメ科植物の根粒菌の窒素固定にも不可欠である。微生物、植物の硝酸還元酵素(ニトレートレダクターゼ)の活性を発現するために必須であり、そのほかにも細菌のギ酸脱水素酵素(ホルメートデヒドロゲナーゼ)や窒素固定におけるニトロゲナーゼなど、いくつかの酵素がモリブデンを要求することが知られている。
[笠井献一]
モリブデン(データノート)
もりぶでんでーたのーと
モリブデン
元素記号 Mo
原子番号 42
原子量 95.96
融点 2620℃
沸点 4660℃
比重 10.22(20℃)
結晶系 立方
元素存在度 宇宙 2.52(第45位)
(Si106個当りの原子数)
地殻 1.5ppm(第52位)
海水 10μg/dm3
百科事典マイペディア 「モリブデン」の意味・わかりやすい解説
モリブデン
→関連項目クロム・モリブデン鋼|耐候鋼|耐熱鋼|ニッケル・クロム鋼|ハステロイ
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「モリブデン」の意味・わかりやすい解説
モリブデン
molybdenum
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
漢方薬・生薬・栄養成分がわかる事典 「モリブデン」の解説
モリブデン【Molybdan】
栄養・生化学辞典 「モリブデン」の解説
モリブデン
世界大百科事典(旧版)内のモリブデンの言及
【高融点金属材料】より
…融点の高い金属材料,とくにタングステン,タンタル,モリブデン,ニオブと,これらの合金をさすことが多い。元素を融点の順に並べてみると,タングステン(3387℃),レニウム(3180℃),タンタル(2996℃),オスミウム(2700℃),モリブデン(2610℃),ニオブ(2468℃),イリジウム(2447℃),ホウ素(2300℃),ルテニウム(2250℃),ハフニウム(2150℃)となる。…
※「モリブデン」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...



