精選版 日本国語大辞典 「有機金属化合物」の意味・読み・例文・類語
ゆうききんぞく‐かごうぶつイウキキンゾククヮガフブツ【有機金属化合物】
- 〘 名詞 〙 各種の金属元素を含む有機化合物。特に金属原子が炭素原子と直接結合したものをさす場合が多い。有機合成化学における触媒、あるいは農薬などに利用される。
改訂新版 世界大百科事典 「有機金属化合物」の意味・わかりやすい解説
有機金属化合物 (ゆうききんぞくかごうぶつ)
organometallic compound
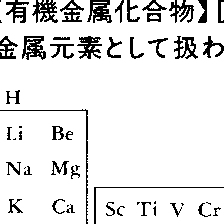
古くは金属を含む有機化合物を一般にこのように呼んでいたが,最近では金属原子と炭素原子の結合を含む化合物をいうのが普通である。したがって金属原子と直接結合する相手原子が酸素である有機酸の金属塩や金属のアルコキシドなどは含めないのが正しいが,便宜上アルコキシドなどを含めて取り扱うこともある。また金属-炭素結合を含みはするがシアノ錯体は含めないのが普通である。さらに金属といってもどこまでの元素を金属元素とするかが問題であるが,かなり広い意味にとって,たとえば図1に示される枠内の元素,すなわち普通には非金属元素に分類されるケイ素Si,リンP,ヒ素As,セレンSe,テルルTeなどをも含めて考えることが多い。したがって化合物中で,通常の無機化合物および有機化合物を除いた広い領域の化合物ということができる。
歴史
有機金属化合物が文献に登場してくるのは19世紀半ばころからである。もちろん当時無機化合物や有機化合物という厳密な意味での概念があったわけではないが,有機金属化合物として最も古いと思われるものはツァイゼ塩KPtCl3(C2H4)・H2Oである。これは1827年デンマークの薬学者ツァイゼWilliam Christopher Zeise(1789-1847)が塩化白金(Ⅳ)水溶液をエチルアルコールで処理してから塩化カリウムを加えて得た淡黄色結晶であるが,20世紀も半ばになってエチレンのπ電子が白金原子に配位したπ錯体であることがわかった。19世紀半ばは有機化学が勃興してくる時代であるが,そのなかで基の理論が成立していく過程で,1841年ドイツのR.W.ブンゼンがカコジルAs2(CH3)4をつくったのをはじめとして,49年イギリスのE.フランクランドがジエチル亜鉛Zn(C2H5)2を発見している。そしてこの亜鉛化合物は有機合成にきわめて有用なことから,その後多くのアルキル亜鉛化合物がつくられているし,同じようにして69年オットーR.Ottoがアリール水銀をつくっている。しかしなんといっても有機金属化合物の歴史のなかで重要なものの一つはグリニャール試薬である。これは99年フランスのバルビエPhilippe Antoine Barbier(1848-1922)によって初めてつくられた。バルビエはメチル基を有機化合物に導入する反応で,亜鉛に代わる金属を探していてこれを発見した(亜鉛はヨウ化メチルを反応しやすくするが,有機亜鉛化合物は空気にふれると爆発しやすい。一般にアルキル有機金属は不安定で,危険である。先のブンゼンもシアン化カコジルの爆発で右眼を失明している)。すなわちバルビエはケトン-ハロゲン化アルキル-マグネシウムからのアルコール合成を行ったのであるが,ついで彼は自分の弟子F.A.V.グリニャールにこれを伝え,グリニャールはこの反応を詳しく研究し,グリニャール試薬RMgXとして知られるようになった。グリニャール試薬は,亜鉛や水銀の化合物と比べて取扱いが簡単で,しかも反応性に富むため,それ以降の有機合成化学の進歩に大きな貢献をした。
一方,遷移金属の化合物では,まず金属カルボニルがつくられた。1881年イギリスのモントLudwig Mond(1839-1909)がニッケルカルボニルNi(CO)4を,91年フランスのM.P.E.ベルトロが鉄カルボニルFe(CO)5をつくっている。ニッケルカルボニルはモンド法(1892)としてニッケル精錬に使われ,さらに多くの金属カルボニルがつくられ,20世紀になってからのレッペ反応で工業的に多く使われるようになったのである。このことから考えると19世紀終りころが有機金属化合物の化学の創成期であるといってよいであろう。さらに1904年にイギリスのキッピングF.S.Kippingは有機ケイ素化合物を開拓して今日のシリコーン工業の基礎をつくり,26年にはクラウスC.Krausが四エチル鉛Pb(C2H5)4の工業的製法を完成してガソリンのアンチノック剤として大量生産がされるようになったし,またポリ塩化ビニルの安定剤として有機スズ化合物が工業的に生産されるようになった。そしてこれらと前後してリン,ヒ素,アンチモン,ビスマスなどの有機金属化合物が研究され,殺虫,殺菌作用のため,医薬,農薬として広く用いられるようになった。30年にはドイツのK.チーグラーが有機リチウム化合物を直接合成して,これがグリニャール試薬をもしのぐ反応性のあることを示して有機合成上で大きな役割を果たすことになった。このようにして徐々に発展してきたこの分野でまさに画期的なできごとは,50年イギリスのキーリーT.Kealyらにより発見されたフェロセン[Fe(C5H5)2]と,55年ドイツのフィッシャーE.O.Fischerのつくったビス(ベンゼン)クロム[Cr(C6H6)2]である。これらは,まったくこれまでに知られていなかったタイプの結合形式をもったサンドイッチ化合物であった(ビス(ベンゼン)クロムは,実は1919年ドイツのハインF.Heinがつくった謎の化合物ポリフェニルクロム化合物と同じタイプのものであることがわかった)。その後ほとんどすべての遷移金属シクロペンタジエニル化合物が合成されるようになり,それまで金属カルボニル以外は明確に単離されたものが少なかった有機遷移金属化合物の研究が,大発展をすることになったのである。
これと同じころ,1953年ドイツのチーグラーがチーグラー触媒(TiCl4-Al(CH3)3系)を発見している。チーグラー触媒がエチレンを常温・常圧でも重合させることができるという発見は,工業的にも学術的にも非常に大きな発見であったが,チタンTiに対するオレフィンのπ電子による配位と,これに対する隣の配位座にあるアルキルの挿入反応であると考えられた。このモデルから遷移金属触媒の反応機構についての基礎的研究が大いに進展し,また工業的にも大きな成果をもたらすことにもなった。ここに有機金属化合物の化学の今日の大発展に至る基礎が築かれたといってよいであろう。
結合と構造
金属原子と炭素原子との間の結合には各種の形式のものがあり,通常の無機および有機化合物にはみられないような特殊なものもあって,そのため構造もまた特異なものを生ずることがある。一般に結合は共有性が強く,すべての金属元素でσ結合による化合物が存在し,これは通常の共有結合と本質的には違わない。ただし先の図1でⅠのグループの元素では,金属より炭素の電気陰性度がかなり大きく,炭素のほうが負に分極しており,その程度の強いものではかなりな程度のイオン結合性をもつことになる。したがってこれらの場合,金属に結合したアルキル基やアリール基などはカルボアニオンのような性質を示すことになる。これに対しⅢのグループの元素は比較的普通のσ結合をつくることが多いが,Ⅱのグループすなわち遷移金属では,σ結合にも金属のd軌道が関与しているし,さらにdπ軌道が存在するため,π結合生成がごく普通にみられる。
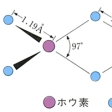
σ結合では形式的には図2-aのようであり,たとえば(C2H5)MgBr・2(C2H5)2Oでは,Mgを中心にした四面体形4配位で,Mg-C2H5の結合は図2-bにみられるように結合距離2.16Åで,ごく普通の共有結合と考えられる(共有結合半径の和は2.17Å)。(C6H5)MgBr・2(C2H5)2Oでも同じような構造でMg-C6H5の結合距離は2.2Åである。同じσ結合でも少し特殊な結合には多中心結合がある。たとえばホウ素やベリリウム,アルミニウムなどで三中心結合,白金で四中心結合などがみられる。先にあげたチーグラー触媒の一つの成分であるAl2(CH3)6では四面体形4配位のAlのまわりは図2-cのようになっていて,Al-C-Alの三中心2電子結合である。もう一つのσ結合での特殊な例は図2-dのようなメタラサイクル形式のものである。σ結合による4員環キレート構造はきわめて反応性に富むものであり,オレフィンメタシス反応の中間体とみなされている。
π結合には各種の形式のものがある。最も典型的なものの一つは,たとえばツァイゼ塩KPtCl3(C2H4)・H2OにおけるPt-C2H4の結合である。Ptのあいているd軌道(PtⅡは5d8構造で,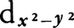 軌道があいている)にC2H4のπ結合によって結合軌道に入っている電子すなわちπ電子が配位している。したがって通常の配位座には配位原子が存在していないことになる。このようなπ電子の配位している錯体をπ錯体といっている。エチレンの場合には,このπ電子の配位だけではなく,さらにPtの満たされたdπ軌道(図3ではdxz軌道)の電子が,エチレンのあいている反結合性π軌道(図3の影をつけていない軌道)に供与されて一つのπ結合性配位結合をつくる(このような結合を逆供与結合あるいは逆配位結合といっている)ので,Pt-C2H4間の結合は二重結合ということになる。エチレンと同じ二重結合がキレート構造になっているものもある(図4右)。三重結合でも同じことでπ錯体をつくる。三重結合においては二つのπ結合はたがいに直交しているので,二つの金属原子に対して橋架け構造となる場合もある(図5)。π電子が2原子ではなく3原子の上に非局在化してアリル系になっている場合は,少し様子が違うが(図6),これは有機合成に際して重要なものと考えられている。たとえばPd2(C3H5)2Cl2では図7のようで,Pdは平面形4配位の二つの結合軌道をC3H5のπ電子が占めると考えることもできる。
軌道があいている)にC2H4のπ結合によって結合軌道に入っている電子すなわちπ電子が配位している。したがって通常の配位座には配位原子が存在していないことになる。このようなπ電子の配位している錯体をπ錯体といっている。エチレンの場合には,このπ電子の配位だけではなく,さらにPtの満たされたdπ軌道(図3ではdxz軌道)の電子が,エチレンのあいている反結合性π軌道(図3の影をつけていない軌道)に供与されて一つのπ結合性配位結合をつくる(このような結合を逆供与結合あるいは逆配位結合といっている)ので,Pt-C2H4間の結合は二重結合ということになる。エチレンと同じ二重結合がキレート構造になっているものもある(図4右)。三重結合でも同じことでπ錯体をつくる。三重結合においては二つのπ結合はたがいに直交しているので,二つの金属原子に対して橋架け構造となる場合もある(図5)。π電子が2原子ではなく3原子の上に非局在化してアリル系になっている場合は,少し様子が違うが(図6),これは有機合成に際して重要なものと考えられている。たとえばPd2(C3H5)2Cl2では図7のようで,Pdは平面形4配位の二つの結合軌道をC3H5のπ電子が占めると考えることもできる。
π結合には金属原子との間の直接のπ結合もある。図8のような場合であって,通常非常に不安定なカルベンやカルビンが金属に結合すると,かなり安定な形でとり出すこともできる。これと似ているが少し違うのはカルボニルやイソニトリルの配位した場合である。一酸化炭素は,:C≡Oの孤立電子対が金属原子に配位するが,金属原子に満たされたdπ軌道があるときは,先のエチレンの配位の場合と同じように逆供与によってπ結合をつくり,結果的に二重結合となる。イソニトリルでも同じである(図9)。
これらに対し,フェロセンやビス(ベンゼン)クロムなどにみられる結合は,非局在化している環状共役二重結合系のπ電子が金属原子に配位しているのだと考えれば,エチレンなどの場合と同じであるが,安定性がきわめて高いことからいってもサンドイッチ構造は特異な結合と構造であるといえる。その代表的なものはFe(C5H5)2,Cr(C6H6)2である。フェロセンなどのような2枚のシクロペンタジエニル環に金属原子が挟まれたもののほかに,1枚のシクロペンタジエニル環に一つの金属原子がのったIn(C5H5)や,3枚のシクロペンタジエニル環に挟まれたもの,あるいは最近注目を集めているベンゼンクロム錯体(ベンゼンとヘキサカルボニルクロムCr(CO)6の混合物を常圧で加熱還流して合成される)などもある。以上のようなエチレン,アリル,シクロペンタジエニル環,ベンゼン環などπ電子が関係しているすべての原子が中心原子に結合している構造を表示するときはηという記号をつける。たとえば[Fe(C5H5)2]はビス(η-シクロペンタジエニル)鉄(Ⅱ)と書く。ηはイータまたはハプトと読む。
有機金属化合物の一つであるホスフィンやアルシンなどが配位子になるときは,また特異な性質の錯体をつくることが多い。たとえばリンPやヒ素Asにはあいているdπ軌道があるため,d電子密度が大きく,満たされたdπ軌道をもつ金属原子に配位すると,通常のσ配位結合のほかに,先に説明したのと同じような逆配位π結合をつくって二重結合となるためである。これらはその特異な反応と広い応用面によって多くの研究がなされている。たとえばバスカ錯体と呼ばれる[IrⅠCl(CO)(PPh3)2]やウィルキンソン錯体と呼ばれる[RhⅠCl(PPh3)3]などがある。バスカ錯体は平面形4配位錯体であるが,水素,酸素,窒素,ハロゲン化水素などの二原子分子との特異な反応性が知られている。たとえば水素では,H2が酸化的付加反応をし,IrⅠの平面形4配位がIrⅢの八面体形6配位錯体となるものとされている(式(1))。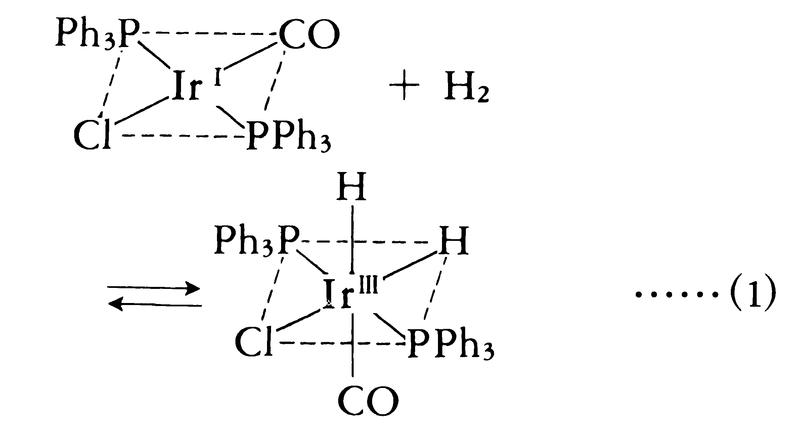
これは酸素や塩化水素でも同じである。このことはたとえば水素錯体では,水素分子を活性化しているとも考えられるが,事実,均一系水素添加触媒として有効であることが見いだされている。同じような錯体で窒素分子を配位した化合物も数多くつくられているが,このことはきわめて興味ある事実に導くことになる。すなわちこれらの錯体を利用しての温和な条件下での窒素固定がなされることである。ウィルキンソン錯体はひずんだ平面形4配位錯体で,きわめて高い活性をもった均一系触媒として,これまでにない特徴をもっている。すなわち配位的に不飽和であり,しかも配位子のホスフィンの一つが解離しやすいために活性で,水素分子,酸素分子その他を配位させて活性化させやすいためで,水素添加,酸化,付加,カルボニル化,脱カルボニル化その他の反応にきわめて広く用いられる。
性質
一般に有機金属化合物は非常に反応性が高く,空気中で自然発火して燃えつきてしまうものも多い。しかし,真空中では高温に加熱しても安定なものもある。たとえば,アルキルリチウムは空気中で燃えつきてしまうが,真空中ではかなり高温でも安定である。この安定性は金属の種類によって大きく変化する。
テトラメチルシラン(CH3)4Siは空気中でも安定で,通常の条件下では特別の配慮なく取り扱うことができる。金属によっては熱にきわめて不安定な有機金属化合物を形成する。たとえば,メチル銀CH3Agは-40℃で分解してしまう。空気にふれると自然発火する有機金属化合物としては,とくに周期表のⅢ族(B,Al,Ga,In,Tl),Ⅱ族(Be,Mg,Zn,Cd)などの電子受容体元素の低級アルキル化合物,およびアルカリ金属(Li,Na,K,Rb,Cs),アルカリ土類金属(Ca,Sr,Ba)のアルキル化合物がある。高級アルキルおよび芳香族化合物では自然発火性は弱くなっている。しかし自然発火性または熱不安定性と化学反応性との間には,はっきりした関係はない。
すなわち,熱に不安定だからといって化学反応性が高いとは限らない。たとえば,メチル銀は熱的に不安定であるが,反応性はむしろ低いことが知られている。有機金属化合物の反応形式は主として次の二つである。(1)多重結合(C=O,C=N,C≡N,C=C,C≡C)への求核的付加反応(式(2))。(2)C-HまたはC-X結合における水素HまたはハロゲンXと金属との交換反応(式(3)(4))。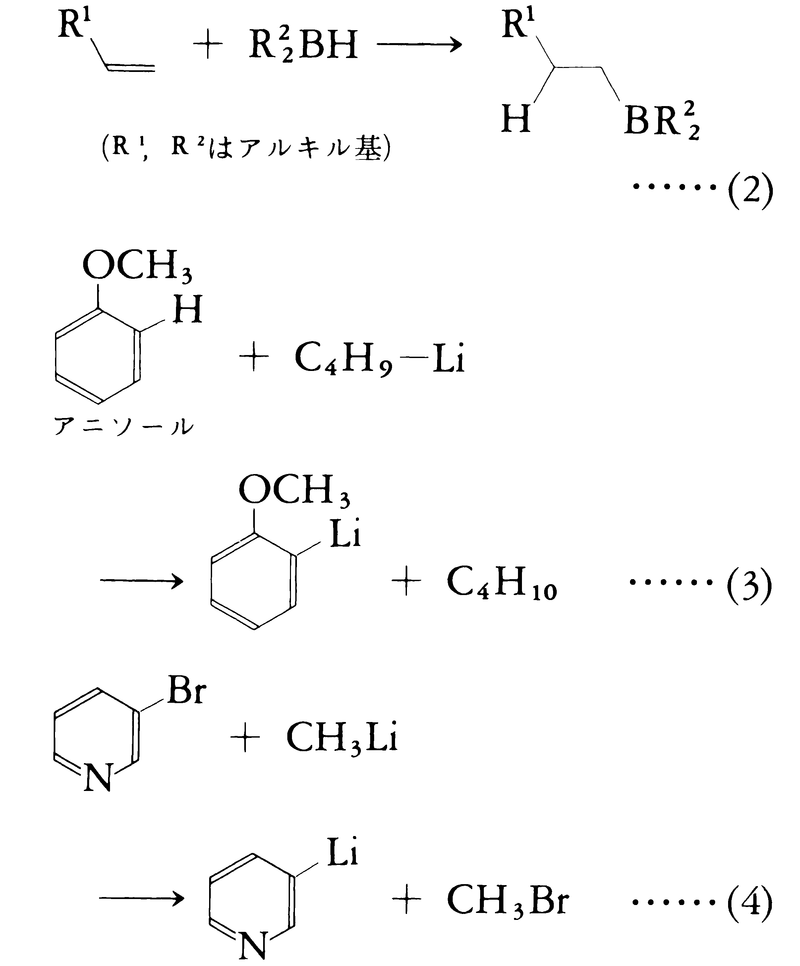
式(2)に示される形式の反応として,カルボニル基の還元反応,グリニャール反応,ヒドロボレーション(ヒドロホウ素化),ヒドロシリル化などがあげられる。ヒドロボレーションはホウ素の水素化物がC=CおよびC≡C結合に付加する反応で,アメリカのブラウンH.C.Brownによって開発された。式(3)に示すタイプの反応は有機金属化合物の合成に用いられる有用な反応であるが,現在のところ有機リチウム化合物に限られている。
有機金属化合物の合成法
代表的な合成法として次の二つがあげられる。
(1)置換反応による方法 末端アルキン,シクロペンタジエンなど酸性水素を有する化合物は金属と反応させると水素を発生して対応する有機金属化合物を与える(式(5)(6))。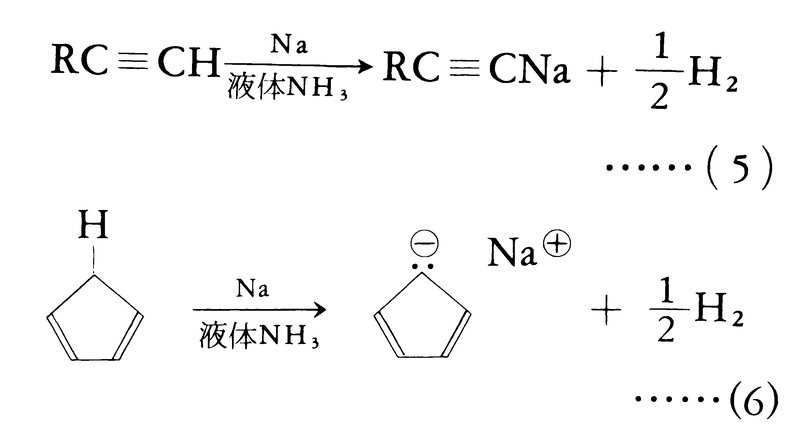
フェロセンも同様に,シクロペンタジエンに金属鉄を高温で作用させて得られる。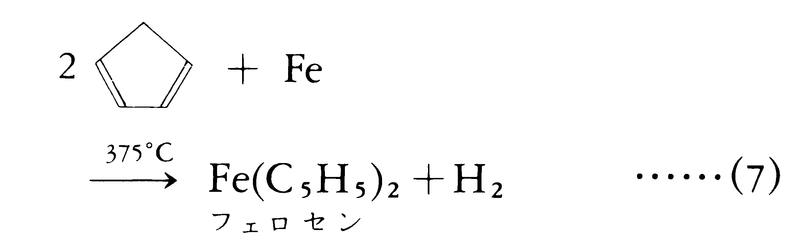
ブチルリチウムやメチルリチウムなどの有機合成に重要な有機金属化合物は,対応するハロゲン化アルキルにエーテル溶媒中で金属リチウムを作用させて得られる(式(8))。
RBr+2Li─→RLi+LiBr ……(8)
グリニャール試薬や亜鉛化合物も同様の方法で合成される(式(9)(10))。
RBr+Mg─→RMgBr ……(9)
2LI+2Zn─→R2Zn+ZnI2 ……(10)
金属-金属置換反応による合成法もよく用いられる。例を式(11)および(12)に示す。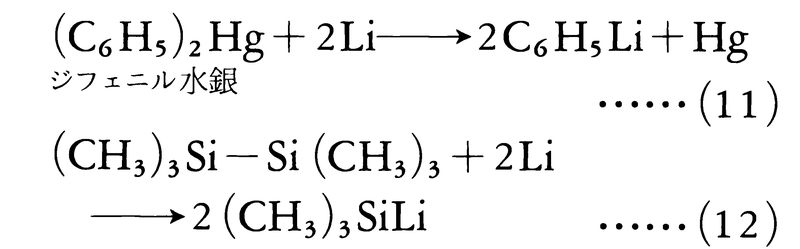
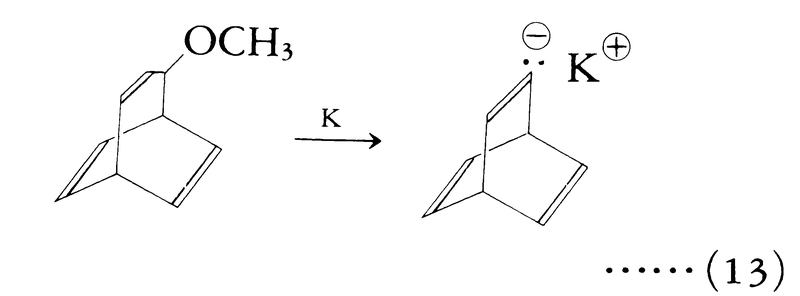
有機金属による金属-水素または金属-ハロゲン交換反応も合成法としてよく使われる。有機金属としては,アルキルリチウムが通常使われる(式(3)(4))。エーテルと金属との反応でも有機金属化合物が合成される(式(13))。
金属-ハロゲン交換反応は,パラジウムのような遷移金属にも適用される(式(14))。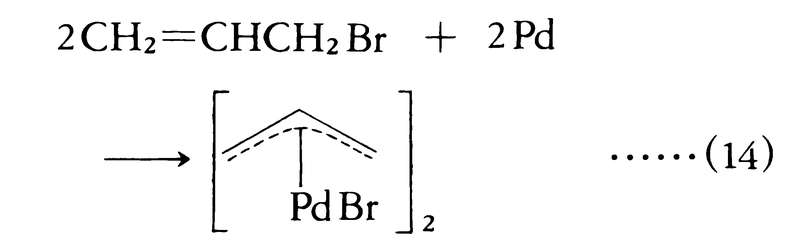
式(14)に示すパラジウム化合物はパラジウムのπ-アリル錯体と呼ばれ,二量体として存在する。これは有機合成上重要な中間体となっている。
(2)付加反応による有機金属化合物の合成 多重結合,とくにC=C,C≡Cなどの結合に対して多くの有機金属化合物や金属水素化物は付加反応を行うことが知られており,これが重要な有機金属化合物の合成法となっている。Li,Na,Be,Mg,B,Alなどの水素化物は式(15)に従って,C=C結合に対してハイドロメタレーションなる反応を行う。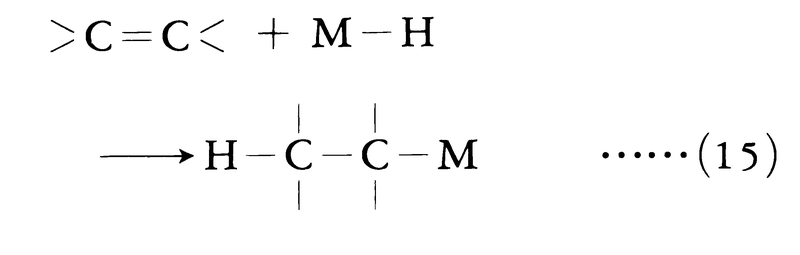
M=ホウ素Bの場合,式(2)に示すように,反マルコフニコフ的にヒドロボレーションが起こり,この反応は合成上非常に重要である。ⅠA族およびⅡA族の金属水素化物では,この反応は一般的に重要ではなく,合成的価値はほとんど見いだされていない。Bと同じくⅢA族に属するアルミニウムAlの場合,工業的に重要な反応であり,トリエチルアルミニウムは金属アルミニウムと水素との反応によりジエチルアルミニウムヒドリドを生成するが(式(16)),これはアルキンに付加反応を行う(式(17))。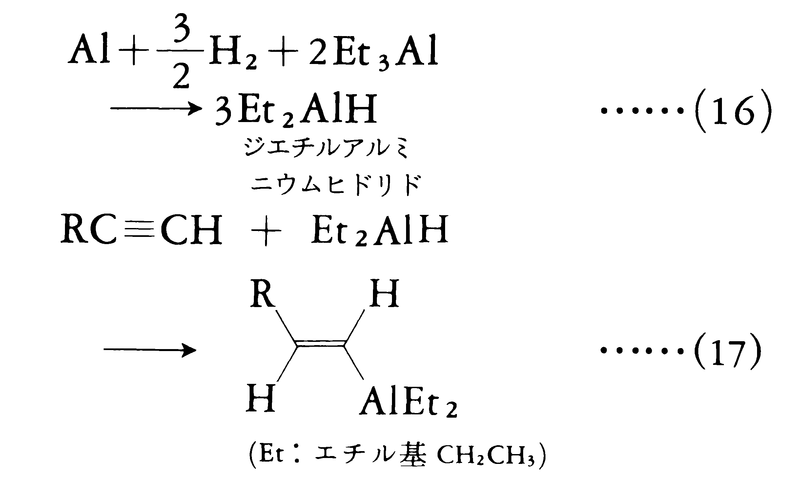
この反応で生成するアルケニルアルミニウムも有機合成上重要な中間体であり,現在もその利用について活発な研究が進められている。ⅣA族元素の水素化物では,付加反応に遷移金属触媒が使われる。たとえばヒドロシリル化反応では,式(18)に示すように,トリメチルシリルヒドリドのアルキンへの付加反応に塩化白金酸が触媒として使われる。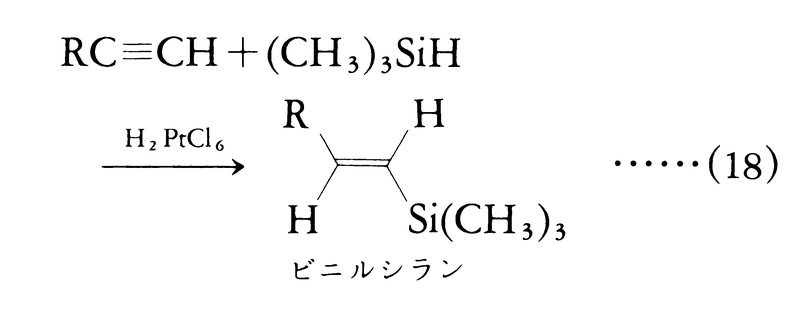
この反応の立体化学はシス付加で進行する経路が主となることが知られている。ここに生成するケイ素化合物をビニルシランと呼び,精密有機合成の中間体として重要。ゲルマニウムの水素化物も同様にハイドロメタレーションを行う(式(19))。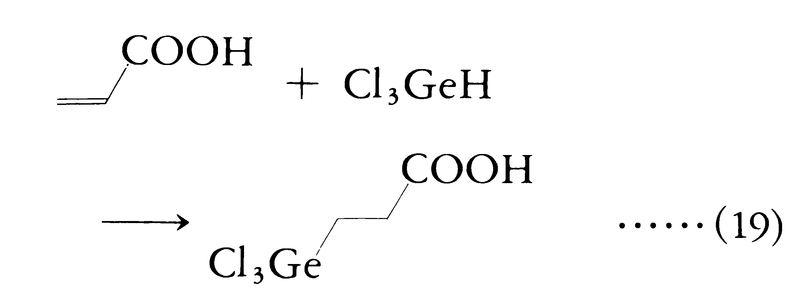
ハイドロメタレーションと同様に重要な反応としてカルボメタレーションがある。これは金属-炭素結合と同時に炭素-炭素結合を生成する反応で,主としてC=CまたはC≡C結合への付加反応に対して用いる。現在のところ,このような反応はわずかしか知られていないが,この反応の開発が日本を中心として各国で活発に進められている。一例として,カルボアルミネーションの例を式(20)に示す。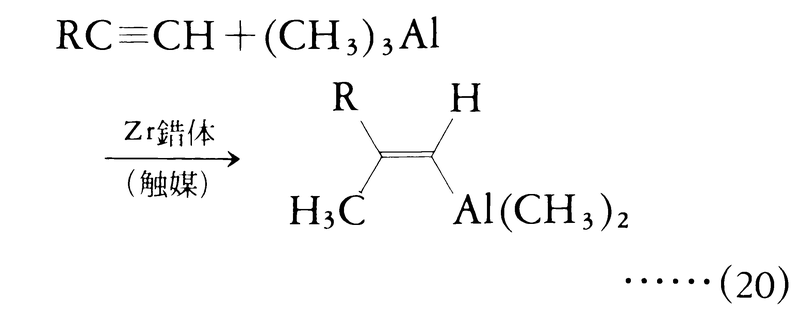
この反応ではジルコニウムZrのシクロペンタジエニル錯体という複雑な化合物を触媒として用いている。タリウムTl,水銀Hg,セレンSeなどの化合物も不飽和結合に付加反応を行う(式(21)(22)(23))。これらの場合には触媒は不要である。有機水銀化合物は強い毒性が認められるので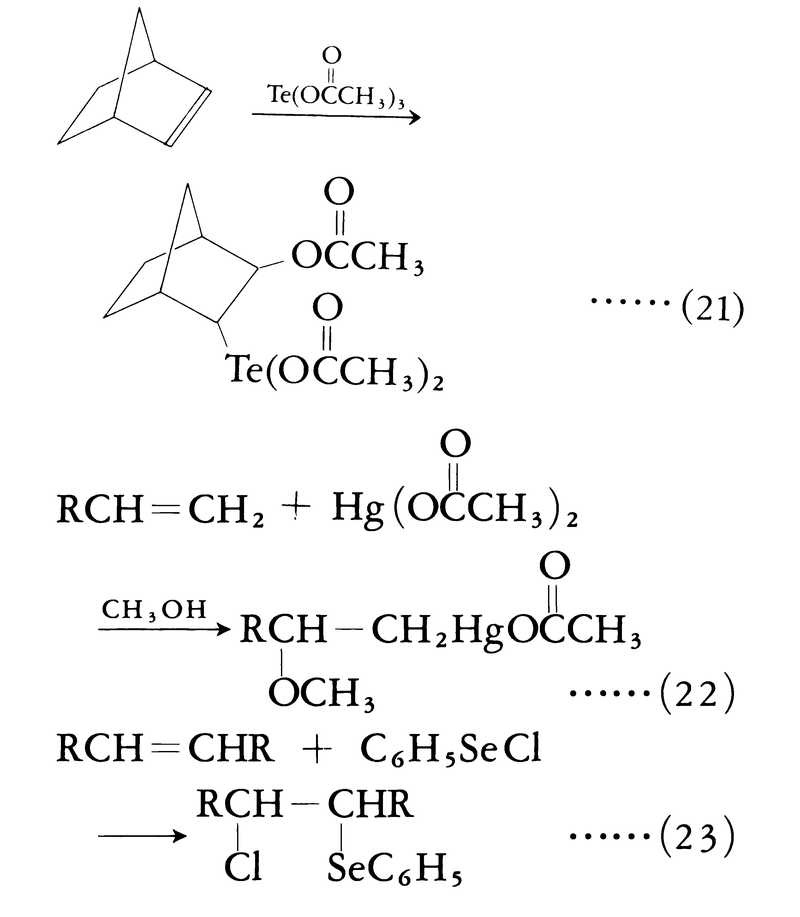
現在ではほとんど有機合成には用いられないが,有機セレン化合物はセレンの制癌作用,有機合成上の有用性の二つの観点から,現在日本とアメリカを中心に活発な研究が進められている。正確には付加反応ではないが,ベンゼン,ブタジエンなどのπ電子系を有する有機化合物は各種の遷移金属(Cr,Mn,Fe,Co,Ni,Mo,Rh,Pdなど)に配位して錯体をつくる。ベンゼンクロム錯体(図10),ブタジエン鉄カルボニル錯体(図11)などは比較的安定である。この種の錯体で興味深い例として,シクロブタジエン鉄カルボニル錯体(図12)がある。シクロブタジエンは反芳香族的で-200℃でも不安定で,スペクトル的にしか確認されていないが,鉄カルボニルと錯体をつくると安定に単離される。
展望
有機金属化学は,有機化学の分野としては比較的新しく,今後の発展が期待される分野である。従来の有機化学反応では不可能であったタイプの反応が,有機金属化合物を使うことによってきわめて簡単に進行したり,従来複雑な工程によって合成されていた化合物でも,有機金属化合物を用いることで比較的簡単につくれる。触媒作用を有する有機金属化合物も多数知られており,省エネルギーや環境保護の観点からも有機金属化学の発展に期待が寄せられている。世界的にみると,日本はアメリカと並んでこの分野では指導的立場にあり,研究者数もしだいに増えている。
→グリニャール試薬 →チーグラー触媒
執筆者:中原 勝儼+友田 修司
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「有機金属化合物」の意味・わかりやすい解説
有機金属化合物
ゆうききんぞくかごうぶつ
organometallic compound
有機化合物のなかで炭素‐金属原子の直接結合をもつものの総称。また、炭素‐金属結合をもたないが水素‐金属結合をもつ錯体(ヒドリド錯体という)を含めることもある。有機化合物中の酸素、窒素、リン原子が金属に結合している場合は含めない。これらはカルボン酸塩やアルコキシドであり、また、エチレンジアミンやトリフェニルホスフィンなどを配位子とする金属錯体も有機金属化合物には含めない。ここで金属原子とは周期表の薄青色で示した典型元素と遷移金属元素をいう。また、一般には薄赤色で示した金属性の少ない元素(半金属、セミメタル、あるいはメタロイドともよばれる)を含める。
多くの場合、有機金属化合物は不安定であり、水や空気との接触で発火したり分解する。また、炭素‐金属結合は反応性に富んでおり、この結合の間に炭酸ガス、一酸化炭素、オレフィン、ジエン、アセチレン、酸素、水素などが挿入されるので、有機合成の中間体や触媒として工業的にも利用価値の高いものがある。たとえば、マグネシウム化合物の一種はグリニャール試薬として、また、アルミニウム化合物の一つであるトリエチルアルミニウムはツィーグラー触媒として重要な役割を果たしている。そのほか、金属を含む有機化合物が医薬や農薬として用いられている例も少なくないが、金属化合物が原因と思われる中毒問題が話題になったこともあり、取扱いは十分注意する必要がある。
[西山幸三郎]
合成法
金属元素の数が多いことからもその合成法は非常に多岐にわたっており、とくに遷移金属化合物の合成法は多様である。次に合成法の代表例を示す。
(1)直接法 金属と有機ハロゲン化合物の反応。
M+RX→RMX
(M=金属、R=水素あるいはアルキル、アリール基など、X=ハロゲン)
代表例は有機マグネシウム化合物(グリニャール試薬)の合成である。また、有機亜鉛化合物も同様に合成され、β‐オキシ酸エステルを生成するレフォルマツスキー反応などの試薬として利用されている。有機ケイ素化合物の主要な合成法もこの反応である。
(2)間接法 別の合成しやすい方法で合成した有機金属化合物と、金属あるいは金属ハロゲン化物との反応。
MR+M′→M′R+M
(M′=金属あるいは金属ハロゲン化物)
たとえば、アルキルカドミウム化合物などの合成である。この合成法は有機遷移金属錯体の合成にもしばしば用いられる。
(3)金属‐水素あるいは金属‐炭素結合と不飽和結合の反応(付加反応)。
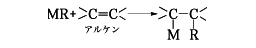
代表例はヒドロボレーション反応や、ツィーグラー‐ナッタ法の中間体生成反応、ブチルリチウムとエチレンの高圧反応でポリエチレンを生成する際の中間体などである。また、金属‐炭素結合のみならず、金属‐酸素、金属‐窒素、金属‐リン結合なども不飽和結合に付加して有機金属化合物を与える。
(4)活性水素をもつ有機化合物と、金属あるいは金属ハロゲン化物の反応(置換反応)。
M+nRH→MRn
(M=金属あるいは金属ハロゲン化物)
アルカリ金属の反応やフェロセンの合成などがこれに入る。
[西山幸三郎]
構造と性質
有機金属化合物の構造と性質を知ることは、それを活用するためにも重要である。金属‐炭素結合の性質は配位子や金属の種類によって異なる。また、典型金属元素化合物と遷移金属元素化合物とでもその構造と性質は異なる。以下、各結合様式により分類した。
[西山幸三郎]
典型金属元素化合物
これらの化合物は、共有結合とイオン結合を有するものに大別されるが、その大まかな目安としては、金属の電気陰性度が役だつが、有機基の性質によっても結合状態の変わることもある。ここでは共有結合を有する多中心型を区別して3種類に分類した。
(1)イオン結合 電気的に陽性なアルカリ金属とつくる結合はイオン的である。したがって、アルカリ金属の有機金属化合物は炭化水素溶媒には不溶で、酸素や水に対してきわめて反応性が高い。たとえば、シクロペンタジエンのナトリウム塩などがそうである。
(2)共有結合 周期表の右のほうにある元素は電気陰性度も比較的高く、有機化合物的な性質を示すようになる。たとえば、多くの有機溶媒に溶け、かなりの揮発性を示すようになる。13~16族の金属はこれに含まれる。たとえば有機ケイ素化合物などである。
(3)多中心結合 Li、Be、Mg、B、Alなどいくつかの金属の化合物は、単量体としての安定度が低いため、多くの場合会合体として存在する。この場合は、配位子のアルキル基や水素が、橋かけの役割を果たす。たとえば、ジボランなどがその例である。
[西山幸三郎]
遷移金属元素化合物
これらの化合物の構造は、その金属の種類の多さや配位子によって多様である。しかし、大まかにはσ(シグマ)結合を形成しているものと、π(パイ)結合を形成しているものに分類される。
(1)σ結合 σ結合をもつ遷移金属化合物は不安定なものが多いが、一酸化炭素や三級ホスフィンなどの安定化配位子を用いると比較的安定になるものもある。たとえばTi(CH3)4はマイナス50℃で分解するが、ビピリジルを加えたTi(CH3)4(bipy)2は0℃まで分解しない。
(2)π結合 多くの遷移金属元素は比較的安定なπ錯体を形成する。この場合、配位子のπ電子の数や金属の種類によりいろいろなπ錯体をつくる。たとえば、オレフィンπ錯体、πアリル錯体、シクロペンタジエニル錯体、η(エータ)アレーン錯体などである。π錯体の表示法でηは結合に関与している炭素数を示す。
[西山幸三郎]
用途
アルキルリチウムやグリニャール試薬、水素化スズ化合物による還元など、有機合成にとって重要な試剤が多い。また、遷移金属錯体の多くは穏和な条件下での選択的合成の触媒として広く用いられている。鉛化合物はガソリンのアンチノック剤として使用されていたが、現在は公害問題などのため、この用途では用いられない。ケイ素化合物はシリコーンとして用途は広い。それ以外でも多くの有機金属(ホウ素、スズ、フェロセンなどを含む)ポリマーが耐熱性ポリマーとして研究、使用されている。含塩素ポリマー(ポリ塩化ビニルなど)の安定剤として、スズ化合物が用いられている例もある。
一方、殺菌剤、殺虫剤としていろいろな有機金属化合物が利用されており、水銀、ヒ素、スズ化合物などがそのおもなものであるが、人体への影響などから製造を禁止されているものもある。医療用として金属化合物が用いられている例も多い。たとえば、ホウ素ががん組織へ濃縮されやすいという性質を応用して、中性子照射によりホウ素10(天然のホウ素は約18%のホウ素10を含有)が崩壊しα(アルファ)粒子でがん組織を壊す治療法も行われている。
[西山幸三郎]
百科事典マイペディア 「有機金属化合物」の意味・わかりやすい解説
有機金属化合物【ゆうききんぞくかごうぶつ】
→関連項目有機化合物
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「有機金属化合物」の意味・わかりやすい解説
有機金属化合物
ゆうききんぞくかごうぶつ
organometallic compound
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...