精選版 日本国語大辞典 「水酸化ナトリウム」の意味・読み・例文・類語
すいさんか‐ナトリウムスイサンクヮ‥【水酸化ナトリウム】
改訂新版 世界大百科事典 「水酸化ナトリウム」の意味・わかりやすい解説
水酸化ナトリウム (すいさんかナトリウム)
sodium hydroxide
化学式NaOH。強い腐食性をもつため,俗に苛性(かせい)ソーダcaustic sodaとよばれている。
性質
潮解性の強い無色の固体。室温では斜方晶系のα型(低温型)。299.6℃で立方晶系のβ型(高温型)に転移する。試薬としては通常,ペレットの形で市販されている。完全に無水のものの融点は328℃であるが,実際はきわめて除去しにくい水と炭酸塩の少量を含むため,318.4℃と約10℃低い融点を示すのがふつうである。沸点1390℃。比重2.130。屈折率1.3576。融解熱1.70kcal/mol。生成熱102.7kcal/mol。水に溶解するとき大量の熱を発生する。1,2,3,3.5,4,5,7水和物が知られている。3.5水和物は無色単斜晶系の結晶で融点15.5℃。水100gへの溶解度は42g(0℃),109g(20℃),347g(100℃)。エチルアルコール,グリセリンに易溶。エーテル,アセトン,液体アンモニアに不溶。水溶液は強いアルカリ性を示す。空気中で水および二酸化炭素を吸収し,炭酸塩に変わる。生じた炭酸ナトリウムは水酸化ナトリウムの濃厚溶液に難溶であるため,この性質を利用して炭酸塩を含まぬ水酸化ナトリウム水溶液を調製することができる。逆にこの性質は,二酸化炭素の吸収用には不利となるため,通常は,炭酸塩を析出するおそれのない水酸化カリウムの溶液が用いられる。熱に対しきわめて安定で,強熱しても水と酸化物とに分解することはない。
難溶性ケイ酸塩,リン酸塩,硫酸塩と共融(アルカリ融解)すると,水溶性のナトリウム塩を生ずるので,これらの溶解に利用されるが,融解状態で金,白金を侵すため,アルカリ融解には高温で水酸化ナトリウムに対する耐性の大きい銀またはニッケル製のるつぼが用いられる。低温でフッ素と反応してフッ化ナトリウム,水,酸素を生ずる。塩素,臭素,ヨウ素と反応し,低温では種々の酸化ハロゲン化物を,高温ではハロゲン化ナトリウムを生ずる。硫黄と反応して硫化ナトリウムおよびチオ硫酸ナトリウムを生じ,セレンとはセレン化ナトリウムと亜セレン酸ナトリウムを与える。リンと反応してリン化ナトリウムとホスフィンおよび種々のホスホリル化合物を,ヒ素とは亜ヒ酸ナトリウムとヒ化水素を生ずる。炭素と強熱すると還元されてナトリウムを生じ,水素と一酸化炭素を発生する。カルシウムと赤熱すると還元されてナトリウムを生ずる。濃厚水溶液はケイ素と反応してケイ酸ナトリウムと水素を生ずる。水溶液はアンモニウム塩と反応してアンモニアを遊離させ,多くの金属塩水溶液から水酸化物を沈殿させる。鉛,アンチモン,スズ,アルミニウム,クロム,亜鉛の水酸化物は両性のため,沈殿は過剰の水酸化ナトリウムに溶ける。一酸化炭素と反応してギ酸ナトリウムを生ずる。油脂をケン化して脂肪酸ナトリウム(セッケン)とグリセリンに変える。タンパク質やセルロースなどの有機物を分解する作用が強い。
製法
工業的製造法には,塩化ナトリウム(工業塩)電解法と炭酸ナトリウムの苛性化による方法とがある。日本では現在前者がもっぱら用いられている。
(1)塩化ナトリウム電解法 工業塩NaCl水溶液を電解して,苛性ソーダ,塩素ガス,水素ガスが同時に取得される。この方法を電解ソーダ法といい,得られる苛性ソーダを電解ソーダという。
2NaCl+2H2O─→2NaOH+Cl2+H2
NaClの各成分が上式に示されるように完全に利用されるわけで,Cl分も塩素ガスのような利用性の高い形に変わるので,きわめて合理的なNaCl利用法である。問題点の一つは,苛性ソーダと塩素との双方の需給がバランスを保つ必要があることで(〈苛性ソーダ-塩素のバランス問題〉),どちらかが過剰になると,その新しい利用や処分法を考える必要が生じる。電解反応の原理は古くから知られていた。NaCl水溶液では次のイオン4種が存在し
NaCl⇄Na⁺+Cl⁻
H2O⇄H⁺+OH⁻
これを電解すると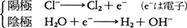
陰極でアルカリが生成するが,そのままでは陽極に生じたCl2と混合して
Cl2+OH⁻⇄ClO⁻+Cl⁻+H2O
が右に進むので,生成物が消費される。そのため生成物相互を分離するくふうがなされ,その方法には隔膜法,水銀法,イオン交換膜法の3種がある。発電機の発達した19世紀後半から直流電流を用いての工業的規模の電解が可能になった。陽極材質は長い間黒鉛が用いられたが,最近では消耗のない寸法安定電極dimensionally stable electrode(DSEと略称。金属チタンに酸化ルテニウム(Ⅳ)RuO2を被覆した金属電極)に切り替えられている。
(a)隔膜法 陽極と陰極(鉄)との中間に隔膜を設け,液を陽極室→陰極室に流して逆流を防ぐ(図2)。NaOH,NaCl混合液(NaOH10~12%程度)が得られるので,蒸発缶で濃縮し,析出するNaClを分離して原料に回す。電解用隔膜の材質の吟味はかなりやっかいである。細孔径が適当であること,機械的・化学的(ことにアルカリに対し)に安定であること,イオンは透過し分子は通さぬこと,などの条件があり,石綿がこの要求を満足する。隔膜法は最も古くから行われていたが,苛性ソーダ純度等が劣り,工程として非経済的であるとされ,水銀法の発達をみた。しかし水銀法は水銀Hgによる環境汚染問題が起こり,ふたたび隔膜法に転換する政策が日本では採られた。
(b)水銀法 隔膜を用いず,陽極と水銀陰極との間で電解する。Na⁺が陰極で放電しHgと反応してナトリウムアマルガムをつくる。
Na⁺+e⁻+Hg─→Na-Hg
水銀陰極の使用形式にはさまざまのくふうがこらされ,以前は水銀を床に流す方式が用いられたが,その後,立型・水平型の鉄板の表面をナトリウムアマルガムでぬらしたものが回転する回転陰極方式が採用されている。これは電解槽の面積を圧縮し生産能率を高めた装置である。このアマルガム中ではNa0.2%程度が流動上適するとされる。アマルガムを別の場所に運び加水分解すると
Na-Hg+H2O─→NaOH+Hg+H2
の反応でNaOHとなりHgが回復再生するのでこれを循環させる。この操作を解こう(汞),そのための装置を解こう塔(槽)という。NaOH50%水溶液が得られるので,そのまま製品となり,また濃縮も容易であり,高電流密度操業も可能である。日本においては1973年ころには水銀法が電解ソーダの96%を占めるに至った。しかしその後,一般に水銀使用にもとづく環境汚染が社会的問題となったため,非水銀法への転換方針が73年決定され,以来隔膜法の復活,イオン交換膜法の開発が行われている。また水銀を使用する場所には厳密なクローズドシステムが施されるようになった。ヨーロッパでは水銀法が主流である。
(c)イオン交換膜法 隔膜法の改良法に該当する。第3の電解ソーダ法として最近注目されており,日本,アメリカなどで開発が進んでいる。Na⁺のみを通す陽イオン交換膜を使用する。生成苛性ソーダの純度は高く,その濃度も20~40%である。イオン交換膜は末端にCOOH基を有する(CF2)n系のフッ素樹脂(商品名ナフィオン)がデュポン社により開発されている(〈食塩電解〉の項参照)。
(2)炭酸ナトリウムの苛性化 電解ソーダ法の発達する以前に用いられた方法で,日本では現在は行われていない。湿式法,乾式法がある。
(a)湿式法 石灰法ともいう。Na2CO3水溶液に石灰乳Ca(OH)2を加えて
Na2CO3+Ca(OH)2─→CaCO3+NaOH
の複分解反応で沈殿したCaCO3を分離し,母液を濃縮する。日本では電解ソーダ法とあわせて実施されていたが,1968年以後中止した。
(b)乾式法 酸化鉄法またはレービヒ法Löwig processとよぶ。まず固相反応でNa2CO3から鉄酸ナトリウムをつくる。
Na2CO3+Fe2O3─→NaFeO2+CO2
これを加水分解してNaOHをつくり,固体Fe2O3を再生循環する。
NaFeO2+H2O─→NaOH+Fe2O3
高濃度NaOH液を得ることができ,有利のはずであるが,一方で強アルカリ物質の高温処理を行うため炉材が腐食されやすいのが難点である。
用途
各種ナトリウム塩,金属ナトリウム,セッケン,調味料等の原料,レーヨン,紙,パルプ,アルミナの製造副原料のほか,苛性ソーダ過剰生産の折は炭酸ナトリウムの原料にする。中和剤,酸性ガス処理剤としても使用される。
水酸化ナトリウムは劇薬で,強い腐食性があるので取扱いには注意を要する。中毒の場合は多量の水または食酢を服用する。生卵,植物油の飲用も有効である。皮膚に付着した場合は水洗では容易に除けないので,5~10%硫酸マグネシウム水溶液で洗浄するとよい。目に入ったときは,角膜が侵されて失明するおそれがあるから,すばやく大量の水(できればホウ酸水)でよく洗い,直ちに眼科医の診察を受ける。
執筆者:藤本 昌利+金澤 孝文
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「水酸化ナトリウム」の意味・わかりやすい解説
水酸化ナトリウム
すいさんかなとりうむ
sodium hydroxide
ナトリウムの水酸化物。カ性ソーダcaustic sodaの別名がある。カ性とは「皮膚を侵す」の意。1884年グラスゴーの工場でソーダ母液を石灰乳でカ性化したのがカ性ソーダ工業の始めであるといわれている。現在ではすべて食塩水の電解によって製造されている。製品として市販されているものには、融解後ドラム缶に流し込んで固化したものと、片状・棒状あるいは半球形錠剤に成形したものなどがある。品質はJIS(ジス)(日本産業規格)および食品衛生法によって規定されている。
[鳥居泰男]
製法
工業的な製造法にはカ性化法と電解法がある。
〔1〕カ性化法 アンモニアソーダ法によって生じた粗重曹の水溶液に炭酸ガス(気体二酸化炭素)を吸収させて炭酸ソーダ原液とし、これに石灰乳を加えて
Na2CO3+Ca(OH)2―→2NaOH+CaCO3
生じた沈殿を濾別(ろべつ)し、蒸発濃縮する。この方法は、近年の塩素工業の急速な発展に伴い、電解法にとってかわられ、1968年(昭和43)以降日本では行われていない。
〔2〕電解法 塩化ナトリウム水溶液を電気分解する方法で、水銀法、隔膜法、イオン交換膜法の三つの方法が行われている。
(1)水銀法 陽極に金属電極(黒鉛など)、陰極に水銀を用いる方法で、負極で放電したナトリウムが水銀に溶けてアマルガムとなる。このナトリウムアマルガムを解汞(かいこう)槽に導いて水と反応させ、水酸化ナトリウムを得ている。製品の品位の点で優れているが電力費が高く、高価で有害な水銀を多量に使用する点が問題である。日本では他の方法への転換が急速に進んだ。
(2)隔膜法 陽極に金属電極、陰極に鉄を用い、両極間にアスベスト製の隔膜を入れて電解する。陽極で塩素、陰極で水素とともに水酸化ナトリウムが生成する。隔膜によって両極の生成物の混合が防止されている。この方法は電力効率が高い点で優れているが、塩化ナトリウムや塩素酸ナトリウムの混入率が高く、純度の点で他の方法に劣る。
(3)イオン交換膜法 陽イオン交換膜を用いて陰陽両極室を分離して電解を行う方法。両電極における反応は隔膜法とまったく同じであるが、塩化ナトリウムの混入率が低いなど純度の点では優れており、今後の進展が期待される。
[鳥居泰男]
性質
潮解性で、空気中に放置すると湿気を吸って溶けるとともに、炭酸ガスを吸収して炭酸ナトリウムとなる。水に溶けやすく、その際大量の熱を発生する。水溶液は強アルカリ性を呈する。エタノール(エチルアルコール)、グリセリンにもよく溶けるが、エーテル、アセトンには溶けない。強熱しても酸化物と水に分解しないが、簡単に融解し、金、白金、ケイ酸などを侵すので、岩石など反応しにくい固体物質を融解するのに用いられる。一酸化炭素と反応してギ酸ナトリウムとなり、油脂をけん化してせっけんとグリセリンを生ずる。またタンパク質、セルロースなどの有機物を分解する。
[鳥居泰男]
用途
化学工業全領域にわたって広い用途をもっている。レーヨン、ステープルファイバー、セロファン、紙、パルプなどの製造、せっけん、染料、香料、農薬、医薬などの製造、金属アルミニウムや各種ナトリウム塩の製造、石油、油脂の精製などがおもなものである。そのほか分析試薬、乾燥剤、二酸化炭素吸収剤に用いられる。
[鳥居泰男]
注意
劇薬(許容濃度1立方メートル当り2ミリグラム)であるから、水溶液が皮膚に触れたり、目に入ったりした場合には、水でよく洗ったのち、ホウ酸水などで洗う必要がある。誤飲した場合には、レモン水を大量に飲むほか、牛乳、卵白を飲むのも有効である。
[鳥居泰男]
水酸化ナトリウム(データノート)
すいさんかなとりうむでーたのーと
水酸化ナトリウム
NaOH
式量 40.0
融点 318.4℃
(完全無水は328℃,実際には水と炭酸
塩を含む)
沸点 1390℃
比重 2.130
結晶系 斜方
屈折率 (n) 1.3576
溶解度 109g/100g(水20℃)
融解熱 1.70kcal/mol
生成熱 102.7kcal/mol
溶解熱 10.10kcal/mol(水200ml,18℃)
転位温度 299.6℃(→立方)
化学辞典 第2版 「水酸化ナトリウム」の解説
水酸化ナトリウム
スイサンカナトリウム
sodium hydroxide
NaOH(40.00).カセイソーダともいう.塩化ナトリウム水溶液を隔膜を用いて電解すると陰極室に生成する(隔膜法).また,炭酸ナトリウムと水酸化カルシウムとの反応によっても得られる.純粋なものは無色透明な固体で,融点328 ℃.通常は少量の水と炭酸塩などを含む白色のもろい固体で,融点318.4 ℃,沸点1390 ℃.密度2.13 g cm-3.潮解性で,水には多量の熱を発して溶ける.水100 g に対する溶解度は42 g(0 ℃),109 g(20 ℃),347 g(100 ℃).エタノールに易溶,エーテル,アセトンに不溶.水溶液は強アルカリ性で濃厚なものは腐食性が強く,有機物を分解し皮膚をおかす.とくに眼に触れると失明のおそれがある.二酸化炭素を吸収して炭酸ナトリウムを生じ,アンモニウム塩からアンモニアを遊離させ,また多くの金属塩水溶液から金属酸化物や水酸化物を沈殿させる.熱的に安定で,ケイ酸塩,リン酸塩,硫酸塩のアルカリ融解により水溶性のナトリウム塩を生じる.化学工業全般にわたって広く用いられる.人造繊維工業,製紙,化学薬品,せっけん,石油精製,軽金属,染料工業,ナトリウム塩の製造,ゴムの再生,有機合成,分析試薬,乾燥剤,二酸化炭素の吸収剤などに用いられる.[CAS 1310-73-2]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「水酸化ナトリウム」の意味・わかりやすい解説
水酸化ナトリウム【すいさんかナトリウム】
→関連項目ソーダ工業|建染染料|電解ソーダ|電気化学工業
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「水酸化ナトリウム」の意味・わかりやすい解説
水酸化ナトリウム
すいさんかナトリウム
sodium hydroxide
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「水酸化ナトリウム」の解説
水酸化ナトリウム
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...