精選版 日本国語大辞典 「臨界状態」の意味・読み・例文・類語
りんかい‐じょうたい‥ジャウタイ【臨界状態】
改訂新版 世界大百科事典 「臨界状態」の意味・わかりやすい解説
臨界状態 (りんかいじょうたい)
critical state
一定量の気体を温度一定に保って圧縮すると,気体の体積は小さくなり,圧力が増す。圧縮を続けると,ある圧力のところで液化が始まる。しかし,ある温度より上では,どんなに圧縮しても気体は液化しない。圧力を加えることによって液化が起こる限界の温度を臨界温度critical temperature,臨界温度で液化の起こり始める圧力を臨界圧力critical pressureという。臨界温度,臨界圧力は,各気体に特有なものであり,気体の量にはよらない。この温度,圧力における物質の状態(あるいは,より広い意味ではその付近の状態)が臨界状態であり,臨界状態が生ずる点を臨界点と呼ぶ。
臨界状態そのものは,1822年にフランスのカニャール・ド・ラ・トゥールCharles Cagniard de la Tour(1777-1859)が発見したことになっているが,その意味が明らかになったのは,人工的な加圧液化の方法が確立された後である。加圧液化の方法は,19世紀の初めころ,M.ファラデーらの努力によって発見され,塩素,炭酸ガス,硫化水素,シアンガス,アンモニアなどが次々に液化された。しかし,酸素,窒素,水素などの気体は,常温の下ではどんなに圧力を加えても液化しなかった。その後60年代にイギリスのT.アンドルーズが,炭酸ガスが31℃以上の温度では,どんなに加圧しても液化しないことを発見して臨界点の存在に気づき,臨界点が一般的なものであることがわかってくるとともに,それまで液化できなかった気体が次々と液化されるようになった。なお,固体と液体の間にも臨界点があるかどうかは,現在のところ理論的には不明であり,実験によっても発見されていない。
臨界状態のミクロな解釈
物質を構成する原子や分子などの粒子間には,相互に力が働いている。この力は粒子間距離が小さいときには斥力,大きいときには引力になり,無限に離れればその力は0になる。力の向きが斥力から引力に変わる距離aは,だいたい数Å(1Å=10⁻8cm)程度で,粒子間距離がこの程度のときに,相互作用ポテンシャルエネルギーは最小になる。温度は原子や分子の運動エネルギーの目安を与えるもので,低温では運動エネルギーが小さく,原子や分子が互いに及ぼし合う引力を振り切って飛散することができないので,粒子間の平均距離がa程度の配列が実現する。その配列の堅固さの度合によって,物質が流動性をもつ場合ともたない場合があり,前者は液体,後者は固体である。高温になると,原子や分子はその熱運動のため,互いの引力圏から飛び出すことが可能になる。この状態が気体である。
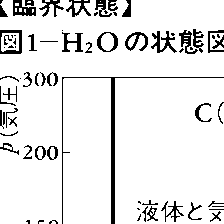
粒子間の平均距離は圧力によっても調節することができるので,気体,液体,固体のどの状態(あるいは相)をとるかは,圧力と温度によって決まる。例として,H2Oの状態図を温度-圧力面内で描けば図1のようになる。液体-気体の共存線は,点Cで終結しているが,この点が臨界点である。一定温度で系を圧縮あるいは膨張させて,液体-気体の転移を起こさせるときの圧力と体積の関係を示すと,おおむね図2のようになる。温度Tが臨界温度Tcより低い,すなわちT<Tcのとき,AB間では圧力が一定で体積だけが変化し,気体と液体が平衡で共存する。線分ABが図1の気体-液体共存線上の一つの点に対応する。この状態での液体と気体の違いは構成分子(あるいは原子)間の平均距離の違いで特徴づけられる。気体のほうが平均距離が大きく,したがって位置エネルギーは液体の場合に比べて大きい。温度一定(すなわち運動エネルギー一定)のまま液体から気体へ転移させるためには,熱的エネルギーを外部から補給する必要がある。これが転移に伴う潜熱である。温度-圧力平面上での状態図(図1)で,液体-気体の境界線(飽和蒸気圧曲線)に沿って,高温高圧側に移動することを考えてみよう。液体の側で見れば,高温になることにより原子や分子の熱振動が大きくなり,平均間隔が広がって密度は減少する。液体は凝縮相であるため,圧縮による密度の増加よりも熱振動の増加による膨張の効果のほうが打ち勝つ。気体の側から見ると,これが逆で,高温になることによる熱膨張よりも,高圧になることによる圧縮の効果のほうが強く,密度は増加する。このため,飽和蒸気圧線を,さらに高温高圧側に進むと,ある点(例えば図1の点C)で,気体と液体の密度が等しくなって,両者の区別が不可能になる。これを圧力-体積の等温曲線で見ると,図2のT=Tcの線のようになり,液体から気体への変化が連続になる。T>Tcでは,等温曲線を見ればわかるように,液体と気体は区別がつかなくなる。気体と液体が共存しているときには,その間に界面ができる。しかし,臨界温度に近づくにつれて表面張力は0に近づき,臨界点で界面は消失する。臨界状態にある物質では,密度の熱的ゆらぎが大きく光が散乱されるので白濁する。これは臨界タンパク光と呼ばれる。
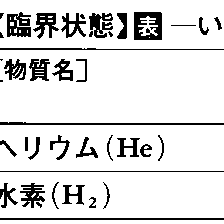
いくつかの物質について,臨界点での温度,圧力を表に示した。原子や分子の間の相互作用が弱いほど,また質量が小さいほど凝縮しにくいため,臨界温度,臨界圧力はともに低い値をとる。
2成分の混合溶液で相互の濃度が異なる2種類の飽和溶液が共存する場合(例えば,水とフェノールの溶液などの2相分離系)には,この2種類の溶液の濃度は温度によって変化するが,この濃度差はある温度で消失する。この状態も臨界状態と呼ばれる。この混合溶液の臨界状態は温度を上げていった場合に起こるものだけでなく,下げていった場合,あるいはその両方に現れるものもある。一般的に,連続的な相転移の温度を臨界温度,または臨界点と呼ぶことがある。このような連続的相転移の一般論は,ソ連のL.D.ランダウによって提唱され,超伝導や磁性の研究に広く用いられている。
→相転移 →臨界現象
執筆者:小野 嘉之
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「臨界状態」の意味・わかりやすい解説
臨界状態
りんかいじょうたい
critical state
(1)原子力用語 原子炉などで、核分裂の連鎖反応が一定の割合で継続する状態をいう。
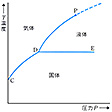
(2)熱力学用語 温度、圧力、体積をいろいろ変えて状態図をつくり、気体の液化や液体の気化などの変化をみるとき、ある点からそれがおこらなくなる。この状態を臨界状態という。純粋物質の平衡状態は温度と圧力によって定まり、一般にはのように固体、液体、気体の各相の存在範囲が示される。各相の存在範囲の境界を示す曲線は、二つの相が平衡に共存できる温度と圧力の組合せを表している。たとえば圧力一定のもとに固体を加熱していくと、直線DEを横切る温度になったとき融解現象が始まって固体と液体が共存した状態になる。このとき融解させている熱の供給を止めると、固体と液体はそのまま共存し続ける。さらに熱を供給していくと液体の割合が増えていくが、全体が液体になるまでは温度は上がらずに一定のままとなっている。これは、固体と液体との間にはっきりした物理的境界が存在し、固体から液体へ転移するためには潜熱を必要とするためである。このような転移は物質の性質(たとえば密度)を不連続的に変化させるものであり、一次相転移(一次相変態ともいう)と名づけられている。昇華および蒸気(気化)の場合も同様であり、その境界はそれぞれ曲線CD、DPによって表される。しかし曲線DPはP点で終わっている。これは、P点以上の温度と圧力になると液体‐気体転移がもはや不連続でなく、気体と液体の共存状態もなくなり、沸点も潜熱もなくなってしまうためである。このような転移では温度や圧力を変えても物質の状態は連続的に、均一に、もとの状態から最終の状態へと変化し、気体と液体が共存することは不可能となる。このような転移を高次相転移とよぶことがあるが、転移というよりも一つの状態の性質変化とみなしたほうがよい。この場合、物質は臨界状態にあるといい、のP点を臨界点、これに対応する温度と圧力をそれぞれ臨界温度、臨界圧力とよぶ。固体‐液体転移にも臨界点があるかどうかについては確証が得られていない。しかし固体‐液体転移でははっきりした原子配列の変化がおこるので、高圧にしても不連続な転移がおこり、臨界点が存在する可能性は少ないと考えられる。液体‐気体転移における臨界点の存在はファン・デル・ワールスの状態方程式からも予測される。はファン・デル・ワールス式の等温線を描いたものであるが、ある温度Tc以下では等温線に極小Aと極大Bが現れる。しかし、ABの部分は、体積が増加すると圧力も増加するという不安定な状態であって実現不可能である。実際の圧力と体積の関係は、面積XAYとYBZとが等しくなるように横軸に平行に引かれた直線XYZによって与えられる。たとえば等温線L―GにおいてはLXが液体、XZが液体と気体の共存、ZGが気体の状態に対応する。温度を上げると極小Aと極大Bがしだいに接近し、臨界温度Tcにおいて両者が一致する。すなわち、この温度以上では気体はいくら圧縮しても液体にならなくなる。Tcおよび点Cに対応する体積Vcおよび圧力Pcすなわち臨界体積、臨界圧力はファン・デル・ワールスの式により
Tc=8a/27bR
Pc=a/27b2
Vc=3b
と与えられる。水の臨界点では
Tc=374℃
Pc=218気圧
Vc=3.1cm3/g
である。
[平野賢一・飯島嘉明]
百科事典マイペディア 「臨界状態」の意味・わかりやすい解説
臨界状態【りんかいじょうたい】
→関連項目臨界圧力|臨界温度|臨界前核実験
出典 株式会社平凡社百科事典マイペディアについて 情報
化学辞典 第2版 「臨界状態」の解説
臨界状態
リンカイジョウタイ
critical state
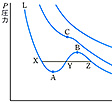
一定温度において気体を圧縮すると,一般に高温では気体のまま密度が増すが,低温では液化が起きる.その分岐点を臨界状態という.図はある物質の圧と体積の等温変化を示したものである.低温 Tl においては,低圧気体Aが圧縮されてBに達すると液化がはじまり,さらに圧縮しようとすると,すべての気体が一定圧のまま液化してCに達する.そこからは気体が存在しないので,Dで示したように体積減少に伴って急激に圧が増大する.一方,高温 Th においては圧縮に伴って密度が増加するだけで,液化はみられない.液化がはじめて観測される温度を臨界温度といい,Tc で示した.この温度で液化がはじめて観測される状態を臨界状態といい,そのときの圧を臨界圧,体積を臨界体積という.図ではP点がそれに相当し,臨界点とよぶこともある.Pを頂点とするドーム型の破線に囲まれた範囲では気体と液体が共存するので,この破線を共存曲線とよぶ.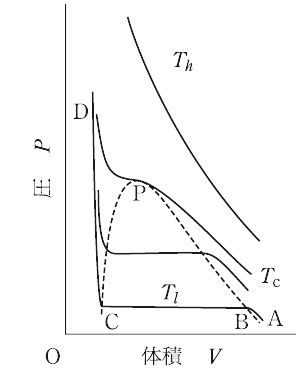
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「臨界状態」の意味・わかりやすい解説
臨界状態
りんかいじょうたい
critical state
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
岩石学辞典 「臨界状態」の解説
臨界状態
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...