精選版 日本国語大辞典 「複素環式化合物」の意味・読み・例文・類語
ふくそかんしき‐かごうぶつフクソクヮンシキクヮガフブツ【複素環式化合物】
- 〘 名詞 〙 環式化合物のうち、炭素以外に酸素、窒素、硫黄など異種の原子をも環に含む化合物の総称。
日本大百科全書(ニッポニカ) 「複素環式化合物」の意味・わかりやすい解説
複素環式化合物
ふくそかんしきかごうぶつ
heterocyclic compound
分子を構成する原子が化学結合により環状に連なっている環式有機化合物は、炭素原子のみで環が構成されている炭素環式化合物と、環を構成する原子として炭素以外の原子が加わっている複素環式化合物に分類される。いいかえると、複素環式化合物とは炭素以外の酸素、窒素、硫黄(いおう)などのヘテロ原子heteroatom(異原子)を環の構成原子として含む環式化合物の総称である。複素環化合物、ヘテロ環化合物(ヘテロ環式化合物)ともよばれる。広く天然に存在し、核酸(デオキシリボ核酸=DNAやリボ核酸=RNA)、クロロフィルなどの生物学的に重要な化合物の構成単位になっているほか、人工的に合成された複素環式化合物には薬理作用をもち医薬品として重用されているものが多い。
[廣田 穰 2015年7月21日]
分類
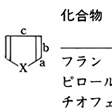
複素環式化合物は幾通りかの方法により分類される。第一は、脂環式化合物の場合と同様に、環の大きさ、すなわち環を構成する原子数による分類法である。3員環から20員環以上の大環状化合物まで、いろいろな環の大きさの複素環式化合物があるが、環を構成する原子数に従って、これらを、3員環複素環式化合物、4員環複素環式化合物、5員環複素環式化合物、6員環複素環式化合物、……のように分類する。炭素環式化合物と同様に12員環以上の大きい環をもつ複素環式化合物はマクロ環複素環式化合物(大環状複素環式化合物)とよばれる。重要な複素環式化合物の多くは5員環、6員環をもっている()。
第二は、環内に含まれているヘテロ原子の種類による分類で、フラン、テトラヒドロフランは酸素複素環式化合物(含酸素複素環式化合物)であり、ピロール、ピリジンは窒素複素環式化合物(含窒素複素環式化合物)である。環に含まれているヘテロ原子数により、さらに副分類できる。
複素環式化合物は複素環にある二重結合の数や芳香族性によっても分類され、この分類法はおもに5員環と6員環の複素環式化合物に適用される。のピロリジン、テトラヒドロフラン、ピペリジン、モルホリンのように、環内に二重結合がない飽和複素環式化合物がある。他方では、フラン、チオフェン、ピロール、ピリジンなどのように環内に可能な限り多くの二重結合をもっている複素環式化合物があり、それらの多くは芳香族性をもっている。両者の中間には、2,3-ジヒドロフランのように、部分的に二重結合をもつ化合物もある。酸素5員環に一つの二重結合をもつ2,3-ジヒドロフランは、二つの二重結合をもつフランと二重結合がないテトラヒドロフランの中間である。
[廣田 穰 2015年7月21日]
飽和複素環式化合物
正常な環の大きさの飽和複素環式化合物
よく知られている飽和の複素環式化合物としては、環にひずみがない5員環と6員環の化合物が多い。これらの飽和複素環式化合物は、本質的には相当する鎖式化合物と類似した性質を示す。たとえば、ピペリジンは鎖式の第二アミンであるジエチルアミンときわめて似た性質をもっている。両者の塩基性を比較すると、解離定数の値はジエチルアミンは9.6×10-4、ピペリジンは1.6×10-3で、ピペリジンのほうがわずかに強い塩基であるにすぎない。またテトラヒドロフランはジエチルエーテル(エチルエーテル)と同様にエーテルの性質を示し、どちらも有機金属化合物のよい溶媒として使われる。
[廣田 穰 2015年7月21日]
小員環状飽和複素環式化合物
5員環や6員環の複素環式化合物は概して鎖式の類似体と似た性質を示すといったが、3員環や4員環のように環が小さい場合には、分子内にひずみがあるので、小環状化合物に特有な反応性を示す。このような複素環式化合物の代表として、エチレンオキシドとエチレンイミンをあげることができる。
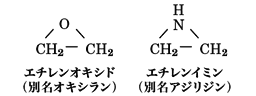
エチレンオキシドは飽和の3員環に一つの酸素原子が含まれる構造で、別名オキシラン、エポキシドともよばれる。また、エチレンオキシド環をもつ化合物を一般にエポキシ化合物という。3員環のひずみが大きく、容易に環が開いて重合や縮合をおこしやすいので、工業的に洗剤や合成樹脂の原料として重要である。接着剤として使われているエポキシ樹脂は、分子内にエチレンオキシド環をもっていて、開環反応により硬化する性質を利用している。
エチレンイミンは飽和の3員環に一つの窒素原子が含まれる構造で、ほかの窒素複素環式化合物と同様に塩基性を示す。エチレンオキシドと同様にひずみのある3員環をもっているので、開環反応性に富んでいて、接着剤やエポキシ樹脂の硬化剤として用いられる。毒性がきわめて強いので、取扱いには注意を要する。
[廣田 穰 2015年7月21日]
複素芳香族化合物
環内に最多の二重結合をもつ複素環式化合物では、相当する鎖式化合物に比べて際だった性質の相違を示すものが多い。たとえば、ピリジンは鎖式の不飽和イミンCH2=CH-CH=CH-CH=NRと安定性などの性質がまったく異なり、フランもジビニルエーテルCH2=CH-O-CH=CH2とは異なる性質をもつ。チオフェン、ピロールなどもこの仲間である。
[廣田 穰 2015年7月21日]
電子構造
これらの化合物は、いずれもヘテロ原子を含む6員環または5員環化合物で、環を構成するすべての原子が平面構造のsp2混成をとり、pπ(パイ)軌道により「環状共役6π電子系」をなしているという特徴をもつ。これが複素芳香族化合物の芳香族性の起源である。ヘテロ原子は孤立電子対(つい)をもち、6員環と5員環では異なる様式で芳香族性に関与している。
6員環のピリジンでは、五つの炭素原子の五つのπ電子と、窒素原子の一つのπ電子が「環状共役6π電子系」を構成していて、ベンゼンと類似した6π電子系芳香族の性質をもっている。ピリジンの場合には、窒素の孤立電子対はsp2混成軌道に入っていてpπ軌道には入っていない。5員環のフラン、チオフェン、ピロールなどでは、四つの炭素原子の四つのπ電子に、ヘテロ原子のpπ軌道を占める孤立電子対の2電子が加わった「環状共役6π電子系」をもつ。このような理由から、5員環と6員環のどちらも芳香族性を示すが、両者の電子構造はすこし異なっているので、両者を分けて、最多二重結合の複素環式化合物の性質について述べよう。
[廣田 穰 2015年7月21日]
5員環内にヘテロ原子をもつ複素芳香族化合物
〔1〕構造と芳香族性 この系列の代表的化合物としては、環内に酸素原子を一つもつフラン、環内に硫黄原子を一つもつチオフェン、環内に窒素原子を一つもつピロールがある(の(1))。これらの分子は、もっているヘテロ原子の種類は違うが、環内に合計6個のπ電子をもっているという共通点がある。分子全体が平面構造で、芳香族の性質を示すので、鎖式の類似化合物に比べるとずっと安定な化合物である。π電子の数は、CH=CH-CH=CH部分の4個にヘテロ原子(O、S、NH)の非共有電子対2個を加えて合計6個と数える。これら6個の電子が環状のπ電子系をなしているので、芳香族性が現れる。ヘテロ原子の非共有電子対(2個の電子)は環の炭素原子のほうに流れ出してきて、平均すると1個以上のπ電子が環炭素上にあるので、この種の5員環複素芳香族化合物をπ電子過剰性複素芳香族化合物とよぶことがある。電子過剰性であるので求電子反応性が高くなる。
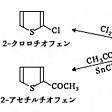
代表的な5員環複素芳香族化合物であり、異原子の種類が異なるフラン、ピロール、チオフェンの芳香族性を比べてみよう()。典型的な芳香族化合物であるベンゼンは、環のC-C結合距離には単結合と二重結合の区別がなくすべて0.1399ナノメートルの正六角形構造であるのに対して、芳香族性がない1,3-ブタジエンではC=Cが0.134ナノメートル、C-Cが0.147ナノメートルで単結合と二重結合の違いがあることが知られている。このことからわかるように、芳香族性が増すと単結合と二重結合の区別がなくなるので、結合距離が芳香族性を測る目安になる。フラン、ピロール、チオフェンの3化合物では、すべて単結合はブタジエンの0.147ナノメートルよりも短くなり二重結合はブタジエンの0.134ナノメートルよりも長くなっているので三つの化合物すべてが芳香族性をもっていることがわかり、結合距離の数値を比べると単結合と二重結合の結合距離の差が最小のチオフェンが3化合物のうちで最大の芳香族性をもつと予測できる。また、異原子と炭素原子との電気陰性度の差が小さいほど芳香族性が大きくなることが知られていて、これから考えてもフラン<ピロール<チオフェンの順序で芳香族性が増大することになる。チオフェンの共鳴エネルギーは130kJ/molで、ベンゼンの150kJ/molに匹敵することも、チオフェンの強い芳香族性と一致している。
一般に、ディールス‐アルダー反応(ジエン合成)による付加物が生成しやすいほど芳香族性が弱いことが知られているので、この反応のおこりやすさをもう一つの目安として、環の芳香族性の強さを調べたところ、チオフェンがもっとも芳香族性が強く、フランがもっとも弱いという順序が裏づけられた。チオフェンは芳香族化合物に特有な置換反応も行う()。
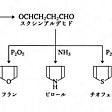
〔2〕合成法 フラン、ピロール、チオフェンは、共通の中間体であるスクシンアルデヒドを経由して、のような反応経路で合成できる。スクシンアルデヒドと五酸化リンP2O5を反応させるとフラン、五硫化リンP2S5を反応させるとチオフェン、アンモニアNH3を反応させるとピロールが得られる。中間体のスクシンアルデヒドはアクリルアルデヒド(アクロレイン)から合成する。
〔3〕一つの環内に2個以上の異原子をもつ5員環複素芳香族化合物 の(1)に示すように、フラン、ピロール、チオフェンの炭素(CH基)をさらに窒素(N)に置き換えた化合物がある。これらの化合物は、概していうとフラン、ピロール、チオフェンなどの母体の5員環化合物に似た性質をもっているが、窒素による置換で環が安定になっている場合が多い。イミダゾールやチアゾールのような環骨格は天然の生理活性物質や医薬品でしばしばみられる。
[廣田 穰 2015年7月21日]
6員環内にヘテロ原子をもつ複素芳香族化合物
〔1〕構造と芳香族性 古典的な構造式を使うと、ベンゼンのように6員環のなかに3本の二重結合が書けるような構造の複素環式化合物は、一般に芳香族性をもっている。中性の酸素や硫黄を含む6員環ではこれは不可能であり、窒素、リンなどの15族元素の場合には可能である。とくに環内に窒素をもつ6員環が重要である。
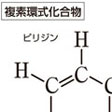
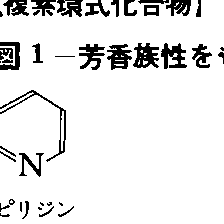
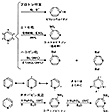
その代表がピリジンで、環を構成している5個の炭素原子と1個の窒素原子は同じ平面上にほぼ正六角形に並んでいて、炭素に結合しているすべての水素もその平面上にある。しかも、すべてのC-C結合距離はおよそ0.1399ナノメートルでベンゼンと等しく、ベンゼンと非常によく似た構造で、典型的な芳香族化合物の構造的特徴を備えている。ピリジン環は化学的に非常に安定で、ベンゼンなどの芳香族炭化水素と同様に置換反応を受けるが付加反応を受けにくい。の(2)のピリジンに続く、キノリンから1,3,5-トリアジンまでの1~3個の窒素原子を6員環内にもつ化合物も、ピリジンに似た芳香族性がある。ピリジンでは環を構成する5個の炭素原子と1個の窒素原子が2p電子をそれぞれ1個ずつ出し合って芳香族6π電子系を構成している。窒素原子の非共有電子対はσ(シグマ)軌道を占めていてπ電子ではない点が5員環複素芳香族化合物と異なっている。このために、炭素原子上のπ電子は電気陰性度の高い窒素原子のほうに流れていき、炭素原子上のπ電子は平均すると1個より少なくなるので、電子欠乏性の複素芳香族化合物とよばれる。電子欠乏性であるので、求電子反応性が減り、ベンゼンに比べて求電子置換を受けにくくなる。窒素原子に対してo(オルト)(2と6)および、p(パラ)(4)位置のπ電子のほうが窒素に引き寄せられやすく不活性化の度合いは大きいので、求電子置換はm(メタ)(3と5)位置におこるが、ベンゼンに比べるとおこりにくい。
ピリジンの窒素原子が塩基性をもっているのは、窒素の非共有電子対にプロトン(H+)が付加してピリジニウムイオンになる反応による()。ピリジンでは非共有電子対がπ電子系に加わっていないので、プロトンが付加しても芳香族性は失われず、ピリジニウムイオンも芳香族性をもっている。
〔2〕反応 ここでは、ピリジンを代表とする6員環窒素複素芳香族化合物の反応を、便宜上、(1)窒素の非共有電子対の反応、(2)陽イオンが攻撃試薬となる求電子置換反応、(3)陰イオンが攻撃試薬となる求核反応、(4)酸化還元反応、に分類して順次説明する。
(1)窒素の非共有電子対の反応 ピリジンは脂肪族アミンと比べるとずっと弱い塩基である。その理由は、脂肪族アミンでは窒素の非共有電子対が比較的エネルギーの高いsp3混成軌道を占めているのに対して、ピリジンの窒素の非共有電子対はより安定なsp2混成軌道を占めているので、弱い求核試薬であり、プロトンとの反応性も低くなっているからである。
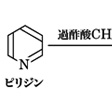
ハロゲン化アルキルやハロゲン化アシルによるN-アルキル化およびN-アシル化反応、過酸との反応によるピリジン N-オキシドの生成も、ともに窒素の非共有電子対による求核的攻撃によりおこる()。
(2)求電子置換反応 ピリジンに対する求電子置換反応は比較的おこりにくい。ニトロベンゼンに対する求電子置換がメタ位置におこるように、ピリジンでも前述の理由から3と5の位置にニトロ化やハロゲン化などの求電子置換がおこる()。酸性溶媒中ではピリジニウムイオンになるために、不活性化がさらに進み、求電子置換を受けにくくなる。求電子反応性が弱いので、ピリジンはフリーデル‐クラフツ反応を行わない。
(3)ピリジンの求核置換反応 ピリジン環の窒素原子により電子を引き寄せられている2、4、6の位置の炭素では電子が不足しているので求電子反応はおこりにくいが、プラス電荷を余分にもっているので、求核反応がおこりやすくなっている。のチチバビン反応はアミドイオンNH2-がピリジン環を攻撃する求核反応置換で、ピリジン環の2と6の位置がアミノ基により置換される。
(4)酸化と還元 ピリジンなどの電子欠乏性の窒素芳香環化合物は、芳香族化合物の代表であるベンゼンに比べて、求電子反応の一種である酸化は受けにくくなり、求核反応の一種である還元は受けやすくなっている。
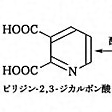
この傾向は、同じ分子内にベンゼン環とピリジン環の両方をもっているキノリンの酸化反応と還元反応を比べてみるとよくわかる()。還元反応として触媒の存在下でキノリンに気体の水素を反応させると、最初にピリジン環のほうが還元されて1,2,3,4-テトラヒドロピリジンになる。これはピリジン環のほうが還元を受けやすいからである。これと対照的に、キノリンを過マンガン酸カリウムにより酸化すると、ベンゼン環のほうが壊れてピリジン環が残り、ピリジン-2,3-ジカルボン酸ができる。ベンゼンとピリジンが縮合した構造の化合物としては、縮合する位置によりキノリンとイソキノリン2種類があるが(の(2))、両者の性質は類似していて、どちらの化合物でもニトロ化などの求電子置換はベンゼン環の側におこる。
〔3〕環内に窒素原子を二つ以上もつ6員環複素芳香族化合物 窒素原子2個を環内にもつ複素芳香族化合物としては、窒素の位置の違いにより、ピリダジン(別名1,2-ジアジン)、ピリミジン(別名1,3-ジアジン)、ピラジン(別名1,4-ジアジン)の3種類がある。N-N結合はC-C結合やC-N結合に比べて不安定であるので、ピリダジンはほかの異性体に比べて多少不安定になっている。このような理由から、窒素数が三つ以上の6員環芳香族化合物は1,3,5-トリアジンを除くと比較的不安定である。1,3,5-トリアジン骨格はN-N結合を含まないので安定で、メラミン樹脂の基本骨格として知られている。
〔4〕環内に窒素以外の原子をもつ化合物 の(2)にあるα(アルファ)-ピランとγ(ガンマ)-ピランは酸素原子を環内にもつ6員環複素環式化合物であるが、環を構成する炭素原子の一つがCH2基で環状のπ電子系をもたないので、芳香族性はない。実際にも、ピラン類は不安定な化合物である。ピランのCH2基をC=O基で置き換えたのがα-ピロンとγ-ピロンであり、ピロンの6員環は多少芳香族性があるので安定に存在する。香料として知られていて、天然にも存在するクマリンはα-ピロン環を含む構造である。
[廣田 穰 2015年7月21日]
有用な複素環式化合物
生物体に含まれるおもな複素環式化合物
生命維持活動に必須(ひっす)で遺伝情報の伝達に重要な役割を果たしている核酸の構成成分としてプリン、ピリミジンなどの複素芳香族化合物が知られている。これらは核酸塩基と総称される化合物群で、DNAの構成成分となっている塩基は、アデニン、グアニン、シトシン、チミンの4種の複素芳香族化合物であり、この4種の窒素複素環式化合物により、すべての遺伝情報が記述されている。RNAの構成成分は、チミンのかわりにウラシルが加わって、アデニン、グアニン、シトシン、ウラシルの4種である(の(a))。
哺乳類(ほにゅうるい)の血液の赤色色素であるヘモグロビンはの(b)のヘム色素とタンパク質が結合した構造をもち、植物の葉の緑色色素であるクロロフィルとともにピロール色素に属する。ヘモグロビンもクロロフィルも4個のピロール環を含む平面大環状化合物(テトラピロール体)であり構造的に類似している。ヘモグロビンは中心金属が鉄で、生体中で酸素を運搬する役割を果たし、クロロフィルは中心金属としてマグネシウムをもち、植物による光合成の中枢としての役割を担っている。
主として植物体中に広く分布している塩基性成分として知られているアルカロイドにも、複素環構造を含むものが多く知られている。一例をあげれば、タバコの葉の毒性成分であるニコチンは、ピリジン環とピロリジン環の両者を分子中にもっている(の(c))。
天然に存在する糖類は、ほとんどすべてが酸素複素環式化合物である。
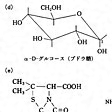
植物体の構成成分であるセルロースや栄養成分であるデンプンなどを構成するグルコースなどの糖類は、ピラノース環とよばれる酸素原子1個を含む飽和の6員環をもっている(の(d))。
[廣田 穰 2015年7月21日]
医薬品などに使われる複素環式化合物
複素環式化合物には薬理作用をもつものが数多く知られている。たとえば、最初にその効用が知られた抗生物質であるペニシリンは窒素と硫黄を含む5員環をもち、広帯域の抗菌作用をもつサルファ剤の多くは4-アミノベンゼンスルホンアミドのアミド窒素上にさまざまな複素環置換基をもつ化合物である(の(e))。
マクロライド抗生物質とよばれているエリスロマイシンなどの化合物は酸素原子一つを含む14員環をもっている。この化合物のように分子内ラクトンの-C(=O)-O-構造をもつ大環状化合物の抗生物質はかなり多く知られている。
[廣田 穰 2015年7月21日]
『佐々木正著『複素環式化合物の化学』(1972・東京化学同人)』▽『國枝武久他著『ヘテロ環の化学 医薬品の基礎』(2002・化学同人)』▽『山中宏他著『新編 ヘテロ環化合物 基礎編』『新編 ヘテロ環化合物 応用編』(2004・講談社)』▽『Edward C. Taylor ed.The Chemistry of Heterocyclic Compounds(Interscience Publishers, New York)』▽『Alan R. Katritzky, Charles W. Rees, Eric F. V. Scriven ed.Comprehensive Heterocyclic Chemistry(Pergamon Press, Oxford)』
複素環式化合物の構造例〔図A〕
フラン、ピロール、チオフェンの性質〔表…
チオフェンの芳香族置換反応〔図B〕
フラン、ピロール、チオフェンの合成〔図…
ピリジンの反応〔図D〕
ピリジンの過酸との反応(芳香族性の維持…
キノリンの酸化と還元〔図F〕
生物界に存在する複素環式化合物の例〔図…
生物界に存在する複素環式化合物の例〔図…
改訂新版 世界大百科事典 「複素環式化合物」の意味・わかりやすい解説
複素環式化合物 (ふくそかんしきかごうぶつ)
heterocyclic compound
環式化合物のうち,環を構成する原子に炭素以外の原子が含まれているものをいう。炭素環式化合物同様,5員環,6員環のものが多い。複素環式化合物において,(1)ピリジンのように二重結合と単結合が交互に並んで共役系(共役二重結合)をつくっているか,(2)ピロールのように二重結合がくるべき位置に非共有電子対を有する原子(窒素など)をもつものは,芳香族性を示し,芳香族化合物に分類される(図1)。複素環式化合物の多くは,1個またはそれ以上の窒素N,酸素O,硫黄S原子を環に含む。それ以外の周期表第ⅣB族,第ⅤB族,第ⅥB族元素,たとえばケイ素Si,リンP,セレンSeなどを含む化合物も知られている。複素環式化合物は種類も数も他の型の有機化合物に比べて際立って多い。アルカロイドや糖類など,重要な天然有機化合物はそれぞれ窒素,酸素を含む複素環式化合物である。また生体内で重要な役割を果たしている物質の中には,複素環式化合物をその活性中心にもつものも少なくない。ヘモグロビン,クロロフィル,ビタミンB12等に含まれるポルフィリン骨格は,ピロール環4個を中心としてつくられている(図2)。また生化学的に重要なアデノシンはアデニンとリボース(ともに複素環式化合物)からなるグリコシドである(図3)。DNAでは,リボースに結合するアデニン,チミン,シトシン,グアニンの配列順序によって遺伝暗号がつくられる。
執筆者:竹内 敬人
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「複素環式化合物」の解説
複素環式化合物
フクソカンシキカゴウブツ
heterocyclic compound
環式化合物のうち,環に炭素以外の原子(ヘテロ原子)を含むものをいう.ただし,エポキシドやラクトンのように鎖式化合物から容易に誘導され,また,環が容易に開いて鎖式化合物になるようなものは,これに含めない.ヘテロ原子として,N,O,Sなどを含むものがもっとも普通である.また,二重結合を最大数もつものは,π電子とヘテロ原子の非共有電子対とが共役して,芳香族性を示すことが多い.五員環の代表的なものは(a)~(c)で,芳香族性は
(a) < (b) < (c)
の順に大きくなる.2個以上のヘテロ原子を含む五員環で,少なくともそのうち1個がN原子であるものを,アゾールという.(d)~(i)などがその例である.代表的な六員環を(j)~(o)に示す.複素環とベンゼン環が縮合した(p),(q)や複素環どうしが縮合した(r),(s)のものもあり,これらはいずれも芳香族性を有して安定である.多くのアルカロイド,クロロフィル,インジゴなど,複素環式化合物は天然にも広く存在する.
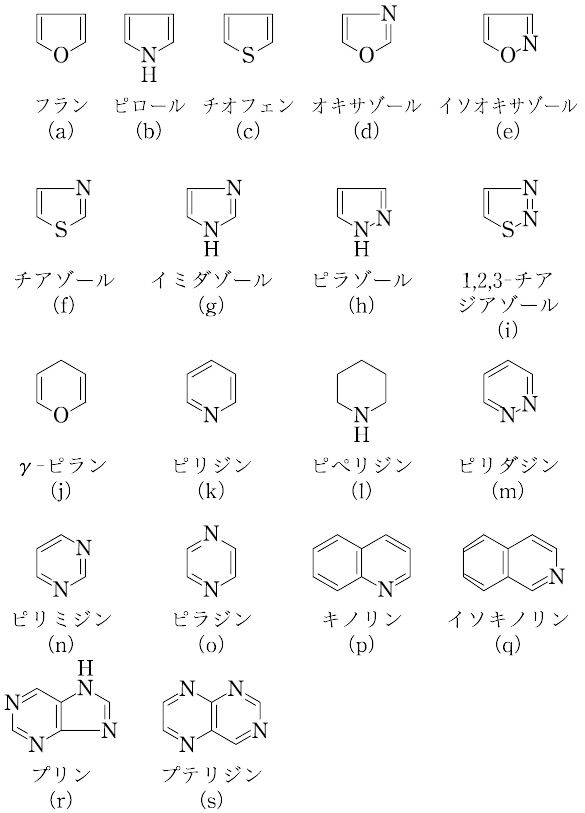
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「複素環式化合物」の意味・わかりやすい解説
複素環式化合物
ふくそかんしきかごうぶつ
heterocyclic compound
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「複素環式化合物」の意味・わかりやすい解説
複素環式化合物【ふくそかんしきかごうぶつ】
→関連項目炭素環式化合物
出典 株式会社平凡社百科事典マイペディアについて 情報
栄養・生化学辞典 「複素環式化合物」の解説
複素環式化合物
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...