精選版 日本国語大辞典 「量子化学」の意味・読み・例文・類語
りょうし‐かがくリャウシクヮガク【量子化学】
改訂新版 世界大百科事典 「量子化学」の意味・わかりやすい解説
量子化学 (りょうしかがく)
quantum chemistry
理論化学の一つで,量子力学を化学の諸問題に応用する学問分野。W.ハイトラーとF.ロンドンが1927年に,前年創始されたばかりの量子力学を用いて水素分子の共有結合を説明したのに始まり,化学結合の諸概念や化学反応性の理論などが発達した。70年代からは,コンピューターの高速化に伴って複雑な分子に対する大規模計算が盛んになり,分子の構造や反応について定量的な知見が得られるようになった。
化学結合論
化学において最も重要な化学結合は共有結合である。これは,2個の原子の間で結合に参加する2個の電子が交換されることによって安定化が生じることに由来している。一方,イオン間の結合は静電的引力に基づくイオン結合である。実際の分子の結合は共有結合とイオン結合の中間の性質をそなえているが,これは量子化学では,共有結合の波動関数とイオン結合の波動関数の重ね合せあるいは共鳴であるという。ベンゼンは3個の二重結合をもつにもかかわらずきわめて安定な化合物であるが,これは二重結合の位置の異なる二つの構造間の共鳴により安定化が起こっているからである。
→化学結合
反応性理論
量子化学を用いて分子の反応性が論じられたのは1931年,ヒュッケルErich Armand Arthur Joseph Hückel(1896-1980)による芳香族分子の反応が初めてである。以後,π電子密度や分極率を反応性の尺度とする理論,反応活性化状態における電子の局在化エネルギー理論,最高被占準位や最低空準位の電子密度を用いる福井謙一のフロンティア軌道理論などが発達した。1964年福井はフロンティア軌道の対称性が反応性を決める重要な因子であることを発見し,65年にはウッドワードRobert Burns Woodward(1917-79)およびホフマンRoald Hoffman(1937- )は立体特異性反応が軌道の対称性で統一的に説明できることを示した。これによって軌道対称性保持の法則が確立した。
→立体特異性
アプイニシオ法
量子力学を使って分子の電子状態を計算するには,二原子分子を除いては,経験的なパラメーターをとり入れた半経験的方法がおもに用いられていた。1960年代以降になると,コンピューターの発達に伴い,経験的パラメーターをまったく用いず,初めから(アプイニシオab initioは〈初めから〉という意のラテン語)量子力学を使って計算するアプイニシオ法がおもに用いられるようになり,計算の信頼度が向上した。実際の計算には,分子中に広がった分子軌道ψjを各原子上においた基底関数φ1,φ2,……を用いて,
ψj=cj1φ1+cj2φ2+……
と表すLCAO近似が最も普通に使われる。分子軌道は電子間の相互作用を平均的な場として考慮したハートリー=フォック法によって決められることが多いが,配置間相互作用法,摂動論などによって電子運動の相関をとり入れ,計算の信頼度を向上させている。
→分子軌道法
ポテンシャルエネルギー面と分子構造
分子の電子エネルギーを原子核の座標の関数として計算するとポテンシャルエネルギー面が得られる。この上の極小点が分子の平衡構造を与える。例えばハートリー=フォック法による計算結果はH2OのO-H距離0.947Å,HOH角105.5°で実験値0.957Å,104.5°とよく一致する。原子数20程度からなる分子の平衡構造は実験との誤差0.02Å,3°以内で求められる。ポテンシャルエネルギー面の鞍点(あんてん)は反応の活性化状態に対応する。実験で求めることの困難な鞍点の構造が量子化学計算から求められている。反応の始原系と鞍点のエネルギー差は活性化エネルギーと呼ばれ,反応の速度を決める重要な因子であるが,計算による予測が行われている。このほか,分子の電子励起やイオン化のエネルギーや確率についても量子化学による研究が盛んである。
→分子構造
分子間に働く力
分子の間にはファン・デル・ワールス力,交換斥力,電荷移動力などが働いているが,分子間力の本質や分子間力によってできた分子間化合物やクラスターの構造や安定性が量子化学理論で明らかになっている。たとえば,水素結合によって生じた水分子の二量体(H2O)2は下図のようにO…H-Oが直線状をした構造をしていることが理論的に予測され,実験的に確認されている。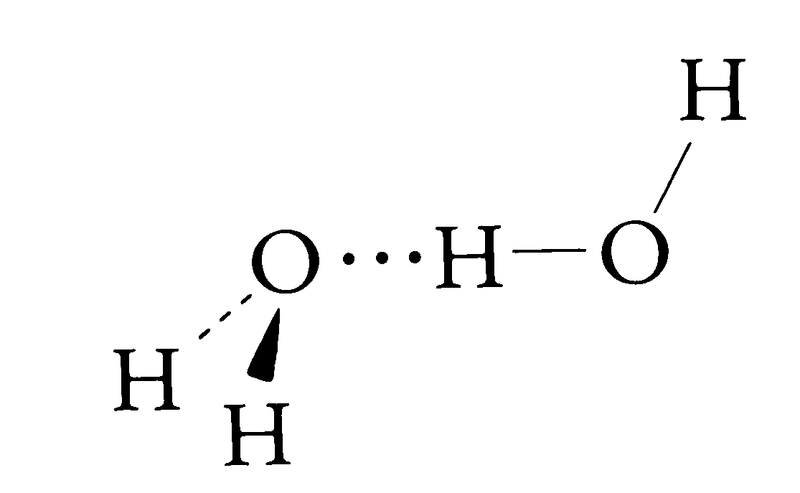
水素結合はOH結合がO⁻δ-H⁺δと分極していることに由来するファン・デル・ワールス力が最も重要であるが,電荷移動力の寄与も無視できないことが示されている。
→分子間力
分子動力学
分子と電子・原子・分子間の衝突に伴ってエネルギー移動や化学反応が起こるが,この際の原子核や電子の運動も量子化学で取り扱われている。たとえば,化学反応に際し活性化状態付近で原子核がポテンシャルエネルギー面を透過するトンネル効果が重要な役割をはたす。また,A+BC─→AB+Cなる一般式で示される化学反応に対し,BCの特定の振動・回転状態からABの特定の振動・回転状態を生成する反応断面積などが計算されている。
執筆者:諸熊 奎治
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「量子化学」の意味・わかりやすい解説
量子化学
りょうしかがく
quantum chemistry
化学の諸現象を量子力学の立場で理解する化学の一分野。化学は物質の構成、その変化を追究する学問であるが、すべての物質は究極的には原子・分子のレベルで考察することができる。原子・分子や素粒子などは量子力学によって体系化されている。この力学体系は古典力学とは異なり、視覚化すれば間違ったモデルとなってしまう。物質の本質を見極めるために、化学では原子・分子を気軽にモデル化するが、本来モデル化できない量子力学体系を化学のモデルとして活用する学問が量子化学である。
量子力学の基本はシュレーディンガーの波動方程式である。この式は、取り扱う系の質量mと位置のエネルギーUとが決まれば、その系のエネルギー値Eが求められる。このEは、量子力学が与えるその系の固有値で、物質と外部からの電磁波との相互作用(光の吸収、発光など)は異なる二つのエネルギー固有値の差ΔE=hνによって観測される。ここで、hはプランク定数で、νは電磁波の振動数である。
量子化学の発祥は水素の原子スペクトルの解釈である。デンマークのN・ボーアは、原子核の周りには電子の動く軌道があって、それらの軌道は不連続な固有のエネルギー値をもっていると仮定した。この仮定によって、今日の原子構造の基礎ができあがった。
イギリスのハイトラーとロンドンは、水素分子の結合状態を量子力学を用いて解明した。彼らは、水素原子のもつ原子核と電子の間に働くクーロン力をUにとった。今日この方法は原子価結合法(VB法)とよばれている。これとは別に、原子の波動関数の一次結合を分子の波動関数にとり、水素分子に対するエネルギー値を求める方法がある。これは分子軌道法(MO法)とよばれる。
今日では、複雑な分子に対してはMO法が広く用いられている。ここで、電子どうしの相互作用が問題となるが、今日では交換積分や重なり積分の値を半経験的または非経験的な値にとって、コンピュータでエネルギー値を求める方法が確立しつつあり、精度のよい理論値が得られるようになっている。
この方法は、分子の励起状態の構造を推定することにも用いられる。これらの構造は反応中間体のモデルに使われるので、量子化学は構造や物性のみならず、反応論にも活用できる時代となってきた。
[下沢 隆]
『福井謙一著『近代工学化学2 量子化学』(1968・朝倉書店)』▽『原田義也著『基礎化学選書12 量子化学』(1978・裳華房)』
ブリタニカ国際大百科事典 小項目事典 「量子化学」の意味・わかりやすい解説
量子化学
りょうしかがく
quantum chemistry
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
化学辞典 第2版 「量子化学」の解説
量子化学
リョウシカガク
quantum chemistry
量子力学的な原理あるいは手法にもとづいて化学現象を解釈する化学の一分野.1927年のW. HeitlerとF. London(ロンドン)の量子力学的方法による水素原子間の相互作用および結合に関する研究がそのはじまりといわれている.量子化学は,化学分野での根底となるいろいろな問題に対し,新しくかつ有効な考え方,手法を提供し,化学の基礎を大きく支えているものの一つである.分子の構造,いろいろな分光学的性質の解釈,そして反応論に対する適用,さらに生物化学的な問題にも及んでいる.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「量子化学」の意味・わかりやすい解説
量子化学【りょうしかがく】
出典 株式会社平凡社百科事典マイペディアについて 情報
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

