日本大百科全書(ニッポニカ) 「ビクトル・マイヤー法」の意味・わかりやすい解説
ビクトル・マイヤー法
びくとるまいやーほう
Victor Meyer method
気化しやすい液体の蒸気密度を測定して分子量を求める方法。ビクター・マイヤー法ともいう。1878年ドイツのV・マイヤーが考案した。
[成澤芳男]
測定方法
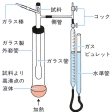
ガスビュレット(気体の体積を測定するのに用いられる器具)の中へ入ってきた空気の体積をV立方センチメートルとする。これは、試料物質の蒸気が高温で占める体積と同じ体積の空気の温度が室温t℃に下がったときの体積である。この空気の中にはガスビュレット内の水が蒸発してほぼ飽和していると考えられる。t℃における水の飽和蒸気圧をp'mmHg(水銀柱ミリメートル)とすると、乾燥空気の分圧は(p-p)'mmHgである。この空気の体積を0℃、1気圧に換算すると、
となる。V0は試料物質が0℃、1気圧で、しかも気体であったとすれば占めるであろう体積である。初めに採取、秤量(ひょうりょう)した試料がWグラムであったとすると、この物質の0℃、1気圧における仮想的な蒸気密度はW/V0g・cm-3である。これより、この物質の分子量は22414×W/V0で与えられる。この方法では目的の物質と空気とを置き換えて測定するので精度はあまりよくなく、誤差は2~3%に達すると考えなくてはならない。この方法はその後改良され、水銀やナトリウムやカドミウムの蒸気が単原子分子であること、亜ヒ酸は通常As2O3であるが、蒸気がAs4O6であること、ハロゲンが高温で原子に解離することなどが明らかにされた。亜ヒ酸は蒸気では二量体(2分子が結び付いた会合体)になる。
[成澤芳男]
歴史
1894年イギリスの化学者ラムゼーはアルゴンを発見したが、当時の技術ではアルゴンの化合物をつくることができず、原子量を決めるのにいかなる化学的方法も利用できなかった。そこでラムゼーはビクトル・マイヤー法による測定で分子量を求め、39.9という数値を得た。しかし単原子分子なのか二原子分子なのか、化学的方法が使えないのでわからない。そこで当時すでに明らかになっていた熱容量測定をすれば、それを解明できることを思いつき、定圧比熱(CP)と定容比熱(Cv)との比γ(ガンマ)を測定して、1.67という値を得た。水銀やナトリウムの蒸気が単原子分子であり、比熱比γが1.67であることから、アルゴンが常温で単原子分子であることが明らかになった。そこで分子量がそのまま原子量であることも明らかになった。
1869年ロシアの化学者メンデレーエフが元素の周期律を発見した。それによると、元素を原子量の順に並べると元素の性質が周期的に変わるということであったが、ここに新たな問題が生じた。当時カリウムの原子量は39.1であり、カルシウムが40.1であることが知られていた。したがってアルゴンはカリウムとカルシウムの間に入らなければならない。このような陽性の強い元素の間に、何物とも化合物をつくらない活性のない元素が入るのは不自然である。当時コバルトの原子量が58.9で、ニッケルが58.7、テルルが127.6で、ヨウ素が126.9というように、原子量と化学的性質が逆転している例が知られていて、またも新しい元素が発見されたとしたら、メンデレーエフの周期律の例外というのでは当時の化学者としては受け入れがたいところもあったようである。しかしこの論争は1913年モーズリーの特性X線(固有X線)の研究で次の関係がみいだされることにより、終止符が打たれた。
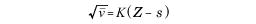
ただし、K、sはスペクトル線の帰属に依存する定数、Zは原子番号、ルートの中は特性X線の波数である。波数は波長の逆数であり、MKS単位系では単位はm-1である。この式が表しているのは「原子にX線をあて、そこから放出される特性X線の波長の逆数である波数の平方根を縦軸に、いろいろな元素の測定を行って、それらの元素の原子核中の陽子の数を横軸にプロットすると直線関係が得られる」という法則である。
1913年はデンマークの理論物理学者ボーアが、今日前期量子論といわれている水素の原子スペクトルを解釈する理論を提出した年でもある。ボーアとモーズリーはともに、ニュージーランド生まれのイギリスの物理学者ラザフォードの弟子であり、ラザフォード自身は有名なα(アルファ)線の散乱の実験により、原子の構造を解明し、さらに弟子たちがより深く原子の構造の研究をして物理学や化学の発展に貢献した。モーズリーが当時知られていた元素を詳しく調べたことにより、17番塩素、19番カリウム、20番カルシウムということがわかった。したがってアルゴンは18番元素でなければならない。なぜなら、化学的な性質からするとカリウムとカルシウムの間には入れられない。しかし陰性のもっとも強い部類に属する塩素と陽性のもっとも強い部類に属するカリウムの間に入るとすれば、化学的にまったく不活性な元素こそふさわしいと考えられたからである。特性X線の測定の結果、みごとに空欄であった18番に収まった。現在ではメンデレーエフの元素の周期律に関する定義が、原子量の順番ではなく、原子核の陽子の数すなわち原子番号の順番に並べるというように修正されている。そしてアルゴンが周期律表上一つの属を構成することが明らかになり、2番ヘリウム、10番ネオン、36番クリプトン、54番キセノンといった一連の元素が、この順番ではないが次々と発見された。
すでに放射性気体元素としてラジウムRaのα崩壊で生じるラジウム・エマネーションradium emanationがアルゴンと同じ属に属することが明らかになった。Raは88番元素であり、α崩壊をすると質量数226のRaは原子番号が二つ、質量数が四つ減少して、原始番号86、質量数222のラドンRnとなる。これはウラン238を親核種とするウラン・ラジウム系列(4n+2)という放射性壊変系列の元素であり、82番、質量数206の鉛が最終の元素である。この系列の元素はすべて4n+2に当てはまる質量数をもつ。n=51とすると206となり鉛の同位体である。n=59とすると質量数238となる。すなわちこの系列の親である。つまりこの系列の元素はα崩壊やβ(ベータ)崩壊を繰り返して、最後は質量数206の鉛の同位体になる。ほかに天然の放射系列は4nのトリウム系列、4n+3のアクチニウム系列が知られている。地球が誕生したころは存在していて現在は消滅したネプツニウム系列(4n+1)があるが、この系列は親核種の寿命が短いために消滅し、20世紀になって原子炉で質量数239のネプツニウムNpが生成されるようになって、人工壊変系列として知られるようになった。
Rはリュードベリ定数である。空欄となっていた61番元素はプロメチウムPmで、ギリシア神話の火の神プロメテウスPrometheusにちなんで名づけられた。原子炉で生成した超ウラン元素の核分裂生成物から分離され、1947年に61番元素であることが確認された。原子の火によって人類が得た、周期表上超ウラン元素を除いて最後まで空欄であった元素である。
このように新しい技術なり理論が展開されると、それに関連して学問が進歩・発展するのである。
[成澤芳男]
『玉虫文一他編『岩波理化学辞典』第3版増補版(1981・岩波書店)』▽『東京工業大学化学実験室編『理工系大学 基礎化学実験』(1988・講談社)』