精選版 日本国語大辞典 「周期律」の意味・読み・例文・類語
しゅうき‐りつシウキ‥【周期律】
日本大百科全書(ニッポニカ) 「周期律」の意味・わかりやすい解説
周期律
しゅうきりつ
periodic law
元素を原子番号の順に並べたとき、その性質が周期的に変化するという法則。元素の周期律ともいう。この法則に従って作成されたのが周期表である。
[中原勝儼]
三つ組元素――周期律発見の第一歩
近世の化学が確立され、元素の概念がはっきりし始めたころ、フランスのラボアジエは1789年すでに約30種の元素の存在を認め、非金属元素や土類元素、金属元素などという分類を行っている。そしてイギリスのH・デービーやスウェーデンのベルツェリウスがさらに元素の概念を明らかにしたことに伴い、元素の特徴による分類に目が向けられていった。それと同時に定量的な測定、とくに原子量の測定がベルギーのスタスによって精密に行われ、原子量と元素の系列との関係が1817年ドイツのデーベライナーによって初めて指摘された。
彼は、化学的性質によって元素を分類すると、よく似た性質の元素が三つずつ組になっていることが多く、しかもその原子量は算術級数的であるか、きわめて近い値をもつということに気がついた。たとえば、よく似た性質をもつカルシウムCa、ストロンチウムSr、バリウムBaの原子量はそれぞれ40、88、137で、(40+137)/2=88.5であるし、鉄Fe、コバルトCo、ニッケルNiはそれぞれ56、59、59である。このことは、1826年フランスのA・J・バラールが臭素を発見したとき、デーベライナーが前記の規則に従って、塩素とヨウ素の原子量の平均から臭素の原子量を81と予言したのが、実際に80であることが確かめられてから、大きく注目されることになった。さらに1829年デーベライナーはこのような三つ1組の元素を多くみいだし、三つ組元素triadと名づけた。これらは、たとえばの①のようなものであるが、これらの間には原子量で前記のような関係があるばかりでなく、化学的性質や物理的性質にも原子量の順序に従って差異があることが指摘された。たとえばAgCl, AgBr, AgIの色や溶解度、CaSO4, SrSO4, BaSO4の溶解度などがその例である。
このような考え方は、すべての元素に適用することはできなかったが、元素の分類から周期律の発見に至る第一歩で、重要な発見であった。この原子量による三つ組元素の概念は、その後も多くの人によってみいだされ、種々な関係が明らかにされた。たとえばフランスのデュマは1852年に次のような考えを発表した。彼は、三つ組元素で真ん中にくる元素は両端の元素の原子量の平均に近いが、やはり違っていて、その違いは明らかに実験誤差の範囲を超えており、原子量は、アルカン(メタン系炭化水素)の分子量(CnH2n+2=16+(n-1)×14)と同じようにいくつかの成分の和と考えた。たとえばの②のようになる。またイギリスのオドリングは、1857年三つ組元素を主体として元素を13のグループに分類したが、1864年にはさらに、元素を原子量の順に並べると、類似元素がしばしば48の差で現れるということをいっている。また16、40、44という間隔もしばしば出てくることから、4という単位が共通の差ではないかと考えているのである(これは現代的にいえば、ヘリウムの原子量4の倍数であるということである)。このような状況のもとに出現したのが「地(ち)のねじ」である。
[中原勝儼]
地のねじ――事実上の周期律発見
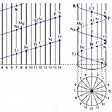
1862年フランスの地質学者ベギエ・ド・シャンクールトアは次のような発表をした。1回転を16に分割した円柱上で、原子量に相当する位置に各元素を順次並べると、のように似た元素が円柱上の同じ線上にくる(16は酸素の原子量にちなんだもの)。たとえばLi・Na・Kや、O・SあるいはF・Clなどがそうである。これをド・シャンクールトアは地質学者らしく「地のねじ」vis telluriqueと名づけた(このときのグラフが水素から始まってテルルまでプロットされたので、テルルのねじ(地のねじ)と命名されたといわれる。テルルはもともと地球を意味するラテン語tellusからつけられた元素名である)。この考え方はまさに周期律の発見であったが、ド・シャンクールトアが地質学者であったことや、地質学的な表現が多かったことから、一般の化学者の注意をひくことなく、後年に至るまで認められなかった。
[中原勝儼]
音階律――周期律の補強理論
そのころイギリスではニューランズが次のような考えを提出した。彼は1863年、元素を原子量の順に番号をつけて配列すると、よく似た性質のものが8番目ごとに繰り返して出てくるので、これによって元素を分類することができると考えた。この関係はちょうど音楽における8度の音階に似ていることから、彼はこれを音階律law of octaves(オクターブの法則)とよんだ。この考えは、元素に番号をつけたということでは原子番号ということになり、「地のねじ」と並んでまさに周期律の発見であった。しかし当時のイギリスの学界は、これを受け入れるだけの背景がなく、荒唐無稽(こうとうむけい)であるとして否定してしまった。とくに学会の講演でニューランズが発表したとき、会員の一教授が「原子量の順序のかわりに、元素名の頭文字の順序に並べて調べたら」と皮肉な質問をするほどであった。当時はこのように否定されたものの、のちにイギリス王立協会は、メンデレーエフの周期律発見に対して1882年デービー・メダルを贈ってから5年後の1887年に至って、ニューランズを認め、同じくデービー・メダルを贈っている。
[中原勝儼]
原子容曲線――マイヤーの貢献
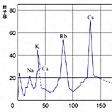
ド・シャンクールトアやニューランズの考えに続いて、ドイツではJ・L・マイヤーが原子容から周期律の発表をしている。彼は1864年に著書で不完全な形ではあるが周期律を説明し、さらにその後の考察を加え、1869年に詳細な結果を発表した。彼の考えの特徴は原子容の周期性を示す図である。
原子容というのは元素単体の1グラム原子が固体で占める体積を立方センチメートルで表した値で、原子容を原子量の順に並べるとのようになる。この曲線をみると、アルカリ金属を頂点とし、アルカリ土類金属は山の下りの斜面に、ハロゲンは上りの斜面にあり、類似の位置にくる元素は化学的にも物理的にも類似の性質をもっている。また谷底には非金属がくるし、そのほか種々の性質で繰り返しがみられる。マイヤーは、この繰り返しが原子量の差をはじめとし、それぞれの元素単位の物理的、化学的性質の示す周期性であること、すなわち周期律をみいだしたのである。
[中原勝儼]
周期律の確立とその意義
周期律の発見者がだれであるかの議論は種々あるが、元素の性質がその原子量の周期関数として変化するという考えは、ド・シャンクールトア、ニューランズ、マイヤーの時代の背景にあったということができよう。しかし、周期律の適切な表現が現代のわれわれにもっとも大きな影響を与えたと考えるならば、周期律を周期表として示したロシアのメンデレーエフが周期律を確立したということができよう。彼は1869年「元素の性質と原子量との関係」という研究を発表した。元素をその原子量の大きさの順序に並べると、元素の性質が周期的に変わるというのがこの論文の主要な点で、これを周期律といい、これに基づき、当時知られていた63元素を分類して表にした。これが周期表である。
この表の元素の位置は、疑問符のついているものを除き、配列はほとんど正しいが、ウランの位置や、水銀と金の位置が逆になっているなどの誤りもあり、いくつかの不合理な点もある。しかし、もっともたいせつなことは、彼の優れた洞察力が、周期律が元素にとって本質的なものであることを見抜いたことにあり、この周期表上の不合理な点を周期律に従って是正していることにある。すなわち、原子量の順序に厳密には従わず、逆転させたり、飛躍のあるところは空欄にして未知元素があるとしている。彼は最初の周期表に手を加え、さらに整理して、1871年第二の周期表を発表した。その周期表が信頼できるもので、周期律の存在が疑いもないものであることを認識させたのは、未知元素の予言である。その後の研究により1875年ガリウム(エカアルミニウム)、1879年スカンジウム(エカホウ素)、1886年ゲルマニウム(エカケイ素)として発見され、しかも原子量、原子価、単体の比重、色、融点、化合物などが予言と一致していた。これは驚嘆すべきことで、周期律の信頼性が確かめられ、元素を統一的にまとめるものとして広く認められるようになった。
このようにして周期律の正しいことが認められたが、それでもまだいくつかの欠点があった。そのうちもっとも大きなものは元素の位置の転倒で、Xe-I、Co-Ni、Au-Ptなどがその例である。これらはさらに精密な原子量測定によってメンデレーエフの考えが正しいことが証明されたものもあるが、そうでないものもあった。しかしそれも、1913年モーズリーの実験により原子番号の意味が明らかにされ、解決された。また、次に困難な事実であったランタノイド元素を周期表上一つの枡(ます)に入れなければならないという事実も、近代的な量子力学の登場によって解決された。すなわち、近代的な原子構造論では、元素のもつ性質のよってきたる原因が原子の電子構造にあることが明らかにされ、このことから、周期律としてもっとも重要なことは、各元素原子の原子核荷電の数ということになる。したがって原子量の順序に並べることよりも、核外電子の数である原子番号の順序に並べることが合理的であるといえる。このように周期律の正しいことが認められ、現代化学の重要な基礎の一つとなっている。
[中原勝儼]
周期律の理論
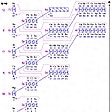
元素の周期律が発見された当時は、それは一つの経験的法則であったし、またそれによって完全なものとされてきたが、現在では量子力学による原子構造理論によって、この法則が正しいことが明らかにされている。原子は原子核とその周りに存在する核外電子から成り立ち、それらの電子は、それぞれの原子軌道関数に従って電子配置を形成している。原子軌道関数はすべて三つの量子数、すなわち主量子数n、方位量子数l、磁気量子数mによって特徴づけられており、またそれらの一つ一つの原子軌道関数に電子が属するときは、さらにスピン量子数sが+1/2か-1/2かのいずれかをとる。このように原子に所属する電子は、これらの四つの量子数によって規定される。同一原子内に入る電子は、この四つの量子数によって規定されるが、同一原子内に入る電子は、この四つの量子数がすべて同じになることはない(これをパウリの原理といっている)。またこれら量子数のとり方には一定の規則があるが、量子数の違う原子軌道関数を区別するのに、l=0, 1, 2, 3,……などに対応してs、p、d、f、……の記号を用い、主量子数と組み合わせて、2s(n=2, l=0), 3p(n=3, l=1), 4d(n=4, l=2)などと表している。これらの原則を用い、核外電子数が1の水素から、電子数103のローレンシウムまでの各原子の基底状態(エネルギー最低、すなわちもっとも安定な状態)にあるときの電子配置をに示す。ただし、Cr, Cu, Auなどは多少違っているところがある。この電子配置図からわかるようにs軌道に1個の電子が入るアルカリ金属、2個入るアルカリ土類金属、あるいはp軌道すべてが満たされる希ガス元素など、周期表での分類による元素群が原子番号に従って周期的に出現することがよくわかる。
[中原勝儼]
『中原勝儼著『電子構造と周期律』(1976・培風館)』▽『井口洋夫著『元素と周期律』改訂版(1978・裳華房)』▽『木田茂夫著『無機化学』改訂版(1993・裳華房)』▽『斎藤太郎著、梅沢喜夫・大野公一・竹内敬人編『無機化学』(1996・岩波書店)』▽『梶雅範著『メンデレーエフの周期律発見』(1997・北海道大学図書刊行会)』▽『長田好弘著『近代科学を築いた人々 中巻――周期律/光/電磁気の先駆者』(2003・新日本出版社)』▽『井口洋夫・井口眞著『新・元素と周期律』(2013・裳華房)』
改訂新版 世界大百科事典 「周期律」の意味・わかりやすい解説
周期律 (しゅうきりつ)
periodic law
元素の物理・化学的性質は,その原子番号の増加とともに周期的な変化をくりかえしていくという化学の根本的な法則。これを表の形で表したものが周期表である。
周期律発見の歩み
18世紀の末,近代化学の諸概念がようやく確立しかけてきたころには,化学者は約30ばかりの元素について,かなり不完全な知見をもつにすぎなかった。しかしその後新しい元素がつぎつぎに発見され,1860年代には約60の元素の諸性質,なかんずくそれらの原子量について,相当に豊富,正確な知識が得られるようになった。このようになると,元素の性質は個々独立のものでなく,その間にさまざまな相関性があることもわかってきた。たとえばドイツのJ.W.デーベライナーは,元素のうちには[塩素Cl-臭素Br-ヨウ素I],[カルシウムCa-ストロンチウムSr-バリウムBa],[鉄Fe-コバルトCo-ニッケルNi]のように3個1組でよく似た性質を示すものが少なくないことを認め,1829年これらを〈三つ組元素triad elements〉として元素を分類することを試みた。その後フランスのシャンクルトアAlexandre Émile Béguyer de Chancourtois(1819-86)は,さらに新しい規則性,すなわち原子を原子量に従って配列していくと,よく似た性質の元素がほぼ等間隔に現れることを発見し,これに基づいて元素を円柱のまわりにらせん状に配列した独創的な図表〈地のらせんvis de terre〉を1862年に発表した(図1)。イギリスのJ.A.R.ニューランズは,元素を原子量の順に段階的に配列していくと,8番目ごとによく似た元素が現れ,これが音楽におけるオクターブに酷似しているという〈オクターブの法則law of octaves〉(〈ニューランズの法則〉ともいう)を1865年に発表した。これらは現在の周期律の最初のいとぐちをつかんだものであったが,あまりにも独創的な内容と新奇な表現のため,その価値を認められなかった。
しかしさらにドイツのJ.L.マイヤーは,原子を原子量の順番にならべた番号(これは現在の原子番号に対応する)と元素の諸性質との関係を系統的,定量的にくわしく検討し,1869年に,〈原子容曲線〉(原子容)のように,それらの性質が原子番号の周期的関数として変化することを明確にし,また同年,ロシアのD.I.メンデレーエフは,これと独立に,元素の原子価,化合物の型式などの化学的性質をも十分考慮に入れて,現在用いられているものと本質的に同様な型式の周期表を完成した。当時はまだ未発見の元素が多かったので,メンデレーエフの周期表には多くの空欄があり,一見たよりない印象を与えるものであったが,その後それらの空欄に該当する元素がつぎつぎに発見され,それらの性質がメンデレーエフが近隣の元素の性質から予測したものとまったく一致したことから,周期律に対する学界の信頼はにわかに高くなった。さらに20世紀に入ってから,原子の構造が明らかになるとともに,その理論的解釈も可能になり,周期律はあらゆる化学的研究に不可欠の,現代化学の最も重要な根本原理と考えられるようになった。
周期律の理論
現在の化学者は,元素の周期律が成り立つ真の理由は,元素の原子構造,とくにそれらの最外部の電子の数と性質が,原子番号(原子量の順序としてではなく,核の電荷数として定義した,今日の意味での原子番号。ただし,実際上はこの二つの定義による原子番号は二,三の例外を除いて一致する)の増加とともに周期的に変化するためであるとみている。元素の物理的および化学的性質は,当然それらの原子構造によって規定されるものであるが,とりわけ原子と外界との相互作用が最も起こりやすい最外部の電子の数と性質が,それらの性質に最大の影響を与えるからである。
さて原子には,原子核のまわりに1s,2s,2p,3s,3p,3d,4s,4p,4d,4f,5s,5p,……のような記号で表される多数の電子軌道があり,その上に電子が配列されている。これらの記号中で1,2,3,……の部分は電子軌道の〈主量子数〉,すなわち原子核に近い軌道から遠い軌道へと数えたときの順序を示す数であり,s,p,d,……はそれら電子雲の形,すなわちsは球形,p,dはそれぞれ図2に示すような形の電子雲をつくる軌道であることを示す(詳細については〈原子〉および〈原子軌道関数〉の項参照)。それぞれの主量子数について,s軌道はつねに1種類しかないが,p軌道には図のように3種類,またd軌道には5種類のものが存在し,さらに複雑な形の電子雲をつくるf軌道には7種類のものが存在する。それらは互いにエネルギー的に同等で,たとえば1個の電子が2px,2py,2pzのどの軌道に入っても,電子のエネルギーは変わらない。これらの軌道上の電子のもつエネルギーは,主量子数については1<2<3<4<……の順に高くなり,また電子軌道の形についてはs<p<d<fの順に高くなる。そこで全体としては,軌道上の電子のエネルギーの順序は図3の矢印の方向,つまり1s<2s<2p<3s<3p<4s<3d<4p<5s……の順に高くなっていく。一方,電子はそれぞれ自転運動(スピン運動)をしているが,図2のおのおのの軌道は,それぞれ特定の方向に対して右回りの自転をしている電子と,左回りのものとの1対ずつを収容できる(パウリの原理)。したがってs軌道は2個,p軌道は2×3=6個,d軌道は2×5=10個,f軌道は2×7=14個の電子を収容できる。そこで原子核の電荷(すなわち原子番号)が1の水素からつぎつぎに増加していくと,それに対応して増加していく電子は図3の矢印の順に軌道をつぎつぎに満たし,表に示したような電子配列の原子が生じていくことになる。この表を周期表と比較すると,両者はみごとに対応していることがわかる。すなわち周期表の左端のⅠA,ⅡA両族の元素は,それぞれns1,ns2(nは周期の番号に等しい主量子数,s1,s2はその主量子数のs軌道上の1個または2個の電子を示す)の電子が最外部にあり,一方右端のⅢB~ⅦBおよび0族の元素は,それぞれnp1からnp6に至る最外部の電子をもつ。またその間のⅢA~ⅦA,Ⅷ,ⅠB,ⅡB族の元素は,(n-1)d1ns2から(n-1)d10ns2,すなわち周期の番号より一つ少ない主量子数のd軌道に電子がつぎつぎと取りこまれる状態の電子配列をしており,さらに周期表の下部にあるランタノイドおよびアクチノイドの諸元素は,(n-2)fすなわち周期番号より二つ少ない主量子数のf軌道で同様のことが起こっている。
このように周期表で上下に重なっている元素は一般に最外部の電子の数と性質(s,p,d,fのどの軌道上に何個の電子をもつか)がよく似ていることが,周期律の〈同族元素は互いによく似た性質をもっている〉という根本原理の基礎である。なお,周期律のもう一つの重要な原則として,〈周期表の左側の族ほど陽性(金属性)が高く,右側の族ほど陰性(非金属性)の高い元素が集まっている。また同族元素の中では,表の上部の元素ほど陰性に,下部の元素ほど陽性になる〉というものがあり,さらに〈元素の示す最大の正の酸化数Nはその族番号に等しく,最小の負の酸化数は-(8-N)に等しい〉(アベックの規則)という原則もある。これらの諸原則はとくに周期表の両端部の典型元素によくあてはまり,それぞれ原子の構造と関連づけてよく説明できる(典型元素)。
執筆者:曽根 興三
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
百科事典マイペディア 「周期律」の意味・わかりやすい解説
周期律【しゅうきりつ】
→関連項目原子容|周期|マイヤー|メンデレーエフ
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「周期律」の意味・わかりやすい解説
周期律
しゅうきりつ
periodic law
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
法則の辞典 「周期律」の解説
化学辞典 第2版 「周期律」の解説
周期律
シュウキリツ
periodic law
全元素を原子番号の増加する順に並べたとき,物理・化学的性質が周期的に変化する規則性をいう.1869年にD.I. Mendeleev(メンデレーエフ),J.L. Meyer(マイヤー)らによって独立に発見された.当時,元素は原子量の順に並べられたが,元素を特徴づけるものは原子量ではなく,原子番号であることがわかってから,上記のように改められた.別な表現をすれば,「元素の性質はその原子番号の周期的関数である」ということもできる.元素の周期律は,電子配置の規則性にもとづいて説明される.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
世界大百科事典(旧版)内の周期律の言及
【原子】より
…原子を原子番号の順に並べると,化学的に類似した性質をもつ原子がある周期で現れる。これを周期律と呼ぶ。周期表で同族の原子は外殻の構造が似ており,そのために類似した化学的性質を示すのである。…
※「周期律」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...