翻訳|lead
精選版 日本国語大辞典 「鉛」の意味・読み・例文・類語
なまり【鉛】
- 〘 名詞 〙
- ① 炭素族元素の一つ。元素記号 Pb 原子番号八二。原子量二〇七・二。蒼(そう)白色の柔らかく重い金属。等軸晶系。天然放射性同位体の崩壊系列最終生成物でもある。鉛を含有する主要鉱物には方鉛鉱・白鉛鉱・尖(せん)亜鉛鉱・硫酸鉛鉱・紅鉛鉱などがある。空気中で酸化され、表面にさびを生じるが内部には進まない。融点が低く、加工が容易で、耐食性にすぐれる。古くから密陀僧(みつだそう)・鉛丹・鉛白などとして顔料や医薬品に用いられた。現在ではめっき用電極、化学反応容器の内張り材、機械部品の金属パッキング、放射線遮蔽(しゃへい)材、合金元素などに広く用いられる。また、重く鈍い感じの事柄にたとえていうことも多い。
- [初出の実例]「神(たましひ)の鈍遅なること
 (ナマリ)の刀に同じく、字を連らね居ゑては花(うるわ)しくあらず。〈国会図書館本訓釈
(ナマリ)の刀に同じく、字を連らね居ゑては花(うるわ)しくあらず。〈国会図書館本訓釈  ナマリノ〉」(出典:日本霊異記(810‐824)中)
ナマリノ〉」(出典:日本霊異記(810‐824)中)
- [初出の実例]「神(たましひ)の鈍遅なること
- ② 贋金(にせがね)のこと。
- [初出の実例]「月によく見れば鉛よ酒の代」(出典:俳諧・一息(1693か))
改訂新版 世界大百科事典 「鉛」の意味・わかりやすい解説
鉛 (なまり)
lead
周期表第ⅣB族に属する金属元素。太古から知られていた元素(古代七金属)の一つで,古代エジプトの遺跡から鉛のメダルなどが発見されており,鉛はおそらく有史以前から,金,銀とともに,金属の形で取り出されていたと思われる。ローマ遺跡には鉛製の水道管がまだ使用できる状態で存在し,2000年も経た古い鉛の装飾品も世界各地から発見されている。
各種同位体の組成が天然の放射性親元素の種類や量によってかなり変動するために,原子量を高い精度で決めることが困難である。天然に存在する非放射性同位体(安定核種)には,204Pb,およびRaGとも呼ばれるウラン系列の出発物質である238Uの崩壊による最終生成物206Pb,AcDとも呼ばれる235Uの崩壊(アクチニウム系列)による207Pb,ThDとも呼ばれる232Thの崩壊(トリウム系列)による208Pbがある。また天然放射性元素の崩壊の途中に生成する放射性同位体としては,210Pb(β⁻崩壊,半減期20.4年,RaDと呼ばれる。ウラン系列),211Pb(β⁻,36.1分,AcB,アクチニウム系列),212Pb(β⁻,10.64時間,ThB,トリウム系列),214Pb(β⁻,26.8分,RaB,ウラン系列)がある。そのほか質量数194から213まで19種の放射性同位体が知られている。天然には,方鉛鉱,白鉛鉱,硫酸鉛鉱,紅鉛鉱などとして存在する。
性質
新しい切口はいわゆる鉛色の,やや白みがかった金属光沢のある蒼白色で,軟らかく(モース硬度1.5),重い(密度11.3437g/cm3,25℃)金属。他の金属との間の摩擦係数が小さいことも特徴の一つである。立方晶系で,面心立方格子(格子定数a=4.9396Å,18℃)を形成している。原子半径は1.76Å,Pb2⁺のイオン半径は1.24~1.28Å,Pb4⁺は0.84Åである。熱伝導率,電気伝導率は銀の8%程度で,熱伝導率は0.351J/cm・s・K(20℃),電気抵抗率2.08×10⁻5Ω・cm(20℃)。線膨張率2.924×10⁻5/deg(40℃)。空気中で加熱すると酸化されPbO,Pb3O4などを生ずる。ハロゲンともよく反応し,熱すれば硫黄,セレン,テルルとも直接化合する。希酸には一般に侵されにくいが,硝酸には溶ける。熱濃硫酸にも侵されて溶けるが,酸素の存在下では酢酸にもよく溶ける。標準電極電位はPb2⁺+2e=Pb(-0.126V),PbO2+4H⁺+2e=Pb2⁺+2H2O(+1.455V)。イオン化傾向が小さく,Pb2⁺イオンはZn,Mg,Al,Cdなどによって還元されるが,一方,鉛はHg,Ag,Au,Pt,Cuなどのイオンを還元しこれらの金属を析出させる。
製法
天然に最も多く存在するのは方鉛鉱であって,鉛製錬の主要原料となる。日本でも,東北地方,岐阜県などから産出されるが,国内需要の大部分(約90%)は選鉱によって鉛60~80%を含む鉛精鉱の状態で,カナダ,メキシコ,ペルー,ボリビアなどから輸入される。また鉛蓄電池をはじめ,スクラップを原料とした鉛の再生も盛んに行われている。鉛精鉱には一般に鉛以外に金,銀,ビスマス,亜鉛,スズ,ヒ素,アンチモンなどが含有されるので,鉛製錬の際にはこれらも回収される。現在鉛製錬は主として溶鉱炉法で行われ,鉛精鉱を焙焼(ばいしよう)・焼結して酸化鉛鉱塊とする工程,この鉱塊をコークスで還元して粗鉛とする溶鉱炉工程,粗鉛の純度を高める精製工程の3工程から成る。まず鉛精鉱にフラックス(SiO2,CaCO3など)を加えて焙焼・焼結し,PbOを主体とする焼結塊とする。この際発生する高濃度の二酸化硫黄ガスは硫酸製造原料とされる。次に焼結塊はコークスとともに溶鉱炉に装入され,コークスの燃焼によって発生する一酸化炭素によって還元されて溶融粗鉛となる。粗鉛中には,大部分の金,銀,ビスマス,一部のヒ素,アンチモン,スズが吸収されている。銅は,含まれる量が少ないときや焼結鉱の脱硫度が低いときには粗鉛中に,その他の場合は鉄の硫化物とともにかわ(鈹)をつくる。亜鉛は大部分がからみに入る。
粗鉛は含有されている不純物を有利に分離・回収し,鉛の純度を高めるため精製される。99.99%以上の純鉛を得る方法には電解法と乾式法の二つがある。乾式法では一般にビスマスの除去に費用がかさむので,ビスマスを含む粗鉛に対しては電解精製が行われる。電解法はベッツBetts法とも呼ばれる。ケイフッ化水素酸H2SiF6100g/l,ケイフッ化鉛PbSiF6を1l中に鉛として70g,これににかわ2~3g/lを加えた混成液を電解浴とし,陽極には脱銅した粗鉛,陰極には鉛の薄板(種板)を用いて,電流密度約150A/m2,電圧0.4~0.7Vで電解する。陰極に高純度の鉛が析出し,鉛より貴な金,銀およびヒ素,アンチモン,ビスマス等の不純物は不溶性のスライムとなる。スズは溶解して鉛とともに陰極に析出するので,析出した鉛を鉄のなべで溶かし,苛性ソーダを添加してスズ酸ナトリウムNa2SnO3として除去する。ベッツ法では得られる純度は99.999%にも達する。
乾式法は各不純物に対し次のような工程がとられる。(1)銅の除去 溶けた鉛をその融点近くにすると,鉛への銅の溶解度が著しく低下して析出した銅が表面に浮かぶ(これをドロスという)。銅が鉛と比べて硫黄との親和力が大きいことを利用し,硫黄の粉末を加えて,銅を硫化ドロスとして分離する方法もある。一般にこの工程をドロッシングという。(2)アンチモンの除去 アンチモンが鉛に比べて酸素との親和力が大きいことを利用して,脱銅した鉛を700℃前後に加熱し,空気または水蒸気を吹き込んで,アンチモンを優先的に酸化除去する。この工程でスズ,ヒ素も分離される。(3)金,銀の除去 亜鉛が鉛よりも金,銀に対する親和力が大きいことを利用して,溶融鉛中に亜鉛を投入して金,銀を吸収させ,次いでこれを鉛の融点近くまで冷却して金・銀,亜鉛の固相(クラストという)を鉛の表面につくって除去する方法で,パークスParkes法という。鉛中に残存する亜鉛は真空にして揮発除去する。(4)ビスマスの除去 マグネシウムおよびカルシウムを加え,ビスマスをCaMg2Bi2の金属間化合物として表面に浮かべて除去する方法であって,クロール=ベタートンKroll-Betterton法という。以上の一連の工程によって電解と同程度の純度の鉛が得られるが,前述のように脱ビスマス法が高価につくことや各工程がバッチ式となるのが問題で,電解法が一般的となっている。近年,連続操業法が開発され,不純物の種類が限られている鉱石に対しては工程が省略できるなど有利な点もあって,乾式法も見直される気運にある。
用途
鉛は密度,熱膨張が大きく,軟らかく,加工が容易であり,潤滑能がよく,弾性率,強度,融点,電気伝導率が低いといった金属材料のなかでも特色のある性質を示す。また,耐食性がよく,他の金属と合金をつくりやすいこととあわせて,広い範囲の用途がある。鋳造しやすく加工もしやすいことから,板,箔,管その他,目的に合うさまざまの形状として使用される。鉛は,ローマ時代に建設された水道管や,15,16世紀の鉛屋根の建造物が現存し,また,現在でも広く水道管や,通信あるいは電力ケーブルの被覆材として信頼性高く使用されることからもわかるように,大気,水あるいは自然環境に対してきわめて優れた耐食性があり,さらに種々の化学物質に対しても安定で,化学工業用機材としても広く使用されている。とくに硫酸に対する耐食性のすぐれていることは大きな特徴である。接合部の詰物として使用すると,力を受けてなじむ。原子番号が大きく密度も高いので,X線あるいはγ線に対する防護材料としても重要であり,鉛ブロックや鉛ガラスとして工業用,医療用,研究用に使用されている。重さそのものを利用しておもりとしての用途もある。振動を吸収する性質があるので,防音あるいは防振材としても使用される。最も多く使用されているのは鉛蓄電池で,電極板あるいは端子とされているが,酸の環境のなかで充電放電を繰り返すという厳しい条件のもとでかなり長期間使用できることは,自動車用蓄電池として日常経験するところである。その他,弾丸としても軍用あるいはスポーツ用に使用される。加工しやすいことから箔としての用途もあるが,身近のものとしてはワインの栓にかぶせてあるのも鉛である。また,はんだ,易融合金,軸受合金,活字合金としての用途も多い。鉛の化合物である鉛白2PbCO3・Pb(OH)2,鉛丹Pb3O4,一酸化鉛PbOなども純金属鉛を原料としてつくられる。四エチル鉛(C2H5)4Pbはアンチノック剤としてガソリンに添加されていたが,これらの有機鉛化合物は環境汚染の面からその使用が厳しく制限されている。
執筆者:大瀧 仁志+後藤 佐吉+大久保 忠恒
鉛による環境汚染
鉛は呼吸器や消化器を介して人体に吸収され,最終的には骨に沈着して長く蓄積される。鉛精錬,溶融,鋳造,印刷,蓄電池製造,鉛管溶接,船舶解体など鉛を取り扱う作業者が,鉛を含む粉塵を吸入して貧血,腹痛,鉛縁(歯茎の青黒い線条)などの鉛中毒に罹患することが多い。大正年間には,授乳の際,鉛白(塩基性炭酸鉛)の入った白粉をなめた乳幼児に鉛毒性脳膜炎が発生し,含鉛白粉は1935年に禁止。外国では乳幼児が住居の壁などに塗られた含鉛ペンキを食べて脳炎を伴う鉛中毒が発生した例がある。
ガソリンのオクタン価を高めるために四エチル鉛が添加されていたが,70年の東京都新宿区牛込柳町交差点周辺における自動車排出ガスによる鉛公害問題が契機となって,鉛の環境汚染を防止するため,75年,レギュラーガソリンへの鉛の添加が廃止された。しかし,大気の鉛汚染は汎地球的に進行しており,都市の大気や道路周辺の土壌の鉛汚染は,大部分は自動車排出ガスに由来すると考えられている。自動車排出ガス中の鉛は道路運送車両法によって0.06g/km以下と規制されている。また鉛の焙焼炉,転炉,溶解炉等の煤煙中の鉛排出基準は10~30mg/m3,公共用水の鉛の環境基準は0.01mg/l以下,排出基準は1mg/l,労働環境の空気中許容濃度は0.15mg/m3である。食品類,飲料水等にも鉛が含まれているが,大気などとともに人体に摂取される1日当りの総鉛量は,現在のところ人体に障害をきたすほどではないと考えられている。
執筆者:中島 泰知
日本における生産・利用史
古代には鉛の産出は銅とともにみられ,平安時代に入り長門,周防が主要な産銅地となり鉛をも出している。銅・鉛採掘の官営の鉱業所は採銅所といい,銅・鉛は鋳銭原料となった。皇朝十二銭のうち初期の銭貨地金の銅,鉛の割合は不明だが,818年(弘仁9)初鋳の富寿神宝以後のものは鉛が増して銅2,鉛1の比率となった。
16世紀から鉛の需要も増して鉛山が諸所に開かれ,銅,銀とともに採掘もされた。金銀製錬に鉛を用い,南蛮吹による銀銅分離には多量の鉛が必要とされた。江戸時代の鋳銭にも鉛を加え,顔料,鉛瓦などにも使用された。江戸初期に栄えた鉛山として藤琴(出羽),葡萄山(越後),長棟(ながと)(越中)があり,やがて十和田,細倉(陸奥)などが開かれ,生野銀山(但馬),阿仁鉱山(出羽)なども鉛を産した。しかし国産のみでは不足し,外国鉛が輸入され,大坂では販売を統制したこともあった。明治以後は神岡,細倉,対州,内ノ岱(たい),生野,中竜,葡萄などの諸鉱山で産し,近くは輸入鉱が多くなっている。
執筆者:小葉田 淳
象徴
ギリシア神話には,英雄ベレロフォンが怪物キマイラの火を吐く口に鉛の矢を射込んだところ,それが溶けて怪物を窒息させた話があり,武器としても用いられたようである。しかし半面,人間に容易に操作されるという性質は鉛自体を卑俗な金属と蔑視させる原因ともなり,錬金術にあっては黄金に変成される以前の未完成な素材〈第1質料prima materia〉と同一視されるに至った。中国や日本で〈青金(あおがね)〉と呼んだように,本来は青白色の金属であるが,空気に触れてさびやすく黒色に変化するので,西洋では最も黒く最も重い金属と考えられた。また占星術では,五惑星のうち明るさと速度が最も劣るとされた土星(サトゥルヌス=サターン)に結びつけられ,黒や鈍重さとの連想から死,死すべき肉体,老化の象徴となった。寓意としては,生命力を象徴する水銀や鳥と対比されることが多く,たとえば鉛に包まれたハトは,肉体に封じ込まれた不死の魂を象徴する。
執筆者:荒俣 宏
鉛[温泉] (なまり)
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「鉛」の意味・わかりやすい解説
鉛
なまり
lead
周期表第14族に属し、炭素族元素の一つ。鉱石からの金属の抽出が容易であるため、もっとも古くから人類が使用した金属として、約5000年前のものと思われる鉛の鋳造品などが発見されている。古代エジプトでは装飾品として、アッシリアでは建造物の一部に使われ、ローマ遺跡からは鉛製の水道管がまだ使用できる状態でみつかっている。古代中国でも鉛製品が多くあり、銅と銀との合金を鉛を用いて分離する方法も知られていた。また古代ガラスは、エジプト、オリエントなどのアルカリガラスに対し、中国、日本では鉛ガラスが多い。さらに医薬、顔料として密陀僧(みつだそう)PbO、鉛丹(えんたん)Pb3O4、鉛白(えんぱく)2PbCO3・Pb(OH)2などの鉛化合物がギリシア・ローマ時代から知られていた。中国および日本では古く青金(あおがね)とよんで五色の金(かね)(黄金(こがね)=金、白金(しろがね)=銀、赤金(あかがね)=銅、黒金(くろがね)=鉄、青金=鉛)の一つであった。元素記号のPbは鉛のラテン語plumbumに由来する。
[守永健一・中原勝儼]
存在
方鉛鉱PbS、白鉛鉱PbCO3、硫酸鉛鉱PbSO4、紅鉛(べにえん/こうえん)鉱PbCrO4などの鉱物として、また亜鉛、金、銀、銅などとともに複雑な鉱物として産出する。世界の埋蔵量は1.5億トン程度で、日本のそれはきわめて少ない。天然の放射性崩壊系列の終点の安定核種は鉛の同位体である。ウラン・ラジウム系列では鉛206、トリウム系列で鉛208、アクチニウム系列では鉛207であるから、放射性鉱物中の鉛の原子量から、その起源や年代を推定することができる。
[守永健一・中原勝儼]
製法
鉛冶金(やきん)のおもな原料は方鉛鉱で、焙焼(ばいしょう)、焼結して酸化物の塊とし、石灰石、コークスなどと溶鉱炉で強熱して粗鉛を得る。粗鉛(98.5%)の精製には乾式法と電解法がある。この精製過程で不純物として含まれている金や銀などが副産物として回収される。乾式法は歴史が古く、イギリスの工業化学者A・パークスが1842年に原理を発見したパークス法では、融解状態で亜鉛が鉛に溶けにくいこと、また金や銀が表面に浮かぶ亜鉛層に溶けやすいことを利用する。すなわち、少量の亜鉛を加えて、粗鉛中の金・銀を亜鉛合金として分離し精鉛とする。電解法は、粗鉛を陽極とし、ヘキサフルオロケイ酸鉛PbSiF6と遊離の酸H2SiF6を含む水溶液を電解して、陰極板(純鉛)上に鉛を析出させる(ベッツ法)。電解鉛とよばれ、高純度のもの(99.999%)が得られる。鉛(地金)は世界で約1053万トン生産されたが、日本では輸入鉱物からの生産を含めても25万トン程度である。消費量は世界で約1041万トン、日本では約23万トン(2011)。
[守永健一・中原勝儼]
性質
軟らかい青白色の金属。熱伝導率、電導率ともに銀の約8%にあたる。容易に切ったり曲げたり延ばしたりできる。新しい切り口は金属光沢をもつが、空気中では表面が酸化され鈍い色となる。このさびは表面を覆い、内部にまで及ばないので、腐食しにくい。空気中で熱すれば酸化鉛(Ⅱ)PbOとなる。酸化鉛(Ⅱ)を450℃付近で長く熱すると四酸化三鉛Pb3O4となるが、550℃以上でふたたび酸化鉛(Ⅱ)となる。ハロゲンとは直接反応してハロゲン化物を生じ、硫黄(いおう)と熱すると硫化物となる。希硫酸には溶けないが、熱濃硫酸や硝酸には鉛(Ⅱ)塩を生じて溶ける。酸素があれば酢酸のような弱酸にも溶ける。冷アルカリ溶液に徐々に溶け、熱アルカリには速やかに溶けて亜鉛(あなまり)酸塩M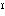 2PbO2となる。二酸化炭素を溶かした水中では表面に緻密(ちみつ)な鉛白(塩基性炭酸鉛)の皮膜を生じて内部が保護される。
2PbO2となる。二酸化炭素を溶かした水中では表面に緻密(ちみつ)な鉛白(塩基性炭酸鉛)の皮膜を生じて内部が保護される。
6Pb+3O2+2H2O+4CO2
―→2[2PbCO3・Pb(OH)2]
鉛が有毒であるにもかかわらず水道の鉛管に使用されたのはこのためである。酸化数Ⅱの化合物のほかに、酸化鉛(Ⅳ)PbO2、酢酸鉛(Ⅳ)Pb(CH3CO2)4などの化合物がある。これら酸化数Ⅳの化合物は、二価化合物を塩素を含む酸化剤で処理したり、電解酸化することによってつくられる。ほかに、テトラエチル鉛Pb(C2H5)4のような有機鉛化合物が知られる。
[守永健一・中原勝儼]
用途
金属材料としては融点が低く軟らかいので加工しやすい。また摩擦係数が小さく、大気、地中、海水などの自然環境に対する耐食性が強いこと、硫酸にも侵されにくいなど化学的性質が優れており、化学反応容器の内ばり、ケーブル被覆剤、鉛蓄電池の電極材料、建築材料に使われる。また軸受合金、活字合金、易融合金の成分として広く用いられている。X線やγ(ガンマ)線、その他の放射線を吸収する力が強いので、放射線遮蔽(しゃへい)材に用いられる。すなわち原子核産業では、鉛板あるいは鉛ガラスとして放射線防護用に用いられる。ある周波数の音波を吸収するので防音材にも使用される。しかし、目的によっては軟らかすぎるので、強度を増し、鉛の性質をなくさないような合金(アンチモン添加)がよく使われる。ケーブル被覆に約1%、蓄電池グリッド用には5~9%、また、ある種の鋳物用には10~15%加えることもある。スズとの合金は軸受合金、はんだなどにも用いられる。鉛の化合物(鉛白、酸化鉛(Ⅱ)、鉛丹、テトラエチル鉛など)も金属鉛を原料としてつくられる。
[守永健一・中原勝儼]
毒性
金属鉛はもちろん、可溶性鉛塩など体内で溶けて鉛イオンを生じるものすべてが有毒である。リン酸鉛として骨に蓄積され慢性障害を引き起こす。おもな症状として貧血、腹痛、伸筋麻痺(まひ)、不眠、視力障害などがみられる。
[守永健一・中原勝儼]
鉛(データノート)
なまりでーたのーと
鉛
元素記号 Pb
原子番号 82
原子量 207.2
融点 327.502℃
沸点 1740℃
比重 11.3437(測定温度16℃)
結晶系 立方
元素存在度 宇宙 (Si 106個当りの原子数)
2.90(第44位)
地殻 12.5ppm(第35位)
海水 10×10-3μg/dm3
化学辞典 第2版 「鉛」の解説
鉛
ナマリ
lead
Pb.原子番号82の元素.電子配置[Xe]4H145d106s26p2の周期表14族金属元素.原子量207.2(1).元素記号はラテン名“plumbum”から.宇田川榕菴は天保8年(1837年)に刊行した「舎密開宗」で,元素名を布綸爸母(プリュムヒュム)としている.旧約聖書(出エジプト記)にも登場する古代から知られた金属.中世の錬金術師は鉛を金に変えようと努力した.天然に同位体核種 204Pb 1.4(1)%,206Pb 24.1(1)%,207Pb 22.1(1)%,208Pb 52.4(1)% が存在する.放射性核種として質量数178~215の間に多数の同位体がつくられている.202Pb は半減期22500 y(α崩壊),210Pb はウラン系列中にあって(古典名RaD)半減期22.2 y(β崩壊).
方鉛鉱PbS,白鉛鉱PbCO3,硫酸鉛鉱PbSO4,紅鉛鉱PbCrO4として産出する.地殻中の存在度8 ppm.主要資源国はオーストラリア,アメリカ,中国で世界の採掘可能埋蔵量(6千7百万t)の50% を占める.全埋蔵量では1億4千万t の60% となる.鉛はリサイクル率が高く,回収された鉛蓄電池,ブラウン管などからの鉛地金生産量は,2005年には全世界で350万t に及び,全生産量の47% にも達している.青白色の光沢ある金属.金属は硫化鉱をばい焼して酸化鉛PbOにして炭素または鉄で還元するか,回収廃鉛蓄電池から電解法で電気鉛として得られる.融点327.43 ℃,沸点1749 ℃.7.196 K で超伝導となる.密度11.340 g cm-3(20 ℃).比熱容量26.4 J K-1 mol-1(20 ℃),線膨張率2.924×10-5 K-1(40 ℃),電気抵抗2.08×10-7 Ω m(20 ℃),熱伝導率0.351 J cm-1 s-1 K-1(20 ℃).結晶構造は等軸面心立方格子.α = 0.49396 nm(18 ℃).標準電極電位 Pb2+ + 2e- = Pb - 0.126 V.第一イオン化エネルギー715.4 kJ mol-1(7.416 eV).酸化数2,4があり,2系統の化合物を形成する.常温では酸化皮膜PbOによって安定であるが,600~800 ℃ で酸化されてPbOを生じる.鉛はイオン化傾向が小さく,希酸には一般に侵されにくいが,酸素の存在下で弱酸に易溶,また硝酸のような酸化力のある酸に可溶.錯イオンとしては,[PbCl3]-,[PbBr3]-,[PbI3]-,[Pb(CN)4]2-,[Pb(S2O3)2]2-,[Pb(OH)3]-,[Pb(CH3COO)4]2- などがあるが,安定な錯イオンは少なく,またアンミン錯イオンはつくらない.Pbより陽性の金属であるHg,Ag,Au,Pt,Bi,Cuの塩を還元して,溶液から金属を析出する.Pb2+ はより陰性の金属であるZn,Mg,Al,Cdによって金属鉛に還元される.
用途は,鉛畜電池用が最大で,世界全体では78%(2003年),日本80%(2003年),アメリカ88%(2006年).日本では,ついでブラウン管・CRT用ガラス,塗料,塩ビ安定剤向け無機薬品として10%,はんだ,鉛管・板など10%.アメリカでは,各種銃弾に3%,塗料・ガラス・セラミックス用3% など.はんだは鉛フリー化が急速に進行中である.ほかの用途も規制強化により需要減少の見込みで,蓄電池はEU(欧州連合)が2006年7月1日に施行した有害物質規制RoHS指令の対象にならないため,今後も主要用途とされる.同指令によれば,EU内で販売される電気電子機器への鉛の含有は,高融点はんだ,圧電素子用セラミック材料,白熱電球管,液晶ディスプレイ・バックライト用蛍光管ガラスなど一部の例外を除いて許されない.ブラウン管用ガラスは2009年現在,対象を除外されている.玩具の安全基準については,現在日本には単独の法令がなく,食品衛生法に乳幼児が口に接触する「おもちゃ」に対する「40度の水で30分間浸出して重金属(鉛として)1 ppm 以下」があるのみである.日本玩具協会はEU玩具安全規格(EN71)とアメリカ材料試験協会(ASTM)の基準値に準拠して,「鉛の溶出基準値(90 ppm)」を自主設定している.鉛の毒性は古くから鉛毒として知られている.鉛はチオール基(SH基)と親和性が高く,酵素活性を阻害して,貧血,神経症状をもたらす.そのため,「鉛及び鉛化合物」としてPRTR法・第一種化学物質に指定され,発がんクラス2,経口クラス2,作業環境クラス2(アメリカ産業衛生専門家会議(ACGIH)許容濃度は時間荷重平均濃度0.05 mg m-3),生態毒性クラス1となっている.水道法水道水質基準 鉛として0.01 mg L-1 以下,水質汚濁法排水基準 鉛として0.1 mg L-1 以下.土壌汚染対策法(平成14年制定)にも,鉛は第二種特定有害物質にあげられており,土壌含有量基準は150 mg kg-1 以下で水銀に次いで厳しい.鉛化合物とともに,金属鉛そのものも有害である.狩猟の盛んな欧米では,鉛散弾を砂と間違えて摂取した水鳥の鉛中毒による大量死が早くから問題になっていて,アメリカでは1991年から鉛散弾の使用が規制された.わが国でも,平成9年ごろから北海道で天然記念物であるオオワシやオジロワシが,エゾシカ猟に使用した鉛ライフル弾を死がいとともに摂取したため鉛中毒によるとされる死亡例が数多く指摘されるに至り,北海道庁は平成12年からのエゾシカ猟における鉛ライフル弾を使用禁止に,平成16年からヒグマも含めた大型獣猟用のすべての鉛弾を禁止した.国も大正7年制定の「鳥獣保護及狩猟ニ関スル法律」を改正して「鳥獣の保護及び狩猟の適正化に関する法律」に変更し,平成15年から指定猟法禁止区域制度を設けて区域内での鉛製銃弾使用を禁止するに至った.クレイ射撃場や,大量の家電製品を含む廃棄物処分場周辺,あるいは工場跡地などの鉛による土壌汚染や水質汚染も問題となっている.[CAS 7439-92-1]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
普及版 字通 「鉛」の読み・字形・画数・意味
鉛
常用漢字 13画
(旧字)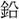
13画
[字訓] なまり
[説文解字]

[字形] 形声
声符は
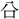 (えん)。〔説文〕十四上に「
(えん)。〔説文〕十四上に「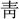 金なり」、〔玉
金なり」、〔玉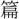 〕に「
〕に「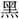 錫なり」とみえる。錫は鉛・銀の間で、銀色にして鉛質なるもの。
錫なり」とみえる。錫は鉛・銀の間で、銀色にして鉛質なるもの。[訓義]
1. なまり。
2. 鉛を焼き、その鉛華をおしろいとする。おしろい。
[古辞書の訓]
〔新
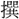 字鏡〕
字鏡〕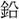
 奈万利(くろなまり) 〔名義抄〕
奈万利(くろなまり) 〔名義抄〕 ナマリ・クロナマリ
ナマリ・クロナマリ[熟語]
鉛印▶・鉛華▶・鉛汞▶・鉛紅▶・鉛膏▶・鉛黄▶・鉛槧▶・鉛黛▶・鉛丹▶・鉛摘▶・鉛刀▶・鉛毒▶・鉛白▶・鉛版▶・鉛筆▶
[下接語]
亜鉛・懐鉛・金鉛・銀鉛・玄鉛・黒鉛・焼鉛・粧鉛・蒼鉛・丹鉛
出典 平凡社「普及版 字通」普及版 字通について 情報
百科事典マイペディア 「鉛」の意味・わかりやすい解説
鉛【なまり】
→関連項目海洋投棄規制条約|工業中毒|ごみ公害|耐食合金|バーゼル条約|非鉄金属
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「鉛」の意味・わかりやすい解説
鉛
なまり
lead
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「鉛」の解説
鉛
世界大百科事典(旧版)内の鉛の言及
【沈着症】より
…外来性の物質あるいは自己の産生する物質が生体組織に沈着し変色すること。外来物質によっておこるものには炭粉沈着症(肺,リンパ節が黒色化),銀沈着症(硝酸銀の服用で皮膚,粘膜,内臓が灰色化),鉛![]() (なまりえん)(鉛を含む化粧品の使用で歯肉に硫化鉛が沈着),また入墨がある。自己の物質では,黒色色素のメラニン(そばかす,ほくろ,悪性黒色腫),褐色色素リポフスチンの沈着(萎縮性臓器),血色素(生理的に,あるいは多量の輸血後,血色素が崩壊して,鉄を含む色素が沈着する),胆汁色素(黄疸)がある。…
(なまりえん)(鉛を含む化粧品の使用で歯肉に硫化鉛が沈着),また入墨がある。自己の物質では,黒色色素のメラニン(そばかす,ほくろ,悪性黒色腫),褐色色素リポフスチンの沈着(萎縮性臓器),血色素(生理的に,あるいは多量の輸血後,血色素が崩壊して,鉄を含む色素が沈着する),胆汁色素(黄疸)がある。…
【土星】より
…錬金術では,この図像に別個の意味を与えた。錬金術のシンボル解釈では,土星=サトゥルヌスは鉛に相当する。錬金工程で,水銀に鉛を作用させてその揮発性を押さえ,凝固させる必要があるとされるが,この場合サトゥルヌスの鎌は,水銀=ヘルメス(メルクリウス)の軽快な足をなぎ払うものという意味を帯びるわけである。…
【非鉄金属鉱業】より
…非鉄鉱物資源を探査・発見し,これを採掘・取得し,選鉱・製錬する産業。非鉄金属とは広義には鉄以外の金属すべてのことであるが,一般的には銅,鉛,亜鉛,スズ,ニッケル,コバルト,タングステンなどのことを指し,金,銀などは貴金属,アルミニウム,マグネシウム,チタンは軽金属として区別されることが多い。世界の生産量(含有量)は銅鉱1002万tで,うちチリ249万t,アメリカ185万t,旧ソ連80万tなど,鉛鉱は269万tで,うちオーストラリア45万t,アメリカ41万t,中国40万tなど,亜鉛鉱は700万tで,うちカナダ111万t,中国100万t,オーストラリア90万tなど,スズ鉱は19万4600tで,うち中国5万4000t,インドネシア4万6100t,ペルー2万2300tなどである(1995)。…
※「鉛」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...




