精選版 日本国語大辞典 「ファンデルワールス力」の意味・読み・例文・類語
ファンデルワールス‐りょく【ファンデルワールス力】
- 〘 名詞 〙 分子と分子の間に働く弱い引力。この力のために分子性の結晶ができたり分子が液体になったりできる。遠方では相互距離の七乗に反比例する。一八七三年にファン=デル=ワールスが発見。
日本大百科全書(ニッポニカ) 「ファンデルワールス力」の意味・わかりやすい解説
ファン・デル・ワールス力
ふぁんでるわーるすりょく
van der Waals' force
分子間力の引力部分のなかで、もっとも普遍的な引力をいい、分散力ともいう。
理想気体の状態方程式はpV=RTで表せるが、実在の気体はこの式に従わない。そこで、オランダのファン・デル・ワールスは次のような補正式(ファン・デル・ワールスの状態方程式)を提出した。
(p+a/V2)(V-b)=RT
ここで、R、p、V、Tはそれぞれ気体定数、気体の圧力、体積、絶対温度を示し、a、bは気体の種類による定数である。とくに、aは分子間に働く普遍的引力を仮定して導かれる。ファン・デル・ワールス力の語源はこの式に由来する。a/V2は内部圧internal pressureとよばれ、「分子間相互の力」があることを示している。
この力の本質は、量子力学に基づいて次のように説明された。すなわち、ドイツ生まれのアメリカの理論物理学者であるF・ロンドンは「すべての原子・分子間に働く力は、静電相互作用である」として、これを引力と斥力とに分け、原子または分子間の距離をrとしたとき、斥力はr-12に、引力はr-6に比例することを導いた。ここで、静電気的相互作用には、〔1〕電子の運動による瞬間的な電荷分布の偏り、〔2〕永久双極子による効果、〔3〕多重極子による相互作用、などがある。このうち、分子間相互作用のもっとも大きいのは双極子どうしの相互作用で、水のように分子間に水素結合をもつ分子がその代表例である。
また、イギリスの理論物理学者レナード・ジョーンズは、原子または分子の間に働く相互作用の位置エネルギーをrのべきで表した。
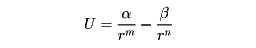
ここで、α、βは係数で、第1項が斥力、第2項が引力を表す。一般にm=12,n=6である。この係数からわかるように、斥力はrが小さいとき大きく、引力は分子間の距離が大きくとも働いている。前者を近接力、後者を遠達力ということがある。
これらの相互作用は大別して、(1)分子の分極率による相互作用―分散力(ファン・デル・ワールス力の中核をなす)、(2)永久双極子どうしや永久双極子と誘起双極子との相互作用による配向力、および(3)温度に依存しない誘起効果、に分類され、それぞれの値がいくつかの分子について求められている。
ファン・デル・ワールス力の係数aの小さいものは、分散力によって説明され、一方、分子間相互作用の大きいアンモニアのような場合、配向力・誘起力とも大きいことがわかる。これは、分子が大きい永久双極子をもつことに起因している。
[下沢 隆]
百科事典マイペディア 「ファンデルワールス力」の意味・わかりやすい解説
ファン・デル・ワールス力【ファンデルワールスりょく】
→関連項目引力|吸着|接着剤|力(物理)|分子間力
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「ファンデルワールス力」の意味・わかりやすい解説
ファン・デル・ワールス力
ファン・デル・ワールスりょく
van der Waals force
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
化学辞典 第2版 「ファンデルワールス力」の解説
ファンデルワールス力
ファンデルワールスリョク
van der Waals force
分子間力の一種であって,双極子-双極子相互作用,双極子-分極相互作用,F. London(ロンドン)の分散力の結果生じるものをいい,ファンデルワールスの状態式のa項の原因となる力と同じものである.これによって,不活性原子間にはたらく力,ベンゼンなどの分子結晶形成を説明することができる.[別用語参照]物理吸着
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
法則の辞典 「ファンデルワールス力」の解説
ファンデルワールス力【van der Waals force】
改訂新版 世界大百科事典 「ファンデルワールス力」の意味・わかりやすい解説
ファン・デル・ワールス力 (ファンデルワールスりょく)
→分子間力
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
栄養・生化学辞典 「ファンデルワールス力」の解説
ファンデルワールス力
世界大百科事典(旧版)内のファンデルワールス力の言及
【固体】より
…しかし,実際にはこれらの原子どうしが集まって固体がつくられる。このときの結合力は,分子間力,またはファン・デル・ワールス力と呼ばれ,電気双極子間の相互作用に起因する。不活性原子などではそれ自体は電気双極子モーメントをもっていないが,他の原子によって双極子モーメントが誘起され,誘起された双極子モーメントどうしの引力相互作用によって結晶がつくられるのである。…
【力】より
…金属の凝集力あるいは凝集エネルギーも水素分子の場合と似たような量子力学的起源をもっている。 このほか有機分子結晶とか不活性ガスの結晶の場合には中性分子・原子などの間に働くファン・デル・ワールス力が結合の力となっている。これは二つの分子(原子)がお互いに相手の分子を瞬間的に分極させ,その分極どうしの間に働く静電的引力が原因となって生ずる力である。…
【分子間力】より
…その結果と実測値の比較からμ,νが決められる。引力項は上記の内部圧に対応し,ファン・デル・ワールス力による。気体分子の場合,ファン・デル・ワールス力のなかでも重要なのは,分子の分極率に起因する分散力である。…
※「ファンデルワールス力」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

