精選版 日本国語大辞典 「酸アミド」の意味・読み・例文・類語
さん‐アミド【酸アミド】
改訂新版 世界大百科事典 「酸アミド」の意味・わかりやすい解説
酸アミド (さんアミド)
acid amide
アンモニアNH3分子の水素原子をアシル基RCO-で置換した化合物の総称で,単にアミドamideともいう。置換された水素の数に応じてそれぞれ第一アミド,第二アミド,第三アミドと呼ぶが,ふつう,酸アミドといえば第一アミドをさす。
RCONH2 第一アミド
(RCO)2NH 第二アミド
(RCO)3N 第三アミド
第一アミドのアミノ基の水素原子を1個または2個の炭化水素基で置換したものが多数見いだされており,これらはN-置換アミドと呼ばれる。また,イミノ基 NHをもつ第二アミドのうち,ジカルボン酸から生成する環状化合物をとくに酸イミド(イミド)と呼び,他の第二アミドと区別することが多い。β-,γ-,δ-アミノ酸が分子内で縮合環化したものはラクタムと呼ばれる。
NHをもつ第二アミドのうち,ジカルボン酸から生成する環状化合物をとくに酸イミド(イミド)と呼び,他の第二アミドと区別することが多い。β-,γ-,δ-アミノ酸が分子内で縮合環化したものはラクタムと呼ばれる。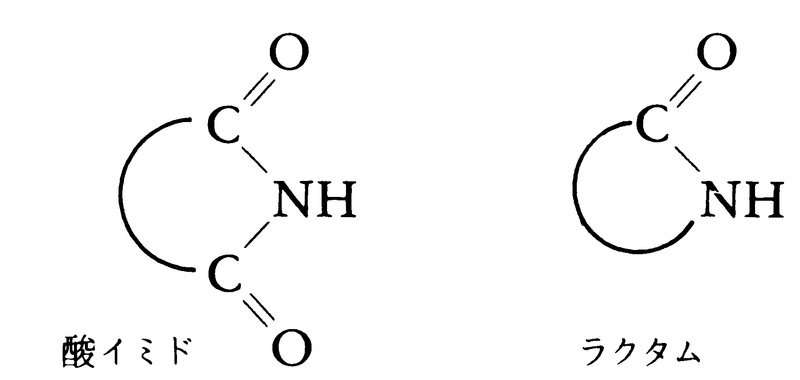
第一アミドの命名は,酸の翻訳名に〈アミド〉を続けるか,酸の英語名の接尾語〈-ic acid〉を〈-amide〉に変えた英語名の音訳を用いる(ギ酸アミド=ホルムアミド,酢酸アミド=アセトアミドなど)。N-置換アミドの名は非置換アミド名の前にN-置換基名をつける。対称的第二アミドや第三アミド名は,相当する第一アミド名の前に〈ジ〉または〈トリ〉をつける。
ホルムアミドHCONH2以外のほとんどのアミドは無色の結晶で,低位のものは水に可溶である。アルコールやエーテルにはよく溶けるが,石油エーテル,四塩化炭素などの無極性溶媒には溶けにくい。中性の化合物であるが,強酸や強塩基と反応して不安定な塩をつくることがある。また,酸や塩基触媒によって加水分解されてカルボン酸RCOOHを生じ,五酸化リンで脱水すればニトリルRCNを生じる。酸アミドは酸塩化物,酸無水物やエステルにアンモニアを作用させて合成する。この方法でアンモニアの代りにアミンを用いるとN-置換アミドが得られる。ほかに,ニトリルの加水分解,カルボン酸アンモニウム塩の加熱でも合成できる。酸アミドは有機合成原料として広く用いられるが,低位のN-置換アミドは溶媒として利用される。スルホン酸のアミドRSO2NH2はスルホンアミドsulfonamideと呼ばれる。
執筆者:井畑 敏一
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
ブリタニカ国際大百科事典 小項目事典 「酸アミド」の意味・わかりやすい解説
酸アミド
さんアミド
acid amide
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「酸アミド」の意味・わかりやすい解説
酸アミド【さんアミド】
出典 株式会社平凡社百科事典マイペディアについて 情報
栄養・生化学辞典 「酸アミド」の解説
酸アミド

化学辞典 第2版 「酸アミド」の解説
酸アミド
サンアミド
acid amide
[別用語参照]アミドの【Ⅰ】
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

