精選版 日本国語大辞典 「シアン化水素」の意味・読み・例文・類語
シアンか‐すいそシアンクヮ‥【シアン化水素】
日本大百科全書(ニッポニカ) 「シアン化水素」の意味・わかりやすい解説
シアン化水素
しあんかすいそ
hydrogen cyanide
水素のシアン化物。ギ酸ニトリルともいう。俗称青化水素、青酸ガス。アミグダリンなどの配糖体としてウメの実などに含まれる。シアン化カリウムやシアン化カルシウムに酸を作用させて得られるが、工業的にはメタン、アンモニア、空気の混合物を、白金触媒の存在下に、常圧、1000℃で反応させてつくる。プロピレンからアクリロニトリル製造の際の副産物としても得られる。原始大気中に含まれた小さな分子の一つで、生物学的に重要な化合物の出発物質と考えられている。無色の揮発性液体。液体は比誘電率がきわめて大きく、そのため塩類をよく溶かす。特有の臭気があり、点火すると紫色の炎をあげて燃える。液体は不安定で長時間貯えると重合して暗褐色の爆発性の固体となる。固体の状態では、シアン化水素分子は水素結合で無限大の鎖をつくっている。液体中でもかなりの程度水素結合が残っている。水、エタノール(エチルアルコール)、エーテルなどと任意の割合で混ざり合う。水溶液は弱酸性を示し、この液をシアン化水素酸あるいは俗称で青酸という。
シアン化ナトリウムなど無機シアン化物の合成や、メタクリル酸メチル、ヘキサメチレンジアミン、乳酸および乳酸エステル、α(アルファ)‐アミノ酸その他EDTA(エチレンジアミン四酢酸)などポリアミノカルボン酸の合成に用いられ、殺虫剤などにも使われる。猛毒なので取扱いには注意を要する。吸入だけでなく皮膚からも吸収される。吸入した場合、270ppmで即死、135ppmでは30分で死亡、110~135ppmで30分~1時間で危険または死亡するという。最大許容濃度は10ppmとされている。空気中に存在するときは試験紙で検出される。ベンジジン‐酢酸銅試験紙を青色にし、メチルオレンジ‐塩化水銀(Ⅱ)試験紙をオレンジからピンクに、ピクリン酸‐炭酸ナトリウム試験紙を黄色から紫色に変える。
[守永健一・中原勝儼]
シアン化水素(データノート)
しあんかすいそでーたのーと
シアン化水素
HCN
式量 27.0
融点 -13.3℃
沸点 25.7℃
比重 0.697(測定温度15℃)
結晶系 正方(-102.8℃)
改訂新版 世界大百科事典 「シアン化水素」の意味・わかりやすい解説
シアン化水素 (シアンかすいそ)
hydrogen cyanide
青酸,青化水素などとも俗称される。化学式HCN。リンゴ,モモ,アンズ,サクランボなどの種子中にアミグダリンなどの配糖体として含まれている。これらは酸による加水分解や酵素によってシアン化水素を分離する。工業的には,メタン,アンモニア,空気の混合ガスを白金触媒で部分酸化させる方法,一酸化炭素とアンモニアからホルムアルデヒドをつくり,熱分解する方法がある。またソハイオ法によるアクリロニトリルの製造過程で副生するシアン化水素が用いられ,とくに日本では副生シアン化水素の占める割合が高い。実験室では,シアン化ナトリウムNaCNと硫酸H2SO4の溶液を加熱して得るのが便利である。
2NaCN+H2SO4─→Na2SO4+2HCN
発生したシアン化水素は塩化カルシウムで乾燥し,氷と塩化ナトリウムで冷却したフラスコ中に導いて捕集する。
無色,特有なアンズのようなにおいのある気体ないし液体。猛毒。融点-13.3℃,沸点25.7℃。可燃性,発火点537℃,点火すると桃色の炎をあげて燃え,窒素と炭酸ガスを生ずる。爆発限界は6~41容量%。水,エチルアルコール,エーテルによく溶ける。水溶液中ではきわめて弱い酸である。酸解離定数K=1.3×10⁻9(18℃)。アルカリ性で酸化エチレンと反応させてのち脱水するか,触媒存在下でアセチレンと400~500℃で反応させるとアクリロニトリルを生成する。フェノールまたはフェニルエーテルに塩化アルミニウムの存在下で塩化水素HClとの混合気体を反応させ,次に加水分解するとフェノール性アルデヒドが得られる(ガッターマンのアルデヒド合成)。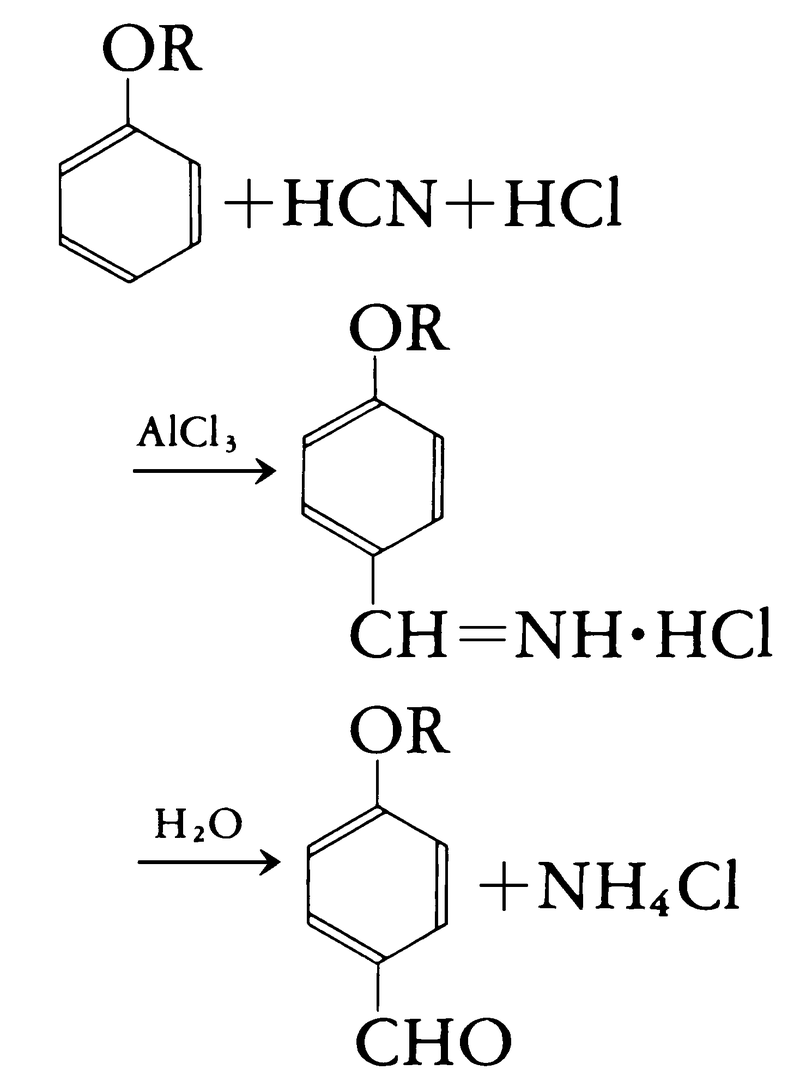
ハロゲンの求核反応によるニトリルの生成,アルデヒドやケトンと反応させてシアンヒドリンを生成し,炭素数を1個増加させる反応等が重要である。有機工業化学においてアクリロニトリル,アルデヒド,アクリル酸,メタクリル酸,乳酸等の原料として広く用いられている。また金属シアン化物も多く知られている。CN⁻は遷移金属イオンに対して配位能力が強く,各種のシアノ錯体が存在する。分析化学では妨害金属イオンのマスキング試薬としても用いられる。シアン化水素は毒物及び劇物取締法で毒物に指定されている。その毒性は,生体組織中の各種酵素と可逆的に結合してその作用を妨げることによる。最も結合しやすいのは組織の呼吸に重要な働きをするチトクロム酸化酵素である。致死量0.06g,人は数秒で死に至り,気体濃度100~180ppmでは数十分から数時間で致命的である。シアン化水素ガスの取扱いは性能のよいドラフト中で行う必要がある。検出にはベンジジン-酢酸銅試験紙,メチルオレンジ-塩化水銀(Ⅱ)試験紙などが用いられる。
執筆者:漆山 秋雄
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「シアン化水素」の解説
シアン化水素
シアンカスイソ
hydrogen cyanide
HCN(27.03).青酸ガス(prussic gas)ともいう.生物体にも存在する.たとえば,ウメの実などのアミグダリンは,HCN,ベンズアルデヒド各1分子と,グルコース2分子が結合した配糖体である.実験室では,シアン化アルカリまたはK4[Fe(CN)6]に酸を作用させると得られる.工業的には,プロピレンとアンモニアからアクリロニトリルを合成する際に副生物として得られる.気体は直線状ニトリル型分子H-C≡N.H-C1.06 Å,C-N1.15 Å.低温の液体でもイソニトリル型分子H-N≡Cは1% 以下と考えられる.結晶は-102.8 ℃ では正方晶系,これより低温では斜方晶系.いずれも固体内では…N≡C-H…Nのように,水素結合で鎖状につながっている.C-H…N約3.18 Å.特異臭がある.密度0.687 g cm-3(20 ℃).融点-13.3 ℃,沸点25.7 ℃.水とは任意の割合にまじる.エタノールに易溶,エーテルに可溶.水溶液はシアン化水素酸である.普通の純度のものは液体状態で,しだいに重合して褐色の爆発性の固体になる.重合はアルカリで促進される.空気中で点火すると,紫がかった炎を上げて燃える.水溶液中では加水分解して,ホルムアルデヒドを経てギ酸とアンモニアになる.還元するとメチルアミンになり,アルデヒドまたはケトンと反応してシアンヒドリンになる.アセチレンに付加してアクリロニトリルになり,1,3-ブタジエンに付加してアジポニトリルとなる.また,HCN液体は双極子モーメントが大きく(2.99 D),金属塩もよく溶かす溶媒である.有機合成の原料(アクリロニトリル,メタクリル樹脂,ナイロン,シアン化物,塩化シアン,乳酸,そのほか農薬など),冶金,密閉船倉や倉庫の殺虫・殺そ剤などに用いられる.猛毒(致死量:約60 mg,許容濃度10 mg/m3).[CAS 74-90-8]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「シアン化水素」の意味・わかりやすい解説
シアン化水素【シアンかすいそ】
→関連項目シアン化水素酸
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「シアン化水素」の意味・わかりやすい解説
シアン化水素
シアンかすいそ
hydrogen cyanide
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「シアン化水素」の解説
シアン化水素
世界大百科事典(旧版)内のシアン化水素の言及
【ガス化学】より
…これらの新たな需要が大きく開かれれば,メタノール工業は面目を一新し,重要なエネルギー・化学産業となろう。 一方,天然ガスの在来型の利用は,シアン化水素はメタンとアンモニアおよび空気を反応させてつくられる。すなわち, 2CH4+2NH3+3O2―→2HCN+6H2Oこの方法はアンドルッソー法と呼ばれる。…
※「シアン化水素」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

