アルミニウム(読み)あるみにうむ(その他表記)aluminium
精選版 日本国語大辞典 「アルミニウム」の意味・読み・例文・類語
アルミニウム
日本大百科全書(ニッポニカ) 「アルミニウム」の意味・わかりやすい解説
アルミニウム
あるみにうむ
aluminium 英語
aluminium フランス語
aluminum 米語
周期表第13族に属する金属元素。普通にみられる金属のうちでは、もっとも新しいものの一つ。
歴史
その名称は、天然産のアルミニウムを含む硫酸塩(ミョウバン)を意味するラテン語alumenに由来する。ミョウバンはすでに5世紀ごろから収斂剤(しゅうれんざい)や媒染剤などに用いられていた。粘土からミョウバンをつくる方法が17世紀に記録されており、18世紀には粘土の中に石灰と異なる塩基が含まれていることが認められていた。しかし、1809年、水素気流中で融解アルミナAl2O3の電気分解によってアルミニウム‐鉄合金が得られること、この合金を溶かした溶液からアルミナが回収されることがイギリスのH・デービーによって明らかにされるまで、その存在を証明することはできなかった。この元素に対しデービーは前述のalumenにちなんでalumiumの元素名を提案したが、のちにaluminiumとなった。単体としてアルミニウムを得るのに初めて成功したのはドイツのF・ウェーラーで、1827年塩化アルミニウムをカリウムと反応させて得た。フランスのサント・クレール・ドビルH. Sainte-Claire Deville(1818―1881)は還元法とともに電解法をも開発し、粘土を原料として電解法でかなりの量の金属アルミニウムを得て、1855年のパリの万国博覧会に「粘土からの銀」として出品した。これをみたナポレオン3世が、フランス甲騎兵の装具をこの軽金属でつくろうとして、彼を援助したことは有名である。現在、大規模な製造に利用されているアルミナと氷晶石を用いる融解塩電解法は、1886年にフランスのP・L・T・エルーとアメリカのC・M・ホールがそれぞれ独立して発明した。
[守永健一・中原勝儼]
存在
地殻中の存在度は酸素、ケイ素に次いで第3位、金属元素としては第1位で、多量に、また広く存在する。種々のアルミノケイ酸塩として、岩石、土壌の主要成分となっている。おもな鉱物には、長石、雲母(うんも)、氷晶石、ギブス石、ダイアスポア、ミョウバン石、カオリナイトなどがあり、それらが風化した粘土のほか、酸化物にはコランダム(サファイア、ルビー)など宝石として珍重されるものが多い。
[守永健一・中原勝儼]
製法
ケイ素との分離がむずかしいので、アルミノケイ酸塩を原料とすることはできない。含水酸化アルミニウムAl2O3・xH2Oの組成をもつボーキサイトが原料として用いられる。不純物として含まれる鉄とケイ素を除くため、ボーキサイトの精製が必要となる。原料を加圧下で濃い水酸化ナトリウムの熱溶液で処理すると、酸化アルミニウムはアルミン酸ナトリウムとなって溶ける。不溶性の水酸化鉄を濾別(ろべつ)した濾液に結晶性の水酸化アルミニウムを少量加えて、空気を通しながら攪拌(かくはん)を続けると、水酸化アルミニウムが濾過しやすい粒状となって沈殿する。このときケイ酸塩は溶液中に残る。生じた水酸化アルミニウムを高温で焼いて酸化物とする。次に氷晶石を溶融し、これに酸化アルミニウムを溶かし、約1000℃、5ボルトで黒鉛を電極として電解する。電極反応は複雑であるが、見かけ上は、氷晶石に溶けた酸化物が電解されてアルミニウムと酸素になり、酸素がさらに陽極の炭素と反応して二酸化炭素または一酸化炭素を生じたことになる。普通の電解法でつくられるアルミニウムの純度は99.8%であるが、電解精製により99.99%以上の高純度のものが得られる。
[守永健一・中原勝儼]
性質
銀白色の軟らかい軽金属で、展性、延性に富み、薄い箔(はく)とすることができる。空気中に放置すると、酸化物の被膜を生じて光沢を失うが、内部まで冒されることはない。空気中で融点近くに熱すると、白光を放って燃えて酸化アルミニウムとなる。その際、多量の熱を発生する。
4Al+3O2―→2Al2O3+3338.832KJ
このようにアルミニウムと酸素とは非常に化合しやすく高温が得られるので、金属の冶金(やきん)や溶接に利用される。たとえば、酸化鉄とアルミニウムの粉末をるつぼに入れ、マグネシウムリボンで点火すると、次の反応によって生じた鉄は酸化アルミニウムに覆われて融解状態となるほどである(テルミット法)。
2Al+Fe2O3→2Fe+Al2O3+845.168KJ
この方法はクロム、マンガンなどの酸化物から金属を製造するのにも使われ、ゴルトシュミット法と総称されている。熱すると窒素、硫黄(いおう)、炭素などと直接結合して、窒化物、硫化物、炭化物などとなる。ハロゲンとも反応しやすく、塩素、臭素中では激しく燃えて塩化アルミニウム、臭化アルミニウムとなる。塩酸、硫酸に溶けてそれぞれ塩化物、硫酸塩をつくるが、濃硝酸には酸化物の被膜を生じ、かえって冒されにくくなる。これを不動態とよんでいる。電気的にアルミニウムの表面に酸化物をつくり、耐銹(たいしゅう)性にしたものがアルマイトである。アルミニウムは水酸化アルカリ溶液に水素を放って溶けてアルミン酸塩となる。
[守永健一・中原勝儼]
用途
金属は展延性に富み、比重が小さく、熱、電気の良導体で、大気中での耐食性が優れているため、板、箔、棒、線、管、型材などあらゆる形に加工されて利用されている。高反射率をもつため高純度アルミニウムは光学機器などの反射鏡に用いられる。また電解コンデンサー箔、磁気ディスク、レーザー用反射鏡、集積回路用蒸着材などに用いられる。その軽さを利用して航空機、自動車、船舶、鉄道に、電気の良導体であることを利用して送電線などに使われている。Al-Cu系合金はジュラルミンとよばれる。また、食品工業、食器類などでのアルミニウムの利用は、耐食性と人体に害のないことによる。そのほか、ペイント、アルミニウム箔による包装、建築材料や原子炉材など、きわめて広範囲の用途が知られている。このような金属または合金としての用途のほかに、多くの化合物が利用される。化合物は、イオン結合性と共有結合性の境界付近にあるようにふるまう。ミョウバンなど硫酸塩、塩化アルミニウム、アルミナ、水素化物とヒドリド化合物および有機アルミニウム化合物などが、それぞれ各種の目的に利用されている。
[守永健一・中原勝儼]
アルミニウム(データノート)
あるみにうむでーたのーと
アルミニウム
元素記号 Al
原子番号 13
原子量 26.98154
融点 660.4℃
沸点 2467℃
比重 2.6989(測定温度20℃)
結晶系 立方
元素存在度 宇宙(Si106個当りの原子数)
8.51×104(第12位)
地殻 8.23%(第3位)
海水(/mgL-1)0.01
改訂新版 世界大百科事典 「アルミニウム」の意味・わかりやすい解説
アルミニウム
aluminium
周期表第ⅢB族に属する金属元素の一つ。その単離に努力したイギリスのH.デービーによって,ミョウバンKAl(SO4)2・12H2Oのラテン名alumenにちなんでaluminumと命名され,のちにaluminiumとなったが,現在でもアメリカではaluminumとつづる。1827年ドイツのF.ウェーラーは,塩化アルミニウムの金属カリウムによる還元によって金属アルミニウムを単離し,初めてその性質を正確に記述したので,ふつう彼がこの元素の発見者とされている。一般の人々にこの金属が紹介されたのは,その工業的製造法を研究したフランスのドビーユHenri Étienne Sainte-Claire Devilleが55年のパリ万国博覧会にこれを出品したときである。
アルミニウムは,アルミノケイ酸塩鉱物などとして広く地球上に存在し,地殻中の存在度は酸素,ケイ素に次いで第3位であるが,金属元素としては第1位である。おもな鉱物としては,長石,雲母,ボーキサイト,氷晶石,カオリナイトなどがあるが,とくにボーキサイトはアルミニウム生産の最重要鉱物である。宝石としてのサファイアおよびルビーの本体は,ともにアルミニウムの酸化物Al2O3で,コランダムと呼ばれる鉱物の一つである。
性質
銀白色の金属(面心立方格子)で,通常使用される金属のうちではマグネシウムに次いで軽く(鉄の約1/3),延性,展性が大きく,薄い箔にすることができる。熱伝導度は0.487cal/cm・s・deg(20℃)で,鉄の3倍,銅の半分である。また,磁性をもたず,電気の良導体で,比抵抗は2.75×10⁻6Ωcm(20℃)である。硬度はあまり大きくない(モース硬度2.9で,スズと亜鉛の中間)。融解の際の潜熱が大きいので,融解には時間,エネルギーを要する。金属表面は可視光線や紫外線に対する反射率が高く,アルミニウム蒸着面は光学系用の鏡として利用される。純度の高いアルミニウムは空気や水に対してきわめて強い。これは表面に薄い酸化物皮膜を生じて内部を保護するためである。しかし高温になると急に酸化が進行し,融点近くに熱すると強い光を発して燃焼し,酸化アルミニウムAl2O3となる。酸には溶けるが,濃硝酸には酸化物皮膜をつくるため比較的侵されにくい。アルカリには水素を発生して溶けてアルミン酸塩となる。99.950%の純度をもつアルミニウムは耐酸性があり,硝酸,濃硫酸などの容器に使用されるが,王水,アルカリには侵される。またアルミニウムは,一般に高温では反応性が大きくなり,窒素,炭素,ホウ素,ケイ素,リン,硫黄など多くの非金属元素とも直接化合物をつくる。
執筆者:水町 邦彦
用途
軽く,耐食性に優れ,美しい光沢をもち,展伸性,延性,鋳造性などの加工性に富み,電気の良導体であるといったアルミニウムの基本的特色は,さまざまな微量合金元素の添加によってさらに強化され,ジュラルミンをはじめ各種のアルミニウム合金として実用化されており,電線,建築材料,航空機,自動車,機械工具,器具什器,包装材料などの広い用途をもっている。また,アルミニウムおよびアルミニウム合金は陽極酸化処理(アルマイト)によって,表面に緻密(ちみつ)な皮膜を形成させて耐食性を向上させたり,同時にこの皮膜にいろいろな色調をもたせることができる。このような表面処理技術の発展も用途の拡大を促している。アルミニウム粉末と酸化鉄Fe2O3粉末の混合物(テルミットthermit)に点火するとアルミニウムが酸化され,酸化鉄は還元されて鉄になるが,この際に発する高熱は鉄の溶接(テルミット溶接)に利用される。アルミニウムのこの化学的活性は,クロム,マンガン,バナジウムなどの酸化物を還元して金属を得る冶金法(テルミット法)にも利用されている。
→アルミニウム合金
製法
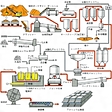
金属アルミニウムは,ボーキサイトを原料とし,バイヤー法による高純度アルミナの製造,およびアルミナのホール=エルー法による電解還元によって製造される。原料のボーキサイトは,フランスの〈ボー村の土〉という語源をもち,風化によって生成した土壌のうち,アルミナ含有量が高くシリカ含有量の低いものをいう。標準的には,アルミナAl2O350%,シリカSiO25%,酸化鉄Fe2O310%,水分H2O30%,その他5%という組成であり,熱帯,亜熱帯地方に多く産出する。確認埋蔵量は150億tを超え,資源枯渇の心配はないとされている。バイヤー法は,1888年にオーストリアのK.J.バイヤーが発明して以来,ボーキサイトから高純度アルミナをつくるための最も経済的な方法として利用されている。
ホール=エルー法は1886年にアメリカのC.M.ホールとフランスのP.L.T.エルーによって独立に発明された方法で,その原理は次のとおりである。900℃の高温でフッ化アルミニウムとともに溶融させた氷晶石Na3AlF6中でアルミナをイオンとして溶解し,
Al2O3─→2Al3⁺+3O2⁻
炭素を陽極としてこれを電解する。陽極では溶解している酸化物イオンO2⁻が酸化されて炭酸ガスとなり,陰極ではアルミニウムの還元生成が起こる。
2/3C+3O2⁻─→2/3CO2+6e⁻ ……(陽極)
2Al3⁺+6e⁻─→2Al ……(陰極)
ファラデーの法則によれば,アルミニウム1tを製造するのに必要な電気量の理論値は2980kAhと計算されるが,反応の効率を考慮すると実際には3300kAh程度必要となる。電解槽の電圧はふつう約4Vであり,両者の積として約1万3200kWhの電力が1tのアルミニウム製造に必要となる。陽極炭素として,あらかじめ焼成炉でブロック状に仕上げた既焼成電極を用いるプリベーク方式と,ペーストを装入して電解炉の余熱で焼成する連続自己焼成電極を用いるゼーダーベルグ方式の2者がある。1炉の容量が120kA以上の大容量電解槽ではプリベーク方式が多く用いられ,最大170kAくらいのものまでできている。
ホール=エルー法が,1886年に発明されて以来,アルミニウム製造の唯一の工業的方法として発展してきたのは,(1)取扱いの容易なアルミナを中間原料とし,しかも1段のプロセスですむ,(2)陽極炭素の利用効率が高い,(3)製品の純度が高く,とくに炭素や酸素を含まない,の3点で他の方法の追随を許さないからである。ボーキサイトを原料として高純度アルミニウム(99.5%以上)を製造する方法は種々研究され,いくつかの可能な方法の提案がなされてきたが,全工程を通じてのエネルギー消費量は現在のバイヤー法とホール=エルー法の組合せが最も低く,将来にわたってもこの状況は変わらないと思われる。ホール=エルー法の欠点は,電解炉という二次元反応装置を使うために生産性が悪く,生産量当りの工場面積が広くなる点くらいのものである。超高純度(99.95%以上)のアルミニウムを得ることは通常の電解法では困難であり,ふつう三層電解法という精製方法で製造される。下層は原料となるアルミニウムを銅との合金にして溶解し,これを陽極として利用する。中層の電解浴は金属アルミニウムよりも密度の大きい溶融塩を使う。上層は製品である超高純度アルミニウムで,電解浴上に浮いた形で今これを陰極として利用する。
全世界での生産能力は1980年で1500万tに達し,金属素材としては銅を抜いて第2位の生産量となっている。日本では1973年に110万tの生産を行ったが,石油危機後は火力発電に頼る電力代金の高騰のために減産を強いられている(1993年における世界の生産量は1600万t,日本の生産量は約40万tである)。
→軽金属工業
執筆者:増子 昇
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「アルミニウム」の解説
アルミニウム
アルミニウム
aluminium
Al.原子番号13の元素.電子配置[Ne]3s23p1の周期表13族金属元素.原子量26.981538(2).質量数27の単核種元素,質量数22~37までの14種の放射性核種が存在する.元素名は古くから知られていたミョウバンalumのラテン名alumenから.IUPACではaluminiumであるがアメリカでは広くaluminumが用いられてる.宇田川榕菴は天保8年(1837年)に出版した「舎密開宗」で亜律密烏母(アリュミウム)としている.1825年にデンマークのHans Christian φrstedによって発見され,1827年にF. Wöhler(ウェーラー)によって金属が得られた.
地殻中の存在度84100 ppm で,地球上に広く,かつ多量に存在する.多くの金属のアルミノケイ酸塩として,岩石・土壌の重要成分である.鉱物として長石,雲母などが代表的である.ルビー,サファイアは不純物を含んだAl2O3.資源としての鉱物はボーキサイト(酸化アルミニウム水和物).オーストラリアが主要産出国で,2006年の産出量6140万t は世界の産出量17700万t の35%.続いてブラジル2100万t,中国2000万t,ギニア1500万t,ジャマイカ1490万t.採掘可能埋蔵量では,世界の25000(単位百万t)のうち,ギニア7400,オーストラリア5800,ジャマイカ2000,ブラジル1900.2006年の地金全生産量は3400万t で,中国930万t,ロシア370万t,カナダ310万t,アメリカ230万t,オーストラリア190万t の順である.国内では電解精錬のコスト高から,ほとんど全量を地金で輸入している.同年の輸入量は230万t で,オーストラリア60万t,ロシア37万t,ブラジル22万t,ニュージーランド21万t,カナダ15万t.このほか,再生地金が国内生産140万t,輸入70万t で,計440万t である.
製錬は,まずバイヤー法でアルミナにして,これをHall-Heroult法で溶融氷晶石中の溶融塩電解により行う.Hall-Heroult法は,1866年にアメリカのCharles HallとフランスのPaul L.T. Heroultが独立に発明した.
銀白色の軟らかい軽金属.電気・熱の良導体.密度2.6989 g cm-3.融点660.4 ℃,沸点2470 ℃.硬度2.8.第一イオン化エネルギー577.5 kJ mol-1(5.98 eV).電子親和力42.5 kJ mol-1.電極電位-1.676 V.通常の酸化数3.軟らかく,展延性に富み,アルミはくに加工される.容易に酸素と反応するので,空気中では金属表面は酸化物で覆われている.純金属は酸素と白色炎を発して酸化物Al2O3になる.ハロゲンとも活発に反応して三ハロゲン化物をつくる.酸化数3の化合物をつくる.両性元素で酸にもアルカリにも反応する.希塩酸に易溶,希硫酸にはゆっくり溶ける.水酸化アルカリとはアルミン酸塩M[Al(OH)4]を生成する.酸化皮膜に覆われていないときは,水とも反応する.
軽量で強力な材料として,広く建築,輸送,パッケージなどに用いられる.家庭でもアルミ缶,アルミはくなどとして多量に使われる.電気伝導率は銅の6割程度であるが,軽さと低価格のために架空送電線に使われている.光沢からアルミ蒸着膜は望遠鏡のミラーに,合成ルビー,サファイアはレーザー材料として用いられる.強力合金,たとえばジュラルミンの材料としても重要である.国内需要の内訳は,自動車,鉄道車両など陸運車両用など輸送機器向け40%,建築資材,サッシなど建築分野向け15%,アルミ缶・アルミはくなど食品・容器包装向け10% などとなっている.[CAS 7429-90-5]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「アルミニウム」の意味・わかりやすい解説
アルミニウム
→関連項目ジュラルミン|チタン合金|非鉄金属
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「アルミニウム」の意味・わかりやすい解説
アルミニウム
aluminium; aluminum
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「アルミニウム」の解説
アルミニウム
リフォーム用語集 「アルミニウム」の解説
アルミニウム
出典 リフォーム ホームプロリフォーム用語集について 情報
世界大百科事典(旧版)内のアルミニウムの言及
【アルミニウム合金】より
…アルミニウムを主体金属とする合金の総称。アルミニウムAlに強度を高めるなどの目的で,銅Cu,マグネシウムMg,ケイ素Si,亜鉛Zn,マンガンMn,ニッケルNiなどを加えた多数の合金がある。…
【軽金属工業】より
…金属工業のうち,比重の比較的小さい金属,すなわち軽金属を扱う工業。軽金属には,アルミニウム,マグネシウム,チタン,ベリリウム,リチウムなどがあるが,とくにアルミニウムは鉄に次いで生産量が多く,軽金属の代表であるので,ここではアルミニウム工業を中心に述べる。
[アルミニウム]
原鉱石(ボーキサイトなど)からアルミナAl2O3を製造する化学的工程と,その電解工程(アルミ1t当り約1万5000kWhを要する)の2過程を要する高度な電気化学工業で,その発達には苛性ソーダ,フッ化物,電力など関連工業の発達,高品位の原鉱石ボーキサイト(Al2O350%以上含有)と,豊富で安価な発電地帯を有することが条件となる。…
※「アルミニウム」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...