共同通信ニュース用語解説 「心筋梗塞」の解説
心筋梗塞
心臓の筋肉に酸素や栄養を送る冠動脈の動脈硬化が進んで血管がふさがり、周辺の心筋細胞が
更新日:
出典 共同通信社 共同通信ニュース用語解説共同通信ニュース用語解説について 情報
精選版 日本国語大辞典 「心筋梗塞」の意味・読み・例文・類語
しんきん‐こうそく‥カウソク【心筋梗塞・心筋硬塞】
- 〘 名詞 〙 心臓の冠動脈に急性に血流が減少ないし停止することにより、心筋の壊死(えし)を起こした状態。冠動脈の血栓によることが多い。前胸部激痛、血圧の低下、ショック状態を示し、死亡することが少なくない。中年以後に多い成人病。
- [初出の実例]「心筋が死んで心筋梗塞という面倒な病気になる」(出典:薬の効用(1964)〈佐久間昭〉一五)
内科学 第10版 「心筋梗塞」の解説
心筋梗塞(虚血性心疾患)
急性冠症候群(acute coronary syndrome:ACS)は,冠動脈に急性イベントが起こって発症する病態の総称であり,急性心筋梗塞症(acute myocardial infarction:AMI)と不安定狭心症(unstable angina:UA)が含まれる.さらに急性心筋梗塞症は心電図変化からST上昇型心筋梗塞(ST elevation myocardial infarction:STEMI)と非ST上昇型心筋梗塞(non-ST elevation myocardial infarction:NSTEMI)に分類される.
このうち非ST上昇型心筋梗塞と不安定狭心症はかなり共通する部分が多く,病態生理学的には不安定狭心症からもっと重症の不可逆的心筋壊死をきたす急性心筋梗塞に至るまでの連続的な病態ととらえられるため,両者を包括して急性冠症候群と称される. 心筋梗塞は,発症からの時間軸により急性心筋梗塞(acute myocardial infarction:AMI)と陳旧性心筋梗塞(old myocardial infarction:OMI)に分類される.
(1)急性心筋梗塞
定義
急性心筋梗塞は,急激に発症した心筋虚血を原因として臨床的心筋障害・心筋壊死がとらえられた状態である.2012年に欧州・米国の学会(European Society of Cardiology, American College of Cardiology Foundation, American Heart Association)と世界心臓連合(World Heart Federation)から急性心筋梗塞として以下のような定義を使用することが勧告された. 心筋の生化学的指標の有意な変化が認められること,および以下のうち1つ以上の所見がみられる場合に,急性心筋梗塞と定義する.①心筋虚血症状②新規に起こった有意なST-T変化または完全左脚ブロック③異常Q波の出現④新たな健常心筋の喪失や壁運動異常を示す画像所見⑤冠動脈造影または剖検所見での冠動脈内血栓の同定
疫学
日本における冠動脈疾患の罹患率・死亡率は欧米先進国に比べて低い.WHOの報告では2000年における急性心筋梗塞の死亡率は人口10万人あたり男性40.6,女性32.6であり,米国の男性72.7,女性64.6の半分程度しかない.しかし米国ではこの数字が減少傾向であるのに対し,日本では増加傾向にあり,高齢化とともに食生活を含めたライフスタイルの西欧化が関連していると思われる.
病因
ACSのほとんど(90%以上)は,冠動脈の動脈硬化性プラークの破綻,それに続く血小板凝集と血栓が原因である(図5-7-20).冠動脈硬化の進行に伴い粥腫が形成され成長すると,プラークが血管内腔に張り出すようになって冠動脈造影では軽度の狭窄病変として認められるようになる.プラーク内には脂質成分,血球,血管平滑筋細胞,細胞外基質などが含まれるが,これが平滑筋と線維成分が多くなると固い線維性プラーク(fibrous plaque)になり冠動脈内に突出する.この結果冠動脈狭窄を生じて労作狭心症の原因となるが,安定化するためにACSの原因にはなりにくい(図5-7-21).
これに対してプラークが多量のやわらかい脂質コアと活性化されたマクロファージTやリンパ球を豊富に含んでいると,マクロファージやTリンパ球が蛋白分解酵素(エラスターゼ,コラゲナーゼ,メタロプロテイナーゼなど)を放出し,これによって細胞外基質が分解され線維性被膜(fibrous cap)が菲薄化する.このようなプラークを「不安定プラーク(vulnerable plaque)」とよぶが,ここに交感神経の亢進や化学的因子,動脈硬化病変に伴う物理的なストレスが加わってプラークが破綻すると,プラーク内容物や組織因子によって血小板凝集や凝固系の活性化が起こり内皮細胞の破綻による抗血栓性低下もあいまって,血栓が冠動脈内に形成される.このほかに冠動脈内皮のびらん(erosion)やプラーク内への出血でも冠動脈血栓が形成される.
冠動脈プラークに血栓が加わることにより冠動脈血流が大きく障害されるため,病変部末梢心筋に強い心筋虚血を生じて心電図上ST低下を伴う胸痛発作を起こすことになるが,ここで生体内の線溶系が活性化して血栓を一部でも溶解すると血流が回復して心筋壊死に陥る前に虚血が改善して発作が消失する.このような「せめぎ合い」状態が不安定狭心症(UA)である.ここでプラークが修復して安定化すれば安定狭心症となる.もしこの高度虚血状態が遷延して心筋壊死を起こしてしまうと急性心筋梗塞(AMI)となるが,完全閉塞になっていなければ心電図上はST低下を呈し非ST上昇型急性心筋梗塞(NSTEMI)とよばれる.このような場合,臨床的に心筋壊死の有無は心トロポニンなどの血液マーカーが,ある基準値をこえたかどうかで判断される.したがってUAとNSTEMIは心筋虚血の程度により区別されているだけの連続的な病態であることがわかる.
これに対して,プラーク破綻により形成された血栓により冠動脈の完全閉塞が持続すると,下流の心筋虚血は貫壁性となりST上昇型急性心筋梗塞(STEMI)となる.冠動脈プラーク破綻と血栓形成の機序は同じであるが,NSTEMIとは臨床所見や初期管理が異なるために,診療ガイドラインなどではNSTEMI/UAとは別に取り扱われる.
このほかにACSのまれな原因として,冠動脈スパズム,冠動脈塞栓,血管炎があげられる.冠動脈スパズムは日本人に比較的多い病態であり,冠動脈塞栓症は心内血栓を作りやすい病態-僧帽弁狭窄症や心房細動,人工弁置換術後などがおもな原因である.血管炎は全身の炎症性疾患の一部として,自己免疫疾患でまれにみられる. 冠動脈高度狭窄・閉塞による心筋傷害の大きさは,①閉塞血管が支配する領域の大きさ,②完全閉塞かどうか,③閉塞している時間,④側副血行路からの虚血領域への血流,⑤心筋虚血に陥った領域での心筋酸素需要,⑦再灌流した場合の虚血部への血流の流れ方と局所の反応に規定される.
a.ST上昇型急性心筋梗塞(ST elevation myocardial infarction)
ACSのなかで,急性期に12誘導心電図にてST上昇を認めるものはST上昇型急性心筋梗塞(STEMI)とよばれる.
臨床症状
1)自覚症状:
半数近くの症例は,急性心筋梗塞発症前に狭心発作など何らかの症状を呈するといわれている.さらに狭心症が不安定化した後に急性心筋梗塞を発症している例が,梗塞前狭心症を有する例の約半数にみられる.急性心筋梗塞発症時の典型的な症状は胸骨下部ないし左前胸部を中心とした激烈な疼痛で,押しつぶされる,締めつけられる,棒をねじ込まれる,焼かれるなどと表現され,30分から数時間持続する.左胸,胸部全体,心窩部,背部の痛みで発症することもあり,上腹部痛で発症したものは消化器疾患と誤診されることがある.同時に左肩,左上腕,頸部,下顎に関連痛をみることもある.随伴症状として,悪心・嘔吐,冷汗,意識障害などを高率に合併し,症状全体が「死の恐怖」や極度の「不安」を伴うことが特徴的である. ただし高齢者では胸痛なしに急性心筋梗塞症を発症することがある.無痛性心筋梗塞は糖尿病患者でも少なからずみられる.
2)身体所見:
大部分の例では,発症時は極度の不安と苦痛を伴った表情をしている.顔面は蒼白で冷感があり,手足の末梢には冷感があるのが普通である.合併症のない急性心筋梗塞の大半の症例では血圧・脈拍は正常範囲内にあるが,そのなかでも前壁梗塞例では交感神経緊張状態にあるため頻脈・血圧上昇傾向を示し,下壁梗塞の約半数例では迷走神経緊張状態となって徐脈・低血圧傾向を示すことが多い.
前胸部の視診では,大きな前壁梗塞などで心尖拍動が収縮期に膨隆するように観察されることがある.心室の収縮・拡張障害によりⅢ音,Ⅳ音を聴取することもまれではなく,僧帽弁乳頭筋の虚血が起こると,心尖部に僧帽弁逆流を示す収縮期雑音が聴かれることもある.発症後数日して心膜炎を併発すると心膜摩擦音が聴取される. 左心不全から全身のうっ血症状を呈するようになると,頸静脈の怒張が起こる.静脈の怒張が著明にもかかわらず,聴診上,肺野が清の場合には右室梗塞を疑う.
また,肺野での湿性ラ音の聴取は,急性心筋梗塞の予後を左右するポンプ失調の合併の診断に欠かせない重要な所見である.
検査成績
急性心筋梗塞の確定診断を行うための検査所見としては,①心電図,②血清心筋マーカー,③画像所見,④組織壊死・炎症の非特異的指標の4つがあげられる.
1)心電図:
急性心筋梗塞の心電図所見は,梗塞部位や冠動脈の状態,発症からの時間により大きく異なる(図5-7-22,5-7-23).1枚の心電図では診断確定に至らず,経時的に記録することによって診断できる場合も少なくない.
冠動脈が完全閉塞して貫壁性の急性心筋梗塞を形成した,定型的な心電図経過を図5-7-24に示す.冠動脈の急激な閉塞に伴い,ごく初期には虚血部位に相当する誘導でT波の増高が起こり,引き続きST上昇が認められるようになる.このとき虚血部とは異なる部位での誘導で対側性のST低下がみられることが重要であり,これによってST上昇部位での冠動脈のイベントであることが推定できる.そしてこのような典型的なST上昇を伴う一連の心電図変化は,冠動脈の閉塞部位に一致した広がりを示す.冠動脈の閉塞が続くとその後Q波が形成されるようになるが,その発現時期は数時間から数日と個々の病態によりかなりの開きがある.ST部分が徐々に基線に近づくようになるとT波の終末部から陰転が始まり,後に深い対称性の冠性T波を形成するようになる.その後数週間から数カ月,あるいは年の単位で陰性T波が徐々に浅くなり,最終的には陽転してしまうことも少なくない.
これに対して,急性期にこのような定型的な心電図変化を示さない例が40%近く存在する.脚ブロックなど新たな心室内伝導障害の発生も急性心筋梗塞発症時によくみられる所見であるが,ST-T変化ばかりでなく,Q波もマスクされてしまうことがあるため,診断に困難を生じる場合がある.しかしながら右脚ブロックにおけるQ波は前壁・下壁梗塞ともに評価可能であり,一般に心室内伝導障害を伴うような急性心筋梗塞は多枝病変や大梗塞・低心機能を伴う重症例が多いことに留意する必要がある.陰性U波も強い虚血発作に伴い,まれならずみられる所見である.これはⅠ,Ⅱ,Ⅴ4〜6誘導で記録されやすいが,左冠動脈前下行枝の高度狭窄による心筋虚血を反映することが多いとされている.
2)血清マーカー
: 血清マーカーは急性心筋梗塞の診断に不可欠である.特に心筋傷害のマーカーはこれまでさまざまなものが使用されてきたが,臨床的に有用な指標は,心筋特異性が高く,血中出現が早く,正常化までの時間が長いもので,計測が簡便かつ安価なものということになる.現在,急性心筋梗塞の診断と梗塞サイズなど重症度判定に用いられているマーカーを以下に示す. a)クレアチンキナーゼ(CK):CKは急性心筋梗塞発症後4時間から上昇しはじめ,冠動脈閉塞が続くと約24時間で最大値となり,2~3日で正常化する.この際のピークCK値や血中CK値を積分して得られるCK総流出量が心筋梗塞サイズとよく相関することが知られており,急性心筋梗塞の予後マーカーの1つとして使用されてきた.ただ再灌流療法などで冠血流が再開すると組織からのウォッシュアウト効果により早期により大きなCKのピークが認められる.この場合にはピークCKも梗塞サイズの推定には役立たないことになる.CKは心筋以外の筋疾患,激しい運動後,筋肉注射後,肺梗塞でも上昇する. b)CKアイソザイム,CK-MB:CKは電気泳動によってCK-MM(骨格筋型),CK-MB(心筋型),CK-BB(脳,腎臓型)に分かれ,心臓にはCK-MMとCK-MBが存在する.CK-MBは骨格筋に存在せずほぼ心筋特異的であるため,臨床的に有用な急性心筋梗塞症のマーカーである.ただCK-MBの上昇の程度は総CKに比べて小さいため,経時的な採血が必要で総CKとの比で2.5%以上であれば心筋傷害が存在する可能性が高いといわれている.最近は後述の心筋特異的マーカーの出現により,その臨床的意義は小さくなりつつある. c)心筋特異的トロポニン:トロポニンT(TnT)とトロポニンI(TnI)は心筋および骨格筋に存在するが,心筋特異的なアイソザイムが存在するため心筋に特異的なモノクローナル抗体を産生することが可能になった.この抗体を用いて心筋特異的トロポニンT(cTnT),トロポニンI(cTnI)の定量的測定が広く行われるようになった.両者ともに心筋特異性が高く,正常では末梢血中に存在しないため,測定値のカットオフレベルを低く設定することができる.ひとたび心筋傷害が起こるとcTnT,cTnIは正常の20倍以上の上昇を示し,しかもこれがcTnTでは10~14日,cTnIでは7~10日持続するため,急性心筋梗塞が疑われるが典型的な所見は認められない場合などにきわめて有用なマーカーである.このため前述の急性心筋梗塞の定義にはこのトロポニンを使用することが推奨されている. d)その他のマーカー:ミオグロビンは急性心筋梗塞発症後1~2時間で上昇し,4時間でピークを迎えるきわめて動態の早いマーカーである.心筋特異的でないためその役割は補助的ではあるが,発症超早期のマーカーとしての有用性が認められる.このほか,ミオシン軽鎖(myosin light chain:MLC),心臓脂肪酸結合蛋白(heart fatty acid binding protein:hFABP)などが心筋特異的マーカーとして使用されているが,CKやcTnT, cTnIに比べて優位性が認められるまでには至っていない. e)非特異的炎症マーカー:急性心筋梗塞発症後,梗塞部での炎症性変化に伴い,白血球数やCRPなどの非特異的炎症マーカーも上昇し,ときに1週間以上持続することがある.
3)画像診断:
a)心臓超音波検査:急性心筋梗塞の画像診断法として現在最も汎用されている検査法である.急性心筋梗塞ではすべてといってよい症例で壁運動異常が存在する.左室壁運動異常は責任冠動脈病変の部位に応じて現れるため,左室を16分画し壁運動を評価することで冠動脈病変部位の想定が可能である.ただ超音波検査では,検出された壁運動異常が急性心筋梗塞によるものか陳旧性心筋梗塞の瘢痕によるものか,あるいは一過性の虚血によって生じているものかの区別は不可能である.このほか,右室梗塞,心室内血栓,心室瘤,心膜液貯留,心室中隔破裂(ドプラ検査併用により)など,急性心筋梗塞におけるさまざまな病態を検出することが可能である. b)心臓核医学検査:検査が煩雑であることと感度・特異度の問題から急性心筋梗塞の診断に一般的に利用されるまでには至っていない.201Tl心筋シンチグラム,99mTc-セスタミビでは虚血部位は欠損像として描出されるが,これ自身は急性心筋梗塞の部位を表すものではない.急性心筋梗塞の部位を同定するのに99mTc-ピロリン酸を用いて陽性像として描出する方法があるが,急性心筋梗塞発症後3~7日の間に施行しなくてはならないなど煩雑なため,実際の施行はほかの検査で梗塞部の同定が難しい場合などに限られるのが現状である.
診断
2012年に勧告された定義に基づき,心筋の生化学的指標の有意な変化(特に心筋トロポニンの上昇の確認が推奨されている)が認められること,下記の所見のうち1つ以上がみられる場合に急性心筋梗塞と診断する.①心筋虚血症状②新規に起こった有意なST-T変化または完全左脚ブロック③異常Q波の出現④新たな健常心筋の喪失や壁運動異常を示す画像所見⑤冠動脈造影または剖検所見での冠動脈内血栓の同定 実際には,胸痛で受診した患者のうち急性心筋梗塞であったのはごく一部であること,また急性心筋梗塞症例でも定型的な心電図変化を呈する症例は全体の半分以下であることから,これらの疑わしい所見に心筋の生化学的指標の上昇をもって急性心筋梗塞と診断される例も少なくないのが現状である.
鑑別診断としては,表5-7-5に示した疾患があげられる.
初期情報のまとめ
急性心筋梗塞の診断は前述の情報を総合することにより可能であるが,臨床現場では患者の初期情報を統合・分類・整理することにより,病態の特徴と重症度を判定し,初期治療の意思決定を行わなくてはならない.以下にそのなかでも重要なものについてあげる.
1)梗塞部位:
心筋梗塞の部位や範囲は,心エコーや核医学検査などの画像検査を用いて詳細に同定できるようになったが,診断名としての梗塞部位は原則として心電図診断である.Q波梗塞ではQ波の出現した誘導,非Q波梗塞ではR波の減高した誘導(R波減高もない例ではST上昇の誘導)から,表5-7-6を参考に梗塞部位を表現する. 右室梗塞については心電図所見だけからの部位診断ではなく,その診断基準については後記する. 一方,非Q波梗塞でQRSの変化に乏しく,ST低下型の心筋梗塞症例では心電図からの梗塞部位診断がしばしば困難な場合がある.心室内興奮伝導異常(左脚ブロック・WPW症候群など)や心室ペーシングリズムの例でも同様に部位診断は困難である.このような症例では,心エコーや核医学検査所見と合わせて梗塞部位を判定することになる.
2)Q波梗塞・
非Q波梗塞:
異常Q波の出現の有無からQ波梗塞(QMI),非Q波梗塞(NQMI)に分類する.以前は貫壁性,非貫壁性という表現が用いられたが,臨床的な所見から病理組織学的所見を推定することが困難なことがあるため,心電図所見をそのまま使用した表現が一般的になっている.
異常Q波の定義は,原則として幅が0.04秒以上で,深さがR波の25%以上とされるが,後壁梗塞ではV1のR/Sが1以上でRの幅が0.04秒以上の場合,Q波梗塞と同等として扱われることが多い.
3)発症からの時間と心筋梗塞のステージ分類:
心筋梗塞は発症後以下の3つのステージに分けることができる.①急性期(発症後数時間から7日まで)②回復期(7~28日)③治癒期(29日以降) 心筋梗塞を診断する際にはこのような病期のどの時点にいるのかを認識しながら,検査のデータを解釈することが重要である.施設によって若干基準は異なるが,①が急性心筋梗塞であり,それ以降は陳旧性心筋梗塞となるが,②をRMI(recent myocardial infarction),③をOMI(old myocardial infarction)と区別してよぶこともある.
4)来院時のバイタルサインとポンプ失調の程度:
来院時にショック症状を呈しているものは,現在でも死亡率が高い超重症例である.この心原性ショックを含め,来院時のポンプ失調の程度から急性心筋梗塞を分類したのがKillip分類(表5-7-7)であり,現在でも急性心筋梗塞の初期情報の1つとして重要である.
管理
1)発症から病院まで:
STEMIの院内死亡率は,CCUの管理と冠再灌流療法の普及により7%前後となったが,これは真の死亡率ではない.病院到着前,すなわちSTEMI発症早期に総STEMI患者の14%が心室細動による心停止に陥り死亡している.この心室細動は心臓性院外突然死例の60%を占める.より迅速なAEDによる電気的除細動が生存率を有意に改善させることが知られており,STEMIの発症超早期の患者教育と病院前救護対策が重要である.わが国でも公共の場にAEDが設置され始めた.AED使用を含む市民による迅速な119番通報と迅速な心肺蘇生法(cardiopulmonary resuscitation:CPR)の啓蒙・普及がますます重要になっている.
したがって入院前治療における重要な要素は,①症状が起こったら患者に早く救急隊あるいは病院にアクセスしてもらうこと,②電気的除細動を含めた心肺蘇生が施行できる救急チームを一刻も早く患者のもとへ派遣すること,③高度蘇生術および心臓救急が行えるスタッフをそろえた医療施設に速やかに移送すること,④迅速な再灌流療法の開始があげられる.このなかで通常最も時間がかかっているのが,①の症状が出てから患者が助けを求めて連絡するまでの時間(patient’s delay)であり,この改善には普段からの心臓発作に対する地域での教育が不可欠である.
2)救急治療室での初期管理:
急性心筋梗塞の疑われる患者,または診断された患者が到着した場合には,疼痛のコントロール,初期情報からの重症度評価,および再灌流療法の適応決定がポイントである.救急室における診療の流れを図5-7-25に示す.
初期評価から患者の病状に応じて適切な薬剤の投与を行う.特に心原性ショック例・顕性心不全例では,ショック・心不全状態からの早期離脱を最優先とした薬剤の選択を行う.また低酸素血症が存在する場合には酸素投与を開始する.
血行動態が安定している場合には,禁忌がなければまずアスピリンを投与する.
胸痛の持続は患者の不安を増強させ,心筋酸素需要増加の原因となるため,早急に軽減させる必要がある.血圧低下や高度徐脈がない例ではまずニトログリセリンの舌下投与を試み,左室前負荷軽減と梗塞関連血管および側副血行路の拡張による虚血の改善を試みる.効果がみられた場合には,静脈内投与で硝酸薬を継続する.これが無効のときには速やかにモルヒネなどの麻薬性鎮痛薬を投与する.モルヒネはニトログリセリンと同様に静脈性の血管拡張作用を有するため,肺うっ血を有する例では前負荷軽減の効果を期待できるが,それ以外の例では前負荷低下による血圧低下に注意する必要がある.
β遮断薬は発症早期からの使用により梗塞サイズの縮小や合併症の発生率低下が得られることが知られている.β遮断薬の禁忌(表5-7-8)がなければ,短時間作用型の薬剤を少量から投与を開始し,効果がみられれば内服薬に移行する.
下壁梗塞に伴う第Ⅱ度房室ブロック,低心拍出を伴う洞機能不全などの徐脈性不整脈がみられる場合には,迷走神経遮断作用を有するアトロピンが有効である. この間に標準12誘導心電図を記録する.ここまでの処置は目標10分以内で行い,ST上昇が確認されてSTEMIと診断したら,直ちに再灌流療法に向けて準備を行う.
3)急性期再灌流療法の適応と実施方法:
再灌流療法には,血栓溶解療法とPCI(経皮的冠動脈インターベンション)治療がある.最近の研究報告から緊急PCIが可能な場合にはPCIが優先されるが,STEMIではいかに早期に良好な再灌流を得るかが短期および長期予後を左右する.冠動脈血流の程度を血管造影で分類したものにTIMI(thrombolysis in myocardial infarction)分類があるが(表5-7-9),ここで“良好な血流”とは冠動脈造影上いったん閉塞していた冠動脈枝が末梢まで良好に造影されるTIMI 3の血流を指す.
患者が来院した場合の救急治療室での診断アルゴリズムを図5-7-26に示す.STEMIでは早期の再灌流療法施行が予後に大きく影響するため,早期診断,早期治療が重要である.図5-7-25に示すように,患者到着後10分以内にバイタルサインのチェック,連続心電図モニターを行い,簡潔かつ的確な病歴聴取とともに12誘導心電図を記録し,血液生化学検査を行う.STEMIと診断して再灌流療法適応と判断した場合には初期管理は時間との勝負であり,血栓溶解療法の場合は患者到着から血栓溶解薬投与開始までの時間(door-to-needle time)を30分以内に,PCIでは患者到着から閉塞部のバルーン拡張までの時間(door-to-balloon time)を90分以内にすることが目標である. 緊急PCIが可能な施設の場合の対応アルゴリズムを図5-7-26に示す.発症後12時間以内は原則PCIを優先するが,そのときの施設の状況で血栓溶解療法を先行する場合がある.発症後12時間以上経っている場合でも胸痛やST上昇が続いていれば早期にPCIが選択される.緊急PCIが施行できない施設の場合には,できるだけ早くPCI可能施設へ転送が原則であるが,この場合血栓溶解療法を先行させるかどうかは転送に要する時間を考慮しながら転送先と相談して決定する.
緊急PCIの手順は,大腿動脈または橈骨動脈など上肢の動脈からカテーテルを挿入し,ガイドワイヤーを閉塞冠動脈に進める.閉塞部通過に成功したら最近は血栓吸引カテーテルを用いて血栓吸引を行うことが多い.その後は通常ステントを充塡したバルーンカテーテルを挿入して病変部を拡張しステントを留置する.使用するステントにはベアメタルステント(BMS)と薬剤溶出性ステント(DES)があるが,どちらを使用するかは患者の状態や抗血小板薬の長期管理上の特徴を考慮して決定する(図5-7-27).
血栓溶解療法に用いられる薬剤にはウロキナーゼ,組織型プラスミノーゲンアクチベーター(tissue plasminogen activator:t-PA)があるが,静注用には一般に血栓選択性のt-PAが使用されている.血栓溶解療法には表5-7-10に示す禁忌と注意事項がある.
4)早期の一般的処置と薬物療法:
初期治療終了後はCCUにて集中監視を行いながら治療を継続する.緊急PCI施行例では,待機的PCIに準じてヘパリンを使用する.さらに,まれではあるが重大な合併症であるステント血栓症を予防するため,抗血小板薬としてアスピリンに加えてクロピドグレルなどチエノピリジン系薬剤を併用する.
これに加えて,急性期からの投与により心筋酸素需要の抑制,梗塞サイズの縮小,左室リモデリング予防効果を有するβ遮断薬とACE阻害薬またはアンジオテンシン受容体遮断薬(ARB)硝酸薬を投与する.さらに近年急性期からの投与が虚血イベント減少をもたらすことが報告されたスタチンも早期に開始される. 硝酸薬については,予後改善効果については明らかではないものの,虚血症状が持続する場合,高血圧,心不全合併例で,虚血部位の灌流改善や壁ストレス軽減による酸素需要低下効果を期待して投与が推奨されている.
5)早期合併症とその対策:
a)不整脈:急性心筋梗塞に伴う不整脈は発症後きわめて早期に発生し,病院収容前の心室細動に対する対処が重要であることは前述のとおりである.厳重な心電図モニターと適切な対処により,急性心筋梗塞後の不整脈管理は格段の進歩を遂げている.①心室性期外収縮:頻回,多源性,あるいは拡張早期に発生する心室性期外収縮は,心室頻拍,心室細動予防のための薬物療法の適応である.これ以外の場合に,「予防的」リドカインなどの抗不整脈薬の投与は根拠がないことが知られている.低カリウム血症,低マグネシウム血症などの是正がまず求められる.薬物療法としては急性期には静注のリドカインが用いられるが,長期的にはβ遮断薬が有効であることが知られている.②心室頻拍・心室細動:急性心筋梗塞発症24時間以内では,何の警告もなく突然心室頻拍,心室細動が起こりうる.以前はこの予防にリドカインが用いられてきたが,徐脈や心停止のリスクを上げるだけで重篤な心室性不整脈の予防効果が明らかでないことがわかり,現在ではβ遮断薬の投与が最も一般的である.心室頻拍が起きても血圧など血行動態が安定していれば,リドカイン静注で洞調律への復帰を期待できるが,血圧低下例や心室細動では速やかに電気的除細動を行う.急性心筋梗塞発症後72時間以内に発生する心室頻拍は,長期予後には影響しないとされている.しかしながら,これ以降に生じた心室頻拍は遠隔期の突然死など予後にかかわる可能性があるため,電気生理学的検査で重症度を判定して植え込み型除細動器の適応を決定する.③上室性不整脈:急性心筋梗塞急性期の交感神経系の活性化に伴う洞性頻脈が最も多くみられ,程度が強く心筋酸素需要を大きく増加させていると考えられる場合にはβ遮断薬を投与する必要がある.次に多いのが左室機能不全に伴う左房圧上昇が原因で生じる心房粗・細動である.ジゴキシンが心拍数コントロールに有用であるが,もし急性心不全の状態でなければβ遮断薬も有効である.これらが持続して心機能低下の一因となっている場合には電気的除細動を施行する.④洞徐脈:右冠動脈閉塞による下壁梗塞では,迷走神経刺激状態になるためによくみられる状態である.高度の徐脈にはアトロピン静注が用いられるが,持続する場合には一時的ペースメーカを挿入することもある.イソプロテレノールを投与して心拍数を上げることは,重篤な頻脈性心室不整脈を誘導することがあり避けることが望ましい.⑤房室ブロック,心室内伝導障害:下壁梗塞でよくみられる不整脈であり,迷走神経緊張および刺激伝導系の虚血の両方が原因となって発生することが多い.一時的ペースメーカを挿入して右室ペーシングを行うことが,最も確実で有効な治療手段である.多くの例では数日から1週間で回復してペースメーカを抜去することができ,恒久的ペースメーカが必要になる例はまれである.
b)ポンプ失調:急性心筋梗塞発症後,左室では梗塞部・非梗塞部ともにサイズや壁厚,壁運動に大きな変化が起こる.発症直後から左室は拡張を始める.最初は梗塞部心筋のロスから壁の菲薄化が起こって膨隆してくるが,その後非梗塞部においても残存心筋に過大なストレスがかかりつづけるために心室の拡大が起こってくる.このような過程を左室リモデリングとよぶ.このような左室リモデリングは急性期の硝酸薬投与でわずかながら抑制できることが知られており,心筋虚血の改善とともに急性期に硝酸薬の持続静注を行う根拠になっている.長期的にはACE阻害薬が左室リモデリングを抑えることが知られており,心機能低下のあるなしにかかわらず梗塞後のACE阻害薬投与が推奨されている.
c)血行動態モニターと心機能曲線からみた急性心不全治療:ポンプ失調からくる心不全は急性心筋梗塞症後急性期死亡の第一の原因である.これは大きな心筋壊死を起こした結果残存心筋が希少となり,生体が必要とするだけの心拍出量を保てないために起こるものである.心不全徴候が明らかな場合,Swan-Ganzカテーテルのような肺動脈カテーテルを留置して,血行動態をモニターしながら治療が行われる.肺動脈カテーテルから得られた肺動脈楔入圧と心係数から,血行動態からみた急性心筋梗塞症の分類を行ったのがForrester分類である(図5-7-28).
サブセットⅠではポンプ失調は存在しないが,サブセットⅡでは心拍出量は保たれているものの前負荷が過度にかかっていて肺うっ血症状を呈していると考えられる.この場合の治療原則は「減負荷療法」であり,利尿薬や静脈拡張が主体の血管拡張薬(硝酸薬など)により,PCWPが低下してサブセットⅠに入ることができるようになる(図5-7-28の矢印①).これに対してPCWPが高値にもかかわらず低心係数であるサブセットⅣに血行動態がある場合には,ポンプ失調は重症であり死亡率も高く,減負荷療法だけでは血行動態は改善しない.ドブタミン,ドパミンなどの強心薬を投与して心筋収縮力を上げることでStarling曲線を左上にシフトさせたうえで利尿薬や血管拡張薬で減負荷療法を行うことが必要である(図5-7-28の矢印②).
Forrester分類は肺動脈カテーテルを挿入しないと計測できないという不便さがあるが,2003年に提唱されたNohria-Stevenson分類はうっ血所見と低灌流という臨床所見からの分類であり,その簡便性・迅速性とすぐれた予後予測効果から,最近は心筋梗塞発症後の心不全を含めた急性心不全の重症度分類に汎用されている.
d)心原性ショック:近年の急性心筋梗塞治療の進歩に伴い心原性ショックに陥った急性心筋梗塞症例は減少してきているが,いったんこれに陥ると現在でも死亡率の高い(70%に達する)状態である.その80%は広範な心筋壊死に伴うものであり,残りが心室中隔破裂や乳頭筋断裂など急性心筋梗塞の機械的合併症に基づくものである.低心拍出が病態の中心で,血圧低下,主要臓器灌流障害による意識障害,乏尿,四肢冷感,アシドーシスなどが特徴である.機械的合併症の場合には緊急手術となるが,それ以外の場合にはドパミン,ドブタミンなど強心薬による治療には限界があるので,大動脈内バルーンパンピング(intra-aortic balloon pumping:IABP)など補助手段を導入して,できるだけ早くPCIまたは冠動脈バイパス手術(CABG)で閉塞冠動脈の再灌流をはかることが予後を改善すると報告されている.
e)右室梗塞:右冠動脈近位部で主要右室枝を分枝する手前で冠動脈の閉塞が起こると,左室の下壁梗塞とともに右室壁の虚血が発生する.およそ下壁梗塞の半数に何らかの形での右室の虚血を伴うとされているが,典型的な右室梗塞の徴候を示すのは下壁梗塞のうち10%程度である.
右室梗塞は,①右側胸部誘導でのST上昇(図5-7-23,5-7-29A),②心エコー図での右室拡大とアキネジア,ジスキネジア,③平均右房圧≧10 mmHgと高値であるがPCWPとの差が小さい(<5 mmHg)こと,④右房圧波形のnon-compliant pattern(深いY谷),⑤PA交互脈などの所見のどれかが1~2項目存在し,収縮性心膜炎や右室負荷疾患が否定されたときに診断できる.右室からの拍出が低下するために後方障害としての右房圧・静脈圧上昇の所見とともに,肺循環からの左室前負荷が減少するために,肺うっ血はないが左室からの心拍出量も低下し,Forrester分類ではサブセットⅢに入ることになる.このような例にニトログリセリンなど硝酸薬を投与するとますます静脈還流が減少して血圧低下をきたしやすい.むしろStarling曲線上において,大量補液により左室前負荷を少し上昇させることにより心拍出量の増加を見込めるようになる点が,右室梗塞の血行動態と治療の特徴である(図5-7-28の矢印③).
f)心破裂(機械的合併症):急性心筋梗塞発症後に突然肺うっ血の増強と低心拍出を伴う血行動態変化をみたら,機械的合併症の発生を考えなくてはならない.機械的合併症としては,心室中隔破裂,僧帽弁乳頭筋断裂,左室自由壁破裂があげられるが,これらは急性心筋梗塞発症後1週間以内に起こることが多い.①心室中隔破裂:新たな収縮期雑音の発生と急激な肺うっ血を起こしたときには心室中隔破裂または僧帽弁乳頭筋断裂を考える.前壁梗塞では心尖部よりの中隔,下壁梗塞では心基部よりで破裂することが多いが,これはドプラ心エコー検査にて診断が可能である.②僧帽弁乳頭筋断裂:前乳頭筋の破裂の場合には,ここへの血流が多重支配になっているためよほど広範な前壁梗塞を起こすようでないと発生しないが,後乳頭筋断裂はこの部分が左回旋枝からの1本の枝で灌流されているため,この枝の閉塞による小さな下・側壁梗塞でも発症しうる.治療は僧帽弁置換術・形成術となる.③左室自由壁破裂:急性心筋梗塞症の死因のうちポンプ失調についで高い死亡原因である.高齢者,女性,広範な初回梗塞例,再灌流療法不成功例に多いとされ,穿孔型(blow-out type)と滲出型(oozing type)がある.前者は救命が難しいが,後者では緊急手術により救命に成功する例も少なくない.
g)梗塞後狭心症:血栓溶解療法施行例や多枝病変例などで,冠動脈に高度狭窄を残している例で起こることがある.心筋梗塞の再発はさらなる心機能低下をきたして重篤な病態をきたすことになるので,早めの冠動脈造影と適切な血行再建術が必要とされる.
h)その他の合併症:心膜炎は約1/4の急性心筋梗塞症症例で,発症後数日で起こってくる.心筋梗塞の拡大や心筋虚血の症状とまぎらわしいが,痛みが背部の僧帽筋方向へ広がることと心膜摩擦音を聴取できることが特徴である.多くの場合,アスピリンで治療可能である【⇨5-7-4)-(2)の心筋傷害後症候群】.
また,左室内血栓が原因で起こる血栓塞栓症も重大な合併症である.大きな前壁梗塞例に多く,心臓超音波検査などで梗塞部に壁在血栓の存在が疑われたら,早めに抗凝固薬による治療を開始することが重要である.
6)回復期の管理と評価:
STEMIの予後は,左室機能,梗塞サイズおよび虚血リスクにさらされている心筋の大きさに規定される.心臓超音波検査による左室機能評価に加えて,心筋血流製剤(201Tl,90mTc-MIBI,90mTc-tetrofosmin)による核医学イメージングが有用である.最近,心臓MRイメージングでの心室機能評価やガドリニウム遅延造影による傷害心筋評価の有用性が報告されている.
急性期治療により病態が安定したら,長期予後を考えた薬物治療を継続する.アスピリン,β遮断薬,ACE阻害薬は,心筋梗塞症の再発予防,心室リモデリング予防,心不全予防,突然死予防に有効であることが,数々の臨床試験から知られており,副作用がないかぎり長期的に継続していくことが推奨される.
冠動脈疾患のベースとなる動脈硬化リスクファクターのコントロールもきわめて重要である.このなかで,禁煙,肥満の改善,糖尿病のコントロール,脂質異常症のコントロールが重要であるが,特にLDLコレステロール値の低下にはHMG-CoA還元酵素阻害薬(いわゆるスタチン)が有効であり,長期的に心筋梗塞の再発を減少させる効果が実証されている.
これらと並行して心臓リハビリテーションを進めていく.離床後は病棟でバイタルサインや心電図をチェックしながらリハビリテーションを進める.その後適正なトレーニング強度の決定のために心肺運動負荷試験を行い,有酸素運動閾値(anaerobic threshold:AT)および最大酸素摂取量(VO2max)を確認し,運動処方を行う.これらの運動療法により運動耐容能の改善や再発率低下,生命予後改善効果のあることが報告されている. 基本的にはATレベル以下の運動強度で行うが,この時期でも急に血行動態が不安定になることがあるので,開始前のメディカルチェックが必要である.
b.非ST上昇型急性心筋梗塞(non-ST elevation myocardial infarction)と不安定狭心症(unstable angina)
概念
ACSのなかで,急性期に12誘導心電図にてST上昇がみられないものは非ST上昇型急性心筋梗塞(NSTEMI)とよばれ,前述のように不安定狭心症(UA)と連続した病態であることが明らかになってきたため,両者を同一カテゴリーで扱うことが通例となっている.
病因
多くのSTEMIと同様に冠動脈の動脈硬化性プラーク破綻やびらんにより,局所に血栓が形成されて冠動脈を一時的に閉塞したり高度狭小化をきたすことが主因である(図5-7-20).このほかに冠動脈攣縮(スパズム)が関与していると考えられる症例が少なからずみられる.日本人は欧米人に比べて冠攣縮性狭心症の頻度が高いので,ACSの発症メカニズムとしてスパズムも念頭に入れておく必要がある. 冠動脈が完全に閉塞し血流が遮断されるとST上昇が起こるが,閉塞せず高度狭窄の状態であったり,閉塞しても早期に側副血行路が発達したりすると,心内膜側に限局した心筋虚血にとなり非ST上昇型ACSとなる.
診断・重症度評価
臨床症状はSTEMIと同様であり,診断プロセスも身体所見,心電図に続いて心エコーによる壁運動異常の検出と血液生化学検査を行う.病歴上からはBraunwaldが提唱した不安定狭心症の分類(1989年)が現在でも重症度を評価して初期治療方針決定に重要である(表5-7-11).
心電図変化についての一般論は別項に譲る【⇨5-4-1)】.発作時心電図ではST低下,T波陰転,陰性U波出現など多彩な波形を示すが,ST低下が遷延する例は冠動脈高度狭窄例が多く,広範なST低下を示す場合には多枝病変の存在が多いので注意が必要である.新規の左脚ブロック出現も高リスクのACSを示唆する重要な所見である.
さらに最近は生化学的指標として,CK,CK-MBとともにトロポニンT(TnT)あるいはトロポニンI(TnI)測定が一般化している.一定以上のCK上昇があればNSTEMIと診断されるが,CK上昇が明らかでなくUAの範疇であってもTnT,TnIが上昇していると微小心筋壊死が推定され,高リスクと認定される.
このような病歴,自覚症状,心電図所見,生化学的マーカーを含めたUAのリスク分類を表5-7-12に示す.また,このような複数の危険因子の組み合わせから評価するTIMIリスクスコア(表5-7-13)が汎用されており,スコアが増加するにつれ相乗的に予後が悪化することが示されている.
治療
リスクに基づいた初期対応が重要であり,まず表5-7-12,5-7-13を用いてリスク評価を直ちに行う.中リスク以上の患者は原則入院とし高リスク患者は心電図監視が可能なCCUあるいはこれに準ずる病室へ収容する.心電図モニター下でベッド上安静とし,アスピリン,ヘパリンと硝酸薬・β遮断薬を投与する.
高~中リスク患者に対する治療戦略は,直ちに冠動脈造影を行い適応があれば冠血行再建術(PCI,CABG)を行う“早期侵襲的治療”か,いったんCCUで内科的治療を行い,その後症状再燃や心不全,虚血の出現があったら冠動脈造影⇒冠血行再建を行うという“早期保存的治療”の2つに分けられる(図5-7-30).数々の臨床試験結果から,最近は中リスク以上でTnTが陽性の場合には早期侵襲的治療が行われることが多くなっている. 亜急性期以降の管理はSTEMIと同様であり,運動負荷試験や画像診断結果により冠動脈造影を行いPCIやCABGの適応を考慮する.長期管理に当たっては,冠危険因子のコントロールを十分に行い,日常生活についての患者教育をきめ細かく行うことが重要である.
(2)陳旧性心筋梗塞(old myocardial infarction:OMI)
定義・概念
2012年に欧州・米国の学会(European Society of Cardiology,American College of Cardiology Foundation,American Heart Association)と世界心臓連合(World Heart Federation)による定義では,以下の所見が1つでもある場合に陳旧性心筋梗塞とすることが勧告されている.①自覚症状の有無を問わず,虚血以外の原因が考えられない異常Q波②虚血以外の原因が考えられない局所の心筋喪失を示す壁の菲薄化や収縮障害③陳旧性心筋梗塞を示す病理学的所見 心筋梗塞急性期を過ぎて,自覚症状や血行動態も落ち着き,心筋生化学マーカーの上昇がなく心電図所見も固定した状態を示している.明確に時期的な定義をしたものはないが,病理学的に瘢痕形成が起こる発症後4週間以降を指すことが多い.
疫学
日本人の心筋梗塞患者を対象とした2009年の臨床研究JACSSによると,急性心筋梗塞の入院死亡率は8%を下回るレベルになっており,これは欧米に比べてきわめてよい成績である.したがって90%以上の患者が生存して陳旧性心筋梗塞として管理・治療を受けている. また日本人の冠動脈疾患患者を長期追跡したJCAD研究によると,陳旧性心筋梗塞例は非心筋梗塞例に比べて有意に予後が悪いことが示された.JACSSでの多変量解析では,内服薬を含まない場合,高齢・女性・腎機能障害・来院時心不全・発症から受診までの経過時間が長期死亡に寄与する独立した因子であり,内服薬を含めた場合,長期生存に寄与する因子としては,腎機能障害・来院時心不全・受診までの経過時間に加えて,アスピリンとβ遮断薬の使用があげられている.
病態生理
梗塞部では,急性期の心筋壊死部位の炎症・浮腫から瘢痕組織に置換され,同部位の菲薄化と進展を生じるようになり,これは早期リモデリングとよばれる.この際に非梗塞部が心臓のポンプ機能低下を代償しようとして,Frank-Starling法則による前負荷増加およびレニン-アンジオテンシン-アルドステロン系や交感神経系の活性亢進が起こり,左室拡大からひいては非梗塞部を含めた左室収縮障害をきたすことになり,晩期リモデリングとよばれる.このような心室リモデリングは,慢性心不全への移行や心臓突然死につながる過程となる.
臨床症状
自覚症状は,心筋梗塞の大きさや冠動脈の状態により変わりうるが,急性期以降は無症状の例も多い.心電図では異常Q波,R波減高,T波陰転などから陳旧性心筋梗塞症の存在を疑う.この時期では,心筋虚血,心不全,不整脈に関する所見の有無が患者管理上重要である.
1)心筋虚血:
心筋バイアビリティのある部位への冠動脈に残存狭窄があると狭心症や無症候性心筋虚血を示す場合があるので,狭心症状に注意するとともに運動負荷心電図や心筋シンチグラムなど画像診断,Holter心電図などで心筋虚血の有無とその広がりをチェックする.
梗塞部など心筋バイアビリティ評価が必要な場合には,ドブタミン負荷心エコーや負荷心筋シンチグラム,最近では負荷心MRIが行われる.
2)心不全:
心筋梗塞サイズが大きい場合や左室リモデリングが進行した場合には,左室拡大と収縮障害による心不全徴候が出現する.労作時息切れ・呼吸困難から身体所見上の心不全徴候(頸静脈怒張,Ⅲ音などの過剰心音,肺胞性クラックル,末梢浮腫など)がみられ,心臓超音波検査で左室拡大,壁菲薄化,壁運動異常などが認められる
3)不整脈:
慢性期の心筋梗塞後不整脈で重要なのは心室性不整脈,特に心室頻拍の有無である.心機能低下例での6連発以上の速い(レート150/分以上)非持続性心室頻拍については,薬物療法だけでなく植え込み型除細動器を含めた非薬物療法も考慮されるため,標準12誘導心電図に加えて定期的にHolter心電図を行う.ハイリスク不整脈が検出された場合には,加算平均心電図による遅延電位の測定も重要である.
治療・患者管理
陳旧性心筋梗塞管理のポイントは,急性心筋梗塞の回復期の管理を確実に継続していくことである.これには,長期予後を考えた薬物治療(アスピリン,β遮断薬,ACE阻害薬)および動脈硬化リスクファクターのコントロール(禁煙,肥満の改善,食事療法,スタチンなど)および運動療法があげられる.
薬物療法では,左室リモデリングの予防をおもな目的としてレニン-アンジオテンシン-アルドステロン系の抑制と交感神経系の抑制が重要であり,前者にはACE阻害薬,アンジオテンシンⅡ受容体拮抗薬,アルドステロン拮抗薬が,後者にはβ遮断薬が使用される.HMG-CoA還元酵素阻害薬(スタチン)は心血管イベント抑制効果が報告されており,スタチンにはコレステロール低下作用以外の多面的効果(pleiotropic effect)として抗酸化作用,抗炎症作用,内皮細胞機能改善作用などがみられるため,大部分の患者に投与されるのが現状である. 心筋虚血が残存している場合には,自覚症状の有無,冠動脈病変の重症度と病変形態,心機能低下の程度を総合的に評価し,適切な薬物療法を行ったうえで冠血行再建術の適応を考慮する.ただし,2007年に報告されたCOURAGE試験で,陳旧性心筋梗塞症を含む安定慢性冠動脈疾患患者に対して,適切な薬物治療を含めた内科的治療を行っていれば,たとえ経皮的冠動脈インターベンション(PCI)の適応になる冠動脈狭窄が存在しても,PCIを追加しても長期予後が変わらないことが報告された(図5-7-31).
狭心症を含む自覚症状の改善効果は認められていること,その後も新しい世代の薬剤溶出性ステントが登場していることから,基本は適切な内科治療であることには変わりはないが,PCIの効用についてさらなる検討が進められていくであろう.
心筋梗塞後の心不全の治療もきわめて重要であり,左室収縮不全に対しては慢性心不全の標準的治療であるアンジオテンシンⅡ阻害薬(ACE阻害薬,アンジオテンシンⅡ受容体拮抗薬)とβ遮断薬を中心とした薬物療法を行う.薬物療法でも心不全のコントロールが難しい場合には,適応があれば心臓再同期療法(cardiac resynchronization therapy:CRT)あるいは手術(冠動脈バイパス術,左室形成術)が行われることがある.
さらに,心筋梗塞後の心室性不整脈治療についても,左室駆出率低下例に心室頻拍を合併する場合には,植え込み型除細動器(ICD)が予後改善効果をもたらすことが明らかになって,欧米ではその適応が広がっている.わが国では欧米ほど心筋梗塞後の突然死は多くないが,十分な薬物療法を行ってもNYHAクラスⅡまたはⅢの心不全症状を有し,かつ左室駆出率35%以下で非持続性心室頻拍を有する場合や,クラスⅠでも左室駆出率35%以下,電気生理学的検査で持続性心室頻拍が誘発される非持続性心室頻拍の例にはICD植え込みが推奨されている.
心筋傷害後症候群(post-cardiac injury syndrome)
心筋梗塞後症候群(postmyocardial infarction syndrome)あるいはDressler症候群ともよばれる.貫壁性心筋梗塞を発症すると壊死部を中心に炎症が起こるが,壊死細胞由来の自己抗体に対する免疫応答が生じ,これが心表面に波及して線維素性心外膜炎を生じることがある.開心術後に起こる心膜切開後症候群と同様のメカニズムである.
軽微なものであれば,急性期の数日間のみ聴診上心膜摩擦音が聴かれるのみで自然に消褪するが,まれに数週間後急性心膜炎の徴候を呈して発熱,胸膜痛様胸痛,心エコーで心膜液貯留,炎症反応陽性(CRP上昇など),胸水貯留などがみられる.
治療は原則として非ステロイド系抗炎症薬を使用するが,炎症が遷延する場合にはステロイド治療が必要になる.
(3)虚血性心筋症(ischemic cardiomyopathy)
定義・概念
虚血性心筋症という概念は,古典的には重症の冠動脈疾患を基礎として心機能低下をきたして,拡張型心筋症に類似した左室拡大と収縮障害をきたした病態と定義されてきた.ところが,1995年のWHO/ISFCでは「冠動脈病変では説明できない心機能低下」を示すものと定義され,従来のものは虚血性心筋症とはよばないことになり多少混乱を生じてきた.この概念は2008年に発表された欧州心臓病学会(ESC)の分類でも踏襲されており,心筋症の定義は「冠動脈疾患・高血圧・弁膜症・先天奇形によるものではない,構造的・機能的異常を伴う心筋疾患」とされている.
しかしながら,実際の臨床上は冠動脈疾患を合併した心機能低下例が虚血性心筋症とよばれることが多いため,2011年日本循環器学会ガイドラインでは,「臨床的に類似した心筋症疾患群の基本病態」の1つとして,虚血性心筋症を定義している(友池ら,2011).
ここでは,「慢性虚血を原因とする拡張型心筋症に類似した左室の拡大と収縮機能の低下を特徴とする重症虚血性心疾患」と定義されている.
病因・病態生理
虚血性心筋症の大部分は,大きな陳旧性心筋梗塞を基礎としてこれによる左室収縮障害や前述の心室リモデリングによる左室拡大を背景とする.これ以外には,狭心症など心筋虚血発作を繰り返し起こすことによって惹起された重症心筋虚血が原因になることがあり,この場合には強い虚血発作の後に遷延する気絶心筋(stunned myocardium)や慢性的血流不足により生じる冬眠心筋(hibernating myocardium)が左室収縮低下の主因となる. さらに,頻度は少なくなるが貧血や睡眠時無呼吸症候群などによる心筋の低酸素状態も原因となる.
臨床症状
自覚症状としては,狭心症など心筋虚血発作を生じる場合もあるが,むしろ胸痛のない無症候性心筋虚血による虚血エピソードが繰り返し起こった結果,呼吸困難など心不全症状で発症し,後に虚血性心筋症であったとわかる場合が少なくない.
身体診察や一般検査では,心不全徴候としてのうっ血所見(頸静脈怒張,肺胞性クラックル,ギャロップリズム(gallop rhythm),浮腫,胸部X線写真での肺血管陰影増強,BNP上昇など),および心筋傷害(心電図でのQ波や心室内伝導障害など),左室拡大・収縮力低下所見(心臓超音波検査など)がメインである.
過去に冠動脈疾患の病歴がない場合には,通常拡張型心筋症と診断されてしまうことがあるが,特に動脈硬化の危険因子を有する例の場合には,Holter心電図でのST解析,ドブタミン負荷エコー,心臓核医学検査(脂肪酸シンチグラフィなど)などで心筋虚血の存在を確認することが必要である.最近は,冠動脈CTによる冠動脈病変の評価が可能になったため,虚血性心筋症と拡張型心筋症の鑑別が容易になった.ただ冠動脈CT所見はあくまで形態学的なものであるため,上記のような機能的検査所見を合わせて,虚血性心筋症と診断することが重要である.
治療・患者管理
一般に虚血性心筋症の予後は拡張性心筋症よりも不良であるといわれている.予後予測因子としては,慢性心不全の指標である左室駆出率や血漿BNP濃度などに加えて冠動脈病変の重症度が重要な因子となる.
したがって治療は,①心筋虚血改善を目的とした冠動脈病変に対する治療,②慢性心不全に対する治療の2つの軸に分けられる.心筋虚血に対する治療は,慢性冠動脈疾患の治療と同様に,適正な内科治療に加えて適応を吟味した冠動脈血行再建術(経皮的冠動脈インターベンション,冠動脈バイパス術)が行われる.特に冠動脈病変末梢の心筋バイアビリティの評価が重要で,血行再建により心機能の改善が見込める部位に対して適切な手段を用いて行うことが重要である.
もう一方の軸である慢性心不全に対する治療は,他項で詳しく述べられているのでここでは触れないが,多数の慢性心不全・心筋梗塞後症例に対する大規模臨床試験結果から,アンジオテンシンⅡ阻害薬(ACE阻害薬,アンジオテンシンⅡ受容体拮抗薬)とβ遮断薬が薬物療法の基本であること,これにアルドステロン拮抗薬を併用することで予後改善効果が認められること,心臓再同期療法や植え込み型除細動器などのデバイス治療の適応も広がってきていることがポイントとなる.[川名正敏]
■文献
髙野照夫,他:急性心筋梗塞(ST上昇型)の診療に関するガイドライン.Circulation Journal, 72, SupplementⅣ,日本循環器学会,2008.
友池仁暢,他:拡張型心筋症ならびに関連する二次性心筋症の診療に関するガイドライン.循環器病の診断と治療に関するガイドライン,日本循環器学会,2011.http://www.j-circ.or.jp/guideline/pdf/JCS2011_tomoike_h.pdf
山口 徹,他:急性冠症候群の診療に関するガイドライン(2007年改訂版),日本循環器学会,2007.http://www.j-circ.or.jp/guideline/pdf/JCS2007_yamaguchi_h.pdf

表5-7-5
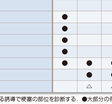
表5-7-6

表5-7-7

表5-7-8

表5-7-9

表5-7-10

表5-7-11

表5-7-12

表5-7-13
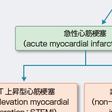
図5-7-19
図5-7-20
図5-7-21
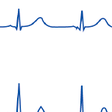
図5-7-22
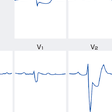
図5-7-23
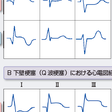
図5-7-24
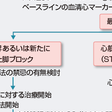
図5-7-25
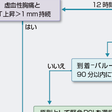
図5-7-26
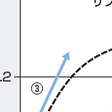
図5-7-28
図5-7-29
図5-7-30
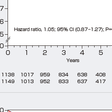
図5-7-31
出典 内科学 第10版内科学 第10版について 情報
家庭医学館 「心筋梗塞」の解説
しんきんこうそくしょう【心筋梗塞(症) Myocardial Infarction】
 心筋梗塞とは
心筋梗塞とは 心筋梗塞の検査と診断
心筋梗塞の検査と診断 心筋梗塞の治療
心筋梗塞の治療 救急医療について
救急医療について 心筋梗塞の予防と対策
心筋梗塞の予防と対策 心筋梗塞(しんきんこうそく)とは
心筋梗塞(しんきんこうそく)とは◎狭心症(きょうしんしょう)と心筋梗塞
心臓は絶え間なく拍動(はくどう)しています。その心臓のポンプ作用の基になっているのは心筋細胞の収縮です。そのエネルギーは、心臓に栄養と酸素を届けている血管である冠動脈(かんどうみゃく)(冠状動脈(かんじょうどうみゃく))によって供給されています。
加齢によってこの冠動脈に動脈硬化(どうみゃくこうか)が生じると、血管の内腔(ないくう)が狭く小さくなり(狭小化)、血の流れが悪くなっていきます。その結果、心筋虚血(しんきんきょけつ)(血液が足りない状態)となります。この障害が可逆的(かぎゃくてき)な(もとの状態にもどったり悪化したりする)場合は、短時間(数分)の胸痛が生じます。これが狭心症(きょうしんしょう)(「狭心症」)です。
ところが、完全に血行が途絶え、心筋細胞が壊死(えし)(細胞が死亡した状態)してしまうと、急性心筋梗塞症と呼ばれる状態になります。
心筋梗塞に至るまでの所要時間は、動物実験でみても、動物の種によって差があり、同じ種でも個体差があります。比較的人間に近いとされるブタで実験してみると、30分間血行を止めると11%、1時間で約80%、2時間で96%の心筋細胞が壊死してしまいます。
しかしながら、側副血行路(そくふくけっこうろ)(枝分かれした血管を通り、回り道して血液が組織に達する路線)が発達していれば、心筋梗塞に至るまでには時間がかかります。人間はイヌとブタの中間ぐらいに側副血行路が発達していると考えられており、心筋梗塞に至るまでには3~6時間かかると予想されています。したがって、血管が閉塞(へいそく)したためにおこる発作の後、心筋が完全に壊死してしまうまでに、早く治療を開始することが非常に重要になるわけです。
◎どうして血管がつまるのか
冠動脈がどうして閉塞するのか、まだ完全にはわかっていません。これまでは、冠動脈のけいれん(スパスムといいます)や、冠動脈に生じた動脈硬化が進行して完全に血管が閉塞してしまうことが原因だと考えられてきました。ところが、その後たくさんの冠動脈造影(血管に放射線に反応する薬液を注入して冠動脈の状態を撮影する方法。(「心筋梗塞の検査と診断」のその他の検査参照))や不幸にして死亡された後の病理解剖の結果から、心筋梗塞の原因となった冠動脈には血液の凝血塊(ぎょうけつかい)(血のかたまり。血栓(けっせん)ともいいます)が高い確率で存在すること(図「狭心症と心筋梗塞症の冠動脈病変のちがい」)、しかもその部位では、動脈硬化した部分をおおっている膜に亀裂(きれつ)が生じていることが明らかになりました。
組織に亀裂があると、そこを修復しようと、血小板(けっしょうばん)をはじめとして、血液に含まれる凝固系(ぎょうこけい)(血を固まらせる)成分がたくさん集まってきます。その結果、過剰な反応が生じ、血栓が大きく成長して、完全閉塞となります。
血栓形成の程度が軽い場合は、症状が現われることなく修復されるため、無症候性の動脈硬化となります。ところが、中等度の血栓の場合は、血管が不完全に閉塞して狭心症をおこし、完全に閉塞すれば急性心筋梗塞症を発症することになるわけです。
◎虚血性心疾患(きょけつせいしんしっかん)は増えているか
狭心症や心筋梗塞症は、虚血性心疾患と総称されています。日本は、欧米各国に比べ、人口あたりの虚血性心疾患数は非常に少なく、厚生省(現厚生労働省)が毎年報告している人口動態統計の死因解析でみても、年齢で調整した死亡率は年々低下しています。ところが、人口の高齢化にともない、虚血性心疾患の絶対数は増加しており、おもな死因の1つを占めています。現在、1年間の心筋梗塞発症数は、およそ15万人、致命率は30%と推測されています。
◎危険因子について
冠動脈硬化の危険因子(冠危険因子(かんきけんいんし)といいます)には、コラム「冠危険因子」に示したようなものがあります。とくに中年男性や以降の女性で複数の因子をもっている人は、定期的な検診を受けることが重要です。
50歳未満の人の発症を男女比でみると、10対1と女性はきわめて低率です。これは、閉経前の女性は、エストロゲンという女性ホルモンによって動脈硬化が抑えられるためです。出産・育児というたいせつな時期に母体を守るためと考えられています。
◎発症の誘因は何か
動脈硬化したところの亀裂が急性心筋梗塞症の成因である、とこの項目のどうして血管がつまるのかで述べましたが、この亀裂がどうしてできるかはまだわかっていません。
ただ、発症前の患者さんの状態を調べますと、疲労、睡眠不足、激務、過度な精神的ストレスがあったことがわかります。必ずしも発症時に何か過激なことがあって、心筋梗塞発作がおこったのではなく、むしろ発症前の不摂生が関係しているのです。
心身の不摂生がこうじると、交感神経系(こうかんしんけいけい)の活動が優勢となり、カテコラミン(カテコールアミン)と呼ばれるホルモンが必要以上に分泌(ぶんぴつ)されます。それが亀裂を誘発したり、凝固能の亢進(こうしん)をまねくと考えられるのです。
発症時刻は、医療機関が休診している時間帯である早朝や夜間のことが多くあります。そのようなとき、我慢せずに、すぐに連絡・相談できるかかりつけの医師や医療機関を日ごろから確保しておくことがたいせつです。
 心筋梗塞(しんきんこうそく)の検査と診断
心筋梗塞(しんきんこうそく)の検査と診断心筋梗塞であるかどうかは、おもに症状、心電図、血液検査(心筋逸脱酵素(しんきんいつだつこうそ))で診断されます。
●心筋梗塞の症状
通常30分以上続く前胸部の強い胸痛(きょうつう)と絞扼感(こうやくかん)(締めつけられるような感覚)があり、恐怖や不安感をともないます。部位は前胸部中央、胸全体、頸部(けいぶ)、背部、左腕、上腹部で、付随症状として冷や汗、吐(は)き気(け)・嘔吐(おうと)、呼吸困難があります。時間は数十分から、24時間以上続くこともあります。
注意点 脳梗塞(のうこうそく)や糖尿病がある人や高齢者の場合、まったく痛むことなく発症することがあります。いつもとようすがちがう場合には、急性心筋梗塞症も念頭におく必要があります。
また、梗塞の部位によっては、上腹部痛による吐き気をともなうことがあるため、消化器疾患とまぎらわしいこともあります。中年を過ぎたら、心電図検査を受けて、心筋梗塞の可能性を早めにチェックしておくことです。
●心電図検査
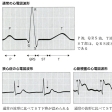
急性期(症状や病態の変化が大きい時期)には、心電図に特徴的な変化があるため、典型的な心筋梗塞発作の診断は容易です。その変化は、ST上昇、数時間後の異常なQ波の出現、数日後の深い冠性T波の出現の3つです(図「急性心筋梗塞症の典型的な心電図変化」)。
注意点 発症初期には、典型的な変化を示さないことも多いため、時間的変化が観察されます。胸痛がある場合は、くり返し心電図をとり、比べてみて変化が明らかになることもあります。
●血液検査
心筋逸脱酵素は、心筋の細胞が破壊されたときに細胞から逸脱する酵素です。代表的なものに、クレアチンホスホキナーゼ(CPK)があり、心筋梗塞発症4~5時間後から血液中で増加します。最近では、アイソザイム(同位酵素)であるMB‐CPKが用いられることが多くなりました。なお、可逆的な変化である狭心症では、血液中に値の上昇はありません。
●その他の検査
心エコー図(心臓超音波検査) 心筋梗塞が生じると、生じた部位の心筋の収縮が低下します。この変化は、超音波検査で容易にとらえられます。心電図上の変化が明らかでない場合や、他の疾患との鑑別に有用です。
また、この検査は、心筋梗塞の広がりや合併症の有無を調べたり、心機能を評価したりするのにも役立ちます。
冠動脈造影 冠動脈造影は、心筋梗塞の診断のみならず、冠動脈形成術(かんどうみゃくけいせいじゅつ)(PTCA)や冠動脈バイパス術などの治療にも不可欠です。カテーテルと呼ばれる管(直径1~3mmくらいの細くてやわらかいビニールチューブ)を手足の動脈から心臓の血管の内部まで送り込み、造影剤という放射線に反応する薬物を注入して冠動脈の状態を映し出す検査です。
心臓核医学検査 心臓に取り込まれる放射性物質(アイソトープ)を利用して画像を得る方法です。心筋梗塞部に集まったアイソトープを黒く見せる陽性像による方法(99m‐Tcピロリン酸心筋梗塞シンチグラムといいます)と、白く見せる陰性像による方法(タリウム心筋シンチグラム)とがあります。
前者は、急性期の1週間まで陽性が保たれるため、急性期の診断に使用され、後者は、心筋梗塞の広がりや梗塞部の心筋がどの程度生存しているかを調べるのに役立ちます。
 心筋梗塞(しんきんこうそく)の治療
心筋梗塞(しんきんこうそく)の治療心筋梗塞であるかどうかは、おもに症状、心電図、血液検査(心筋逸脱酵素(しんきんいつだつこうそ))で診断されます。
●胸痛発作(きょうつうほっさ)が生じた場合
●救急外来あるいは入院直後の治療
●さらに高度な医療が必要な場合
●入院後の治療
●後療法=薬物治療について
◎合併症に対する治療法
心筋梗塞症の合併症には、不整脈(ふせいみゃく)、ポンプ失調(しっちょう)・心原性(しんげんせい)ショック、心破裂、CCU症候群、梗塞後狭心症(こうそくごきょうしんしょう)と無症候性心筋虚血(むしょうこうせいしんきんきょけつ)、右室梗塞(うしつこうそく)、心膜炎(しんまくえん)、左室血栓(さしつけっせん)とそれにともなう塞栓症(そくせんしょう)があります。これらのうち、不整脈については別項で述べられていますので(「不整脈」)、ここではそれ以外の合併症について述べます。
■ポンプ失調と心原性ショック
■心破裂(しんはれつ)
■CCU症候群
■梗塞後狭心症(こうそくごきょうしんしょう)と無症候性心筋虚血(むしょうこうせいしんきんきょけつ)
■右室梗塞(うしつこうそく)
■心膜炎(しんまくえん)
■左室血栓(さしつけっせん)とそれにともなう塞栓症(そくせんしょう)
◎心臓リハビリテーション
急性期から1~2週間、退院が可能となるレベルのころまで心臓リハビリテーションが実施されます。
まず、日常生活に必要最小限の運動の回復が行なわれ、その後、病棟で、監視下リハビリテーションが実施され、歩行などの回復が行なわれます。
退院すると、外来で、監視下から非監視下リハビリテーションに移り、家庭での運動療法の処方が行なわれます。
●胸痛発作(きょうつうほっさ)が生じた場合
できるだけ早く治療を開始したほうが、その後の経過(予後)が順調です。発作直後には危険な不整脈(ふせいみゃく)も生じやすいため、発作がおこったときは我慢せず、すぐに医療機関に連絡して相談しましょう。受診の際はできるだけ救急車を要請してください。また、すぐに相談できるかかりつけ医を日ごろから確保しておくこと、循環器の専門医がいる病院を調べておくことも重要です。
●救急外来あるいは入院直後の治療
救命に必要な処置や緊急冠動脈造影の準備が一般的な治療とともに行なわれます。そして、専門医と担当医が相談し、その施設で治療するか専門施設へ転送するかの判定がなされます。
精神的ケア(不安の除去) 厳しい胸痛のため、患者さんは、死の不安を感じていることが多いものです。そのため、まず安心感を与え、安静を守り治療すれば必ず社会復帰できる病気であることが説明されます。
疼痛(とうつう)の除去 痛みが強い場合には、塩酸モルヒネという鎮痛薬(ちんつうやく)が使われます。痛みによって血圧や脈拍が増えると心臓にさらに負担がかかるため、強い痛みは我慢しないほうがよいのです。
点滴の確保 抗不整脈薬の使用のほか、疼痛除去、血行動態(血圧・脈拍)のコントロールを早急に行なう必要があるため、静脈から薬液を点滴注入しなければなりません。
酸素吸入 低酸素状態は、病態を悪化させることがあります。そのため、少量の酸素吸入(1分あたり2ℓ)が開始されます。
心電図モニター 急性期には危険な不整脈が出現しやすいので、心電図を連続して観察することが重要です。胸に電極がつけられ、テレメーター(遠隔モニター)で観察されます。
ニトログリセリンの舌下(ぜっか) ニトログリセリンを口に含むと胸痛が軽減したり、血管が再開通することもあります。患者さんがニトログリセリンをもっている場合には、5分ごとに3錠まで使用します。胸痛が消えない場合は、医療機関に連絡してください。
ヘパリンの静注 ヘパリンというのは、抗凝血薬(こうぎょうけつやく)(血を固まりにくくする薬)ですが、それを入院直後に静脈から注入(点滴)することで、血栓でふさがれた冠動脈が再開通する確率が増します。通常、5000単位で、1日あたり1万5000単位が持続点滴されます。その後、活性化凝血時間を調べ、200秒以上保たれるよう調整されます。
●さらに高度な医療が必要な場合
以上の初期治療には、心電図モニター、電気ショック、一時ペーシング(体外式ペースメーカーの使用)、人工呼吸器などの器材が必要ですが、さらに重症の人の救命には、血行動態監視、補助循環装置、心臓カテーテル検査室、心臓外科、冠動脈疾患用集中治療室(CCU)が必要になります。
初期治療を行なった医療施設で治療を開始する場合は、血栓溶解療法(けっせんようかいりょうほう)を始めるかどうかがまず決められます。専門施設に転送する場合も、静脈点滴が必要となります。再灌流(さいかんりゅう)(血流の再開通)にともなう危険な不整脈が生じ、救急車内で電気的除細動(でんきてきじょさいどう)を実施する可能性もあります。そのため、転送時には医師が救急車に同乗します。
●入院後の治療
急性期は、原則としてCCUに収容され、梗塞した箇所の治療や後療法が実施されるとともに、合併症の予防や対応が行なわれます。
CCUの役割 CCUとは冠動脈疾患用集中治療室のことで、心電図を常時集中監視し、医療スタッフが常駐している集中監視室の周囲に重症室が配置されるなど、緊急対応しやすいように設計されています。
患者さんの精神的安静度を考えた場合、内科系集中治療室では個室のほうが好ましいと考えられています。
再灌流療法(さいかんりゅうりょうほう) 心筋梗塞をおこした部位の大きさを縮小させることが長期予後(治療後の状態)の改善につながります。そのため、できるだけ早いうちに閉塞した冠動脈を再開通(再灌流)させることが急性期の治療目標となります。
発症後6時間までに実施すると梗塞のサイズの縮小が期待できるため、原則として、発症後6時間以内であれば冠動脈内の血栓を溶かすこと(冠動脈内血栓溶解療法(かんどうみゃくないけっせんようかいりょうほう)、ICTと略します)を中心とした再灌流療法が実施されます。最近、この時間を12時間から24時間にまで広げて、その効果が検討されています。
血栓溶解薬は、第1世代の血栓非親和性(ひしんわせい)(血栓と結合しにくい性質)のウロキナーゼではなく、第2世代の血栓親和性をもった組織型プラスミノーゲンアクチベーター(tPA)やproUKという薬が使われます。今後は、半減期(はんげんき)(効果が低下するまでの期間)がより長く、血栓溶解率の高い第3世代の血栓溶解薬が使われるようになるでしょう。この薬は、点滴ではなく、1回の静脈注入によって使え、早く再開通できるため、さらに使用頻度が増すと予想されます。
ICTとPTCA(経皮的冠動脈形成術(けいひてきかんどうみゃくけいせいじゅつ)、いわゆる風船療法。狭心症の「狭心症の治療」の経皮的冠動脈形成術参照)は、ともに閉塞血管を再開通させる治療法です。急性心筋梗塞症については、早いうちに、閉塞した血管の再灌流を始めるほうが予後がよいため、施設によってもっとも早く再開通できる方法が選ばれます。
ICTを第1選択として不成功に終わった場合、PTCAを追加することができます。出血する危険がある場合には、むしろPTCAが選択されます。PTCAはICTに比べ、より確実な再灌流療法ですから、PTCAに熟練した医師が常時いて、カテーテル室がすぐに使用できる状態であれば、PTCAが選択されてもよいと思われます。
●後療法(こうりょうほう)=薬物治療について
抗血栓薬治療(こうけっせんやくちりょう) ICTまたはPTCAが終わると、抗血小板療法(こうけっしょうばんりょうほう)と抗凝血療法(こうぎょうけつりょうほう)が実施されます。これらは薬物療法で、抗血小板薬と抗凝血薬(両者を合わせて抗血栓薬といいます)が使われます。
抗血小板薬としてよく使われているのはアスピリンです。抗凝血薬としてはヘパリンが使われます。
抗血栓薬治療の第1の目的は、心筋梗塞の早期再発・拡大および死亡率の軽減です。心筋梗塞後にヘパリンを使用することで、死亡率が21%、心筋梗塞症の再発が30%も減少することが明らかとなっています。また、アスピリンでも明らかに死亡率、再梗塞が減少しています。そのため、血栓溶解療法をしたかしないかにかかわらず、患者さんに出血傾向や禁忌(きんき)(有害な副作用が現われるため特定の薬を使用しないこと)がないかぎり、急性心筋梗塞症を発症した場合には、ヘパリンとアスピリンが使用されます。
通常、ヘパリンは、3日間持続点滴され、徐々に量を減らして中止されます。アスピリンは、当日から内服開始となります。
抗血栓薬治療の第2の目的は、再灌流療法後の再閉塞予防と死亡の予防です。これは、血栓溶解薬を単独で使用するより、ヘパリンを併用するほうが開存率(再開通した場所が維持される度合い)がよいからです。また、アスピリンを併用すると、再梗塞が50%も減少し、死亡率は42%減少したという報告があり、再灌流療法後においてもヘパリンとアスピリンの併用が勧められています。梗塞をおこした血管の開存は長期予後にかかわるため、再開通後の後療法は重要なのです。
抗血栓薬治療の第3の目的は、心筋梗塞症の遅発性再発と死亡の二次予防です。抗血小板薬、抗凝血薬ともに心筋梗塞後の二次予防に効果があるとされており、簡便で出血する危険の少ないアスピリンがよく使われています。
ACEI(アンギオテンシン変換酵素阻害薬(へんかんこうそそがいやく)) 心筋梗塞をおこすと、心機能が低下しますが、そのこと自体が梗塞後の予後を大きく左右します。梗塞が大きい場合、徐々に心臓は拡大し、放っておくと、慢性期にかけてさらに心機能が低下してしまいます。この状態を左室再構築(さしつさいこうちく)(リモデリング)と呼んでいます。
ACEIを使用すると、この左室拡大が予防され、心機能の低下が抑えられます。また、突然死や再梗塞を予防するといわれ、予後の改善に期待されています。
硝酸薬(しょうさんやく) 心筋梗塞の急性期には、血圧を120mmHg以下に維持するため、静脈注射用の硝酸薬が使用されます。硝酸薬はまた、梗塞サイズの縮小、左室再構築防止、心破裂(しんはれつ)の予防が期待されています。
カルシウム拮抗薬(きっこうやく) 梗塞後に狭心痛がある場合や、高血圧症を合併しているときに用いられます。塩酸ジルチアゼム(ヘルベッサー)やニフェジピン (アダラート)などが使われます。
β遮断薬(ベータしゃだんやく) 禁忌がないことを条件に、欧米ではβ遮断薬の早期からの使用が推奨されています。これによって心破裂の予防、梗塞サイズの縮小、長期予後の改善が期待されます。日本では、副作用や冠(かん)れん縮(しゅく)(冠動脈のけいれん、スパスム)の悪化を懸念して、あまり使用されていません。しかし、心不全がなく洞性頻脈(どうせいひんみゃく)が現われている場合では、少量の短時間作用型のβ遮断薬の内服が開始されます。
■ポンプ失調と心原性(しんげんせい)ショック
急性心筋梗塞症の急性期において死亡する患者さんの死因のうち、その約70%はポンプ失調によるものです。そのなかでも心原性ショックの死亡率はいまだに50%以上と高率です。
ポンプ失調というのは、心筋梗塞症によって、急激な左心室の収縮機能障害が生じ、全身の需要に見合うだけの血液を心臓から送り出せなくなった状態のことです。この状態を代償(だいしょう)するため、末梢血管(まっしょうけっかん)が収縮したり、左心室の充満圧が上昇し、さらに肺(はい)うっ血(けつ)(肺胞(はいほう)に血がたまる状態)がおこり、重症例では心原性ショックをおこしてしまいます。
肺うっ血(「肺うっ血/肺水腫」)になった場合、利尿薬(りにょうやく)(フロセミド)やニトログリセリンなどの血管拡張薬、そしてカテコールアミン系薬(塩酸ドブタミンが第1選択)が使用されます。カテコールアミン系薬で効果が期待できない場合は、ホスホジエステラーゼ阻害薬などが使用されます。血管拡張薬を24~72時間使用した後、中止して、肺動脈楔入圧(はいどうみゃくせつにゅうあつ)が上がるようなら、硝酸薬やACEIなどを内服します。
心原性ショックという場合、梗塞をおこした心筋が原因でおこるものをさし、梗塞をおこす前からかかっている病気や発作の機械的な合併症、不整脈に由来するショックは除きます。
心原性ショックというのは、たんに血圧の低下だけではなく、末梢循環不全(まっしょうじゅんかんふぜん)、すなわち全身の細胞組織への血の循環がなんらかの原因で障害されている状態のことです。したがって、その診断には、末梢循環不全の存在を明らかにしなければなりません。
末梢循環不全は、おもに腎臓(じんぞう)、皮膚、脳血流障害の所見から判断されます。収縮期血圧が90mmHg未満で、1時間の尿量が20mℓ以下、皮膚が冷たく湿潤(しつじゅん)(じっとりしている)で、チアノーゼ(血中酸素不足で皮膚が蒼白(そうはく)になること)があれば診断がつきます。また、脳血流低下による傾眠(けいみん)傾向などの意識障害、代謝性アシドーシスの存在も末梢循環不全の存在を示しています。
このショック状態、すなわち末梢循環不全が持続すればするほど予後は悪くなります。血行が改善しても多臓器不全(複数の臓器が機能不全になる)によって死に至ります。したがって、ショックが発生したら、速やかに心肺機能を是正しなければなりません。
ショック状態の患者さんに対しては、低酸素血症が明らかな場合は、酸素吸入や人工呼吸が行なわれます。また、血行動態を改善するためにカテコールアミン(塩酸ドパミン)が使用され、血圧が上昇しない場合には、さらに塩酸ドブタミンやノルエピネフリンが使用されます。
治療を開始後、10~15分しても収縮期血圧が80mmHg以上にならない場合は、補助循環装置である大動脈内バルーンポンピング(IABP)が使用されます。
さらに、収縮期血圧が50mmHg以下、あるいは電気的除細動(でんきてきじょさいどう)が必要となる心室細動(しんしつさいどう)や心室頻拍(しんしつひんぱく)をくり返す場合(「心室頻拍」)には、IABPよりも経皮的人工心肺装置(けいひてきじんこうしんぱいそうち)(PCPS)が選択されます。
このような補助循環を用いても閉塞血管が再開通しない場合、死に至る確率は70%以上となります。したがって心原性ショックに対しては、補助循環を併用し、早期に確実に閉塞冠動脈の再開通が得られるPTCAが選択されることになります。
経皮的人工心肺装置(PCPS)というのは、従来、心臓手術のときに用いられる人工心肺を、皮下にカテーテルを挿入することで、内科的に応用するものです。これで血行動態の改善をはかりながら再灌流療法を実施することで、心原性ショックをおこしている人の救命をはかります。
以上のような補助循環・再灌流療法でも不十分な場合は、心臓のポンプ機能を一部代行する補助人工心臓(ほじょじんこうしんぞう)の適用が考えられます。
■心破裂(しんはれつ)
心破裂は、心筋梗塞症急性期の脆弱(ぜいじゃく)な心筋組織の破綻(はたん)から生じます。生じた部位により、左室自由壁破裂(さしつじゆうへきはれつ)、心室中隔穿孔(しんしつちゅうかくせんこう)、乳頭筋断裂(にゅうとうきんだんれつ)の種類があります。好発時期は、梗塞発症当日と1週目です。
左室自由壁破裂の死亡率は高く、ポンプ失調死の予防とともに急性心筋梗塞症治療の課題の1つです。心自由壁破裂例の検討から、高齢者、女性、軽症者、高血圧の人、初回梗塞者によく発症することが明らかになっています。これらは心破裂発生の危険因子とも考えられています。また、梗塞発症後の血圧変動の大きい人や心膜炎(しんまくえん)をわずらっている人も心破裂の頻度が高いことがわかっています。
自由壁破裂には、徐々に心嚢内(しんのうない)に血液が貯留し、心臓を圧迫する(心タンポナーデ)浸出型(しんしゅつがた)と、突然破裂する穿孔性破裂型(せんこうせいはれつがた)とがあります。
心筋梗塞急性期は、原則として収縮期血圧が120mmHg以下に保たれていますが、とくに前述した破裂の危険因子を複数もっている人の場合は注意を欠かすことができません。
浸出型は、ショックになる前に診断が可能です。心嚢から血液を抜いてタンポナーデ状態を解除した後に、手術を行ない救命することが可能です。
問題は、穿孔性破裂型です。これは瞬時に伝導収縮解離(でんどうしゅうしゅくかいり)(心室停止、心室細動などの重症不整脈が存在しないにもかかわらず脈拍を触知できない状態)となり、死に至ります。破裂後、できるだけ短時間でPCPSを始め、全身循環を確保したうえで、手術に移行する方法が実施されていますが、救命は困難です。
心破裂に似た合併症として、心室中隔穿孔という病態があります。これは左右の心室の間にある心室中隔に亀裂(きれつ)が入り、左心室から右心室へ血液が入り込んでしまうものです(シャント血流といいます)。聴診して、胸骨の左の第3、第4肋間(ろっかん)に全収縮期雑音が新たに聴きとれる場合は、この合併症が強く疑われます。心エコー図検査のカラードップラー法でシャント血流の存在が確認されれば診断が容易につきます。
この合併症に対しては、できるかぎり手術が行なわれます。まず緊急冠動脈造影後、(大動脈内バルーンポンピング)IABPが使用されます。そして、肺動脈の血流が体血流(たいけつりゅう)の2倍以下であれば待機となりますが、2倍以上あるか、IABP下でもシャント血流量が増える場合は緊急手術となります。とくに、ショック症状がある場合は緊急手術となります。
このほか、心筋梗塞後には重篤(じゅうとく)な僧帽弁閉鎖不全(そうぼうべんへいさふぜん)を生じることもあります。これは僧帽弁を支持している乳頭筋という組織の断裂(乳頭筋断裂)、もしくは腱索(けんさく)が断裂したためにおこります。放置しておくと、左心不全からショック状態になります。虚血にともなう乳頭筋不全による閉鎖不全では、ショックになることはまれです。心エコー検査を行なって診断します。明らかな僧帽弁閉鎖不全の場合は、手術の適用もあり、弁置換術(べんちかんじゅつ)あるいは弁形成術(べんけいせいじゅつ)が実施されます。
■CCU症候群(しょうこうぐん)
CCU症候群とは、集中治療室に入室2~3日後、せん妄(もう)状態で発症する軽度の意識障害のことで、錯覚(さっかく)や幻覚(げんかく)をともないます。
この状態になる患者さんの多くは、その前に不眠状態となっています。最近は発症数が減っていますが、これは再灌流療法を受け、またリハビリテーションが短縮されたことによると考えられています。
CCU症候群を予防するには、不眠要因を極力排除し、医師と患者さんの十分な意思の疎通、患者さんが時間の感覚を保つことがたいせつです。必要ならば、睡眠導入薬も使用されます。
■梗塞後狭心症(こうそくごきょうしんしょう)と無症候性心筋虚血(むしょうこうせいしんきんきょけつ)
梗塞後狭心症とは、心筋梗塞発症後24時間から1か月以内に出現した胸痛発作で、発作時に虚血性心電図変化があり、CPK(心筋逸脱酵素(しんきんいつだつこうそ))の再上昇がないものです。
心筋虚血がある場合は、症状の有無にかかわらず、予後が不良です。そのため、梗塞後に残る虚血は不安定狭心症(ふあんていきょうしんしょう)と同等に扱われ、冠動脈バイパス手術やPTCAの適用が考えられます。
■右室梗塞(うしつこうそく)
右室梗塞は、下壁部の梗塞に併発することが多く、その頻度は24~53%と報告されています。右室梗塞は、梗塞量が大きいと低心拍出量となり、低血圧・乏尿(ぼうにょう)・ショック状態になることもあります。また半数以上に2度以上の房室(ぼうしつ)ブロック(「房室ブロック」)をともないます。
治療としては、再灌流療法が実施されます。右冠動脈が再開通すると低心拍出量は改善され、房室ブロックも消えてしまいます。右心不全徴候が強いときには、輸液療法、カテコールアミンの使用、心房心室同期ペーシングなどが試みられます。こうすることで、心筋梗塞発症後1週間までに右心不全は改善します。
■心膜炎(しんまくえん)
体位性の胸痛(あおむけになると痛みが増し、座ると軽くなる)と、呼吸性の胸痛(息を吸ったときに痛む)があります。胸痛を鎮めるために、アスピリンが使用されます。
前壁の梗塞で梗塞サイズが大きい場合は、急性期から心嚢液(しんのうえき)がたまり、心膜炎をおこすことが少なくありません(ただし、ドレスラー症候群という心膜炎は通常、2週間以降に生じます)。
■左室血栓(さしつけっせん)とそれにともなう塞栓症(そくせんしょう)
心筋梗塞後、左室壁に血栓ができる確率は約20%です。とくに前壁では約40%、広範前壁では60%とされています。塞栓率は5%以下と低率ですが、脳梗塞(のうこうそく)を生じた場合には致命的になることもあり、対策が必要です。
抗凝血療法を十分に行なえば、壁在血栓(へきざいけっせん)(壁にできる血栓)や脳塞栓の発症率は明らかに低下します。そこで、塞栓の危険度が高い、広範な前壁梗塞症(ぜんへきこうそくしょう)ではヘパリンが使用され、心室瘤(しんしつりゅう)や壁在血栓が明らかである場合は抗凝血薬を3か月間内服します。
 救急医療について
救急医療について急性心筋梗塞による死亡の60~70%は発症から1時間以内で、その原因はほとんど心室細動(しんしつさいどう)であると推測されています。心室細動がおこった場合、2~3分以内に救急蘇生法(きゅうきゅうそせいほう)を始めないと命は助かりません。心肺停止から蘇生を始めるまでの時間が1分以内なら97%蘇生は成功しますが、5分経過すると25%に低下してしまいます。救急車を呼んでも、到着までにはふつう5分以上かかります。到着までに、そばにいる人が心肺蘇生法(しんぱいそせいほう)(CPR)を実施することがいかに大事かがわかります。
心室細動には、電気的除細動が有効ですが、救急救命士制度ができてからは、日本でも病院に到着する前に使えるようになりました。
さらに、音声案内にしたがうと一般の人でも使える自動体外式徐細動器(AED)の設置が、公共の施設や駅、空港などで進められています。また、各地の消防署などでAEDの使い方の講習も行なわれています。
今後は、第1発見者による心肺蘇生法が普及するとともに、AEDを使った徐細動の実施が浸透することが望まれます。
なお、CCUの機能を備え、専門医を乗車させた救急車(モービルCCU)を使い、病院到着を待たず、車中で治療ができる方式が、まだ少数ですが、実施され始めています。
 心筋梗塞(しんきんこうそく)の予防と対策
心筋梗塞(しんきんこうそく)の予防と対策高齢者の心筋梗塞症は、狭心症と同様、非典型的な症状で発症することがまれではありません。つまり、何の症状もなく、知らないうちに心筋梗塞症になっていることがあるわけです。ふだん経験したことがない胸部から上半身の不快感が続く場合は、それが痛いものでなくとも、放置せず、速やかにかかりつけの医師に相談してください。
そのためにも、日ごろから家庭医をつくるよう心がけておいてください。家庭医に健康状態を承知しておいてもらうほか、心電図の記録があれば発作時にも役立ちます。
とくに、心臓病と診断されている人では、急変時にどこの医療機関を受診すればよいかを、日ごろから家庭医と相談して、決めておくこともたいせつです。
心筋梗塞の治療は、安静、酸素吸入、鎮痛などの一般的な処置に加え、初期には救命が大きな目的となります。初期の死亡原因の大部分は、致命的な不整脈(心室細動)によるものです。できるだけ早く病院へ収容してもらうことがたいせつです。
改訂新版 世界大百科事典 「心筋梗塞」の意味・わかりやすい解説
心筋梗塞 (しんきんこうそく)
myocardial infarction
冠状動脈の一部の血流がとだえて,その流域の心臓の壁が壊死に陥り,心臓の機能障害を生じる疾患。生命にかかわる場合のある重い病気である。20世紀初期までは,病理解剖によって初めて診断できる疾患であったが,最近では臨床的に容易に診断できるようになった。
心筋梗塞の疫学
日本では心筋梗塞を含む心疾患による死亡は1950年以来,増加の傾向にあり,58年以来,悪性新生物や脳血管疾患に次いで3位を占めるようになり,さらに85年以降は脳血管疾患を抜いて第2位となっている。このなかで,狭心症や心筋梗塞などの虚血性心疾患の増加は著しく,50年に人口10万人に対して約10人であったものが,94年には約50人と5倍以上となり,心臓疾患による死亡全体の約3割になる。この増加は,1980年代までは生活の変化によって冠状動脈の硬化や血栓症が増加したことに帰因するが,近年はおもに高齢者における死亡数の増加による。世界的にみると,先進国での虚血性心疾患による死亡率は高く,欧米では日本の約5倍に達する。
心筋梗塞の発生を年齢や性別などでみていくと,90%は40~80歳代に発生しており,60歳代の発生が最も多い。男性は女性よりも発生率が高く,50歳代では約8倍,60歳代でも3~4倍である。職業でみると,肉体労働者よりも精神労働者に多く,肉体労働者では座業の人に多い。タバコについては,喫煙者は非喫煙者の3倍の発生頻度となっており,食事では飽和脂肪酸を多くとる人に多い。
心筋梗塞の種類
心筋梗塞は,壊死の広がり,発症時の痛みの有無などによって分類される。心筋梗塞は心臓のあらゆる部分に起こりうるが,左心室壁に起こるものが最も多く重要なので,左心室壁のどの部分が壊死に陥ったかによって,それぞれの部位別に前壁梗塞,前壁中隔梗塞,広範囲前壁梗塞,側壁梗塞,下壁梗塞,後壁梗塞などと呼ぶ。また心房に起こるものを心房梗塞,右心室に起こるものを右心室梗塞と呼ぶ。心室の同じ部分でも,壊死が壁の全層に広がったものを貫壁性梗塞,心室壁の内層と中層のみの壊死で,外層の心筋の機能は残っているものを心内膜下梗塞または非貫壁性梗塞と呼んでいる。発症時に胸痛を感じないものを無痛性梗塞というが,老人に多い。なお,発病が1ヵ月以内の病変の不安定な状態を急性心筋梗塞,それ以後の,壊死が繊維化して落ち着いた状態を陳旧性心筋梗塞という。
心筋梗塞の原因
心筋梗塞は冠状動脈が閉塞されることによって起こる。冠状動脈は動脈硬化や炎症によって生じた高度の狭窄部が血栓や塞栓によって閉塞される場合が多いが,まれには冠状動脈の攣縮(れんしゆく)による閉塞や冠状動脈内膜下に血腫が生じて閉塞されることもある。するとその下流の部分には酸素や栄養が供給されなくなり,壊死が起こることになる。したがって,冠状動脈硬化を促進する,高血圧や糖尿病などの冠動脈危険因子が基礎病変として最も重要であり,梅毒,川崎病,結節性動脈炎などの各種血管炎も原因となる。また冠状動脈閉塞の前段階として著しい狭窄が認められることが多く,狭心症が前兆となることが少なくない。血栓を生ずる直接の原因としては,播種性血管内凝固などの凝血機能の亢進,脱水,高脂血症などによる血液粘性の亢進などがあり,一方,塞栓の原因には心臓の弁膜疾患などがある。
心筋梗塞の誘因
発病の誘因は明らかでないことが多いが,各種のストレスが誘因として考えられる。精神的緊張,暴飲暴食,緊張を要する競技,温度の急な低下,極端な減食,期限の迫られた仕事,台風の前後,寒冷前線の通過などがきっかけになることが多い。
前兆
まったく前兆なしに突然発病することもあるが,半数近い例では,発病の数ヵ月ないし数週間前から前兆としての狭心症の発作が起こる。それまで健康だった人では狭心症の発作が起こり,前から狭心症のあった人では発作の回数が増加し,持続時間が長くなり,あるいはそれまでの労作性狭心症の人が睡眠中や安静時にも発作が起こるようになり,いわゆる不安定狭心症または切迫梗塞と呼ばれる状態が前兆となる。
心筋梗塞の症状
発病すると前胸部の中央に強く深い鈍痛あるいは圧迫感を感じ,数十分ないし数時間にわたって持続する。生命の危険を感ずるような不安感,恐怖感を伴い,狭心症とちがって亜硝酸薬(ニトログリセリンなど)が無効のことが多い。痛みの部位は胸の中央または少し左寄りで,心臓の前の部分が大部分であるが,左肩,左腕,みぞおち,右胸,背中,頸,あごなどにも感ずることがある。一般に痛みは深いところに広がり,痛みの場所をはっきり示せないことが多い。痛みの性質は狭心症よりも強いものが多く,鉄板を胸に押しつけられたような,焼火ばしを突っ込まれたような,胸や心臓を握りつぶされるような,あるいは息がつまるようなといった言葉で表現される。吐き気や嘔吐を伴うことが多く,顔色が悪くなり,手足が冷たくなり,冷汗が出ることが多く,息苦しさや動悸を感ずることもある。血圧が下がったり心臓の拍動が止まるために意識が混濁することもある。このような自覚症状は数時間から1日で軽快するが,重症の場合は,数時間以内に心停止を起こして死亡したり,心不全が進んで著しい呼吸困難や肺水腫,さらに心臓性ショックに陥る。一方,老人などでは痛みはほとんどなく,食思不振,息ぎれ,元気がなくなるなどの特徴のない症状で発病することもある。
他覚症状としては,胸痛を訴える時期に顔面蒼白,発汗,手足の湿疹,発熱がある。脈拍数は少なく弱いことが大部分であり,数時間たって,頻脈になったり,不規則になったりして変化しやすいのが特徴である。血圧は発症時は低くなるが,その後かえって高くなることもある。発病後の1~2週間は,心筋の壊死が生じて最も不安定な時期であり,状態が急変することが多く,専門医の治療にゆだねる必要がある。1~2週間を無事に切り抜ければ,再発が起きないかぎり,順次活動範囲を広げて1~3ヵ月で社会復帰できるようになる。
合併症
最も多いのは不整脈で,約90%の例になんらかの不整脈が起こり,あらゆる種類のものがみられる。心室性期外収縮が最も多く,前壁梗塞では心房細動,心室頻脈などの頻拍性不整脈,下壁梗塞で房室ブロックなどの徐拍性不整脈が多くみられる。また急性期死因の主要なものには心室細動および心拍停止がある。第2に心不全がある。心筋梗塞によって心室の一部の収縮力が低下すると心臓機能は低下し,心臓のポンプ作用は弱まる。心拍出量が著しく減少すると心不全となり,肺鬱血(うつけつ)が起こり,さらに進むと肺水腫の状態になる。発病後数日のうちに起こることが多く,体動や不整脈が契機となる。第3に心臓性ショックがあり,最も重篤な病態である。左心室の筋肉の40%以上が壊死に陥ると起こるとされ,血圧低下,乏尿,チアノーゼ,四肢寒冷などの症候を呈する。近年の進んだ治療法でも50%以上が死亡する。その他の合併病態として心膜炎,心破裂,静脈血栓,肺梗塞,脳塞栓,末梢塞栓,播種性血管内凝固,乳頭筋断裂または不全,心室瘤などがある。また発病後数週して,心膜炎や胸膜炎などを生ずる梗塞後症候群がある。これは壊死に陥った心筋が抗原となって起こる一種のアレルギーと考えられている。
検査と診断
心電図の変化は特徴的で,心筋梗塞の起こった部位に相当するグラフに,発病後からT波増高とST上昇があり,数日間持続する。数時間後には異常Q波が現れ,心筋梗塞の典型的所見が完成する。しかし数日から十数日でSTは徐々に基線に復し,T波が陰性化して冠性Tと呼ばれる形となる。
心筋が壊死に陥ると,血中に心筋の細胞成分である各種の酵素や収縮タンパク質の崩壊産物が遊出する。通常,クレアチンキナーゼ(CPK)とミオグロビンが最も早期に増加し,次いでトロポニン,グルタミン酸-オキサロ酢酸トランスアミナーゼ(GOT),乳酸脱水素酵素(LDH),ハイドロオキシ酪酸脱水素酵素などが増加し,2日目にピークに達し,1~2週間で復元する。ミオシンは梗塞の大きさに比例して1週以上にわたって持続的に高値を示す。ミオシンは心筋特異性のCPK,LDHなどのイソ酵素と同様に特異性が高い。また1~2週間目に,組織修復に関連した一部の酵素やタンパク質(フィブリノーゲン等)が増加する。発病のストレスに応じて,副腎皮質ホルモンやアドレナリンなども盛んに分泌される。非特異的な炎症反応として,白血球増加,赤沈促進などの所見もみられる。胸部X線写真では,心臓の拡大がみられることも少なくない。心不全に合併すると肺鬱血像が生じ,心室瘤のはり出しがみられる場合もある。
心エコー図では,梗塞部位の収縮運動の低下,心囊液の貯留がみられる。放射性同位体によるシンチグラムでは,心拍出量,駆出率などの血行動態の変化と梗塞部位の広がりがわかる。なお,特殊な検査として,心臓カテーテル法と選択的冠動脈造影がある。心臓カテーテル法による検査では,心拍出量の減少,駆出率の低下,左心室拡張終期圧・肺動脈楔入圧・肺動脈拡張期圧などの上昇,中心静脈圧の上昇がみられ,左心室造影では,梗塞部の収縮性低下や心室瘤形成,心室中隔穿孔(せんこう)の有無が明らかとなる。冠動脈造影では,責任冠状動脈の閉塞,狭窄像などがみられる。右心室梗塞では,肺動脈圧が低く,中心静脈圧が高い。心不全のある例では,常時カテーテルを留置して監視しながら治療を行う。
放射性同位元素によるシンチグラムを用いて心筋の傷害の程度,冠動脈の血流分布,残存心筋と壊死心筋,さらには心機能を分析することができる。
治療
発症直後の応急処置は安静,酸素吸入,鎮痛鎮静剤および抗不整脈剤の注射である。急性心筋梗塞が疑われれば,発病数時間以内の症例には冠状動脈の血栓融解療法,あるいは直接にバルーン付きカテーテルで拡げるPTCAが行われるようになり,効果をあげている。心筋梗塞は重篤な疾患で,急性期には病状が変化しやすいので,発病が疑われたら応急処置の後なるべく専門医による持続監視集中治療の行える特殊病棟に入院させる。この特殊病棟をCCU(coronary care unitの略)と呼ぶが,CCUでは,心電図を持続監視し,心不全やショックの予防治療のために,カテーテルを留置して静脈圧,肺動脈圧,心拍出量などを記録する。心電図による重症不整脈の発生の予測と予防および治療が予後に大きな影響を及ぼす。
基本的治療は,肉体的・精神的安静,鎮痛と狭心発作再発の予防,酸素吸入,食事の制限などで,発病後1週間程度はベッドで安静を保つ。その間,不整脈,心不全,ショック,血栓などの合併症の治療を行う。急性期を切り抜ければ,徐々に負荷を増して数ヵ月かけて社会復帰ができるようにする。回復後は,狭心症の再発,不整脈および心不全の発生が予後を悪化させるので,その監視と治療が必要である。特殊な病態には外科的に心室瘤切除,冠状動脈バイパス手術,僧帽弁置換術などが行われる。軽症例や初期治療の順調に進んだ例には,発症3週目から段階的に運動量を増すリハビリテーションを行う。慢性期になると心不全,不整脈および虚血に対する治療と高血圧・糖尿病などの合併症の治療が中心となる。
執筆者:細田 瑳一
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「心筋梗塞」の意味・わかりやすい解説
心筋梗塞
しんきんこうそく
冠状動脈による心筋への酸素(血液)の需要と供給が不均衡となり酸素不足の状態(冠不全)が持続する結果、心筋細胞に不可逆性変化(心筋壊死(えし))が生じて心筋の収縮機能が多少なりとも障害を受けた病態をいう。原因は主として冠状動脈の硬化性狭窄(きょうさく)病変を基盤とし、血栓形成や動脈のれん縮が加わって冠血流がとだえることにあると考えられる。すなわち、冠血流が停止すると、心筋細胞において細胞小器官の膨化が数十分以内に生じ、数時間の経過で心筋壊死が進展するとされている。心臓弁膜症などで心腔(しんくう)内に形成された血栓が冠状動脈閉塞を引き起こすこともある。
好発年齢は狭心症と同様に50~60歳代であり、男性が女性に比べて多い。臨床的に労作および安静時に突然生じる左前胸部の絞扼(こうやく)感(絞め付けられるような感じ)を主症状とし、冷汗、悪心、嘔吐(おうと)などの随伴症状を呈することもある。また頻発する狭心症の発作に対してニトログリセリンの投与が奏効しない場合も、心筋梗塞への移行を考慮しなくてはならない。
[井上通敏]
診断
病歴、心電図所見、白血球数、血清逸脱酵素の定量によって診断されるが、多くの場合、発症数時間後に心電図のST部分の著明な上昇を認めるので、判定は容易である。心筋の壊死によって、血清内へ流出する血清逸脱酵素の一つであるクレアチンフォスフォキナーゼ(CPK)のイソ酵素MB型の定量測定も、心筋梗塞に特異性が高く、診断に有用である。
[井上通敏]
治療
急性心筋梗塞は発症後数時間内に不整脈などで死亡する例が多いので、早期にICUやCCUに収容して集中監視および治療を行うことが肝要である。安静を保ち、酸素吸入を施行する一方、胸痛に対しては鎮痛剤を使用するが、心筋梗塞の胸痛は通常の鎮痛剤では奏効しない場合が多く、麻薬(モルヒネ)の使用を余儀なくされることもある。これらの一般的処置が行われたら、集中監視システムを設置した専門施設での治療が必要である。心筋梗塞の死亡率は20%程度であり、心不全、ショック、心破裂、不整脈に基づくことが多い。治療法の進歩に伴い、不整脈による死亡は減少傾向にあるが、心筋収縮機能の低下に起因する心不全やショックによる死亡率は依然として高率である。心筋の収縮力低下は障害心筋の範囲に依存しているため、治療に際してはこの点に留意し、心筋の保護に努力する。すでに壊死が進展した心筋細胞は再生しないので、非梗塞領域の健常残余心筋の障害進展を防止することも肝要である。なお、外科的療法としては、心不全やショックが強いときに大動脈内バルーンパンピングを行う。すなわち、大腿(だいたい)動脈から大動脈内にバルーン付きカテーテルを挿入し、胸部下行大動脈内に固定して大動脈圧を調整し、冠血流を増加させる方法である。また急性期を過ぎてからは、大動脈と冠動脈にバイパスの血管を設ける手術も行われる。
[井上通敏]
百科事典マイペディア 「心筋梗塞」の意味・わかりやすい解説
心筋梗塞【しんきんこうそく】
→関連項目A-Cバイパス術|冠不全|狭心症|虚血性心疾患|心臓病|心電図|睡眠時無呼吸症候群|大動脈瘤|動脈硬化|突然死|バルーン療法|ポジトロン断層撮影法|メタボリックシンドローム
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「心筋梗塞」の意味・わかりやすい解説
心筋梗塞
しんきんこうそく
myocardial infarction
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
生活習慣病用語辞典 「心筋梗塞」の解説
心筋梗塞
出典 あなたの健康をサポート QUPiO(クピオ)生活習慣病用語辞典について 情報
栄養・生化学辞典 「心筋梗塞」の解説
心筋梗塞
世界大百科事典(旧版)内の心筋梗塞の言及
【壊死】より
…形のうえで現れる変化のうち,可逆性のものを変性とよぶが,壊死は,不可逆性の変化に陥ったものである。壊死をおこす原因には,栄養動脈の閉塞による血行停止(たとえば,冠動脈閉塞によっておこる心筋梗塞),毒素(ヘビ毒,ガス壊疽(えそ)菌,ジフテリア菌などによる細胞融解),ウイルス感染による細胞崩壊,化学物質(青酸塩など),電離放射線(癌の放射線療法などでおこる),高温や低温(火傷,凍傷)などが挙げられる。細胞壊死のメカニズムには不明の点が多いが,膜系のATPの喪失,カルシウムイオンの細胞内流入が密に関係している。…
【狭心症】より
…冠状動脈の粥状硬化など,種々の原因で冠状動脈の血流が不足して一時的に心筋の酸素不足が生じ,その症状として数分間,胸が圧迫されるような苦しみや痛みを伴う発作をくり返す病気である。この苦しみの発作を狭心発作と呼び,これが数十分以上も続くときは,心筋の一部が壊死に陥り元どおりには回復しない心筋梗塞(こうそく)に移行することがある。1768年イギリスのヘバーデンWilliam Heberden(1710‐1801)によって狭心発作と心臓との関係につき詳細に記述されたが,そのときにはまだ狭心症と心筋梗塞との区別は明確でなく,狭心症のなかに心筋の壊死を伴う心筋梗塞を含めて考えていた。…
【心臓】より
…心筋を養う冠状動脈に硬化症やスパズム(痙攣(けいれん))が起こり,心筋の好気性代謝に必要とする酸素が十分供給されない場合は,嫌気性代謝が主となりエネルギー産出は著しく減少し,心筋障害が進行する。これは臨床的には狭心症や心筋梗塞(こうそく)の発症につながる。心筋
[冠状循環coronary circulation]
心臓を養う冠状動脈coronary arteryは大動脈基部から左右2本出て心外膜下に入る。…
【心電図】より
…STは一般にPQと同じレベルにあるもので,心室全体が等電位にあることを示す。したがってSTが上昇または下降すると,心室筋の一部に興奮性の異常(心筋梗塞(しんきんこうそく)など)のあることが推定される。T波は心室興奮の回復過程により生じ,その経過は0.16秒である。…
【心破裂】より
…したがって,正常の状態では心破裂を起こすことはない。心破裂の原因となるのは,大部分が心筋梗塞(こうそく)である。とくに心筋梗塞で血圧が高い場合や老人,特に女性の場合に生じやすく,心筋梗塞の発生後数日の間,あるいは10日前後に,再び強い狭心発作が起こったり,興奮したりすると,心筋に少しずつ亀裂が生じて,ついには全層が破れる。…
【動脈硬化】より
…それ以後も脳卒中は悪性新生物(癌)に次いで第2位を占めている。したがって日本人の動脈硬化性疾患についての疫学的研究は,脳卒中に関してのものが主役を演じざるをえなかったということができるし,このことはアメリカやヨーロッパ諸国においては狭心症や心筋梗塞(こうそく)などの虚血性心疾患についての疫学的研究が主役であるのと同じ理由をもつ。日本における近年の虚血性心疾患と脳卒中の死亡率の頻度をみると,虚血性心疾患による死亡は1950年は年間9.9人(人口10万人対。…
※「心筋梗塞」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
目次 飼養文化 北アメリカ 北方ユーラシア偶蹄目シカ科の哺乳類。北アメリカでは野生種はカリブーcaribouと呼ばれる。角が雄だけでなく雌にもふつうある。体長130~220cm,尾長7~20cm,...