精選版 日本国語大辞典 「硝酸アンモニウム」の意味・読み・例文・類語
しょうさん‐アンモニウムセウサン‥【硝酸アンモニウム】
改訂新版 世界大百科事典 「硝酸アンモニウム」の意味・わかりやすい解説
硝酸アンモニウム (しょうさんアンモニウム)
ammonium nitrate
化学式NH4NO3。工業部門では通常,硝安と呼ばれる。また窒素肥料としての正式名称は硝酸アンモニアである。
性質
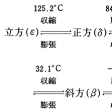
無色の結晶。固体には低温型から順に,正方(α),斜方(β),斜方(γ),正方(δ),立方晶系(ε)の5種類の変態が知られ,各変態間の転移温度は,-18℃(α→β),32.1℃(β→γ),84.2℃(γ→δ),125.2℃(δ→ε)である。温度の変化に応じて結晶系,密度,体積が種々に変化するため,大量の結晶を長期間保存する際,固化により団塊にかたまりやすい。β型は比重1.66(25℃),屈折率1.611。γ型は比重1.725(25℃)。常温でふつうに得られる結晶はγ型。きわめて吸湿性で,水100gへの溶解度は,118.3g(0℃),241.8g(30℃),580g(80℃)。メチルアルコール100gに20℃で17.1g,エチルアルコール100gに20℃で3.8g溶ける。水に溶ける際,大量の熱を吸収するので,寒剤に利用される。約210℃で分解し,一酸化二窒素N2Oと水を生ずる。
NH4NO3─→N2O+2H2O
さらに高温に熱すると急激な分解を起こして爆発する。爆発点約1300℃。
2NH4NO3─→2N2+O2+4H2O
この性質は硝安爆薬として利用されるが,空気中に常温で保存するときはわりあい安定である。実験室では,硝酸をアンモニア水で中和し,液を蒸発濃縮して結晶を析出させてつくる。
執筆者:藤本 昌利
工業的製造法
50~70%硝酸にアンモニアガスを吹き込み,中和反応によって製造する。
NH3+HNO3─→NH4NO3
硝酸の沸点は比較的低く(68%で120.5℃),また中和発熱量が大きい。沸点以上に達すると気相で霧状硝安が発生するため,反応熱を効果的に除去し液中で安定に反応させるくふうがなされる。実用化されているものに,常圧中和法と,加圧状態(4~5気圧),150℃程度で反応させる加圧中和法(ファウザー法など)がある。水分の蒸発によって効果的な冷却を行い,反応温度を調節し,一方,反応熱で生成硝安溶液を濃縮する。中和工程から得られた硝安液は,直接,あるいは蒸発濃縮後99~99.7%溶融液としたのち,造粒塔塔頂よりスプレーして落下中に冷却固化させ球状硝安(1~2mm径)にする方法,溶融液を水冷ベルト上に流し板状に固化させたものを破砕してフレーク状にする方法,かきまぜて粉状に冷却晶出させる方法,などが行われる。造粒された硝安は乾燥冷却過程で起こる,結晶相転移にもとづく粒子くずれを防ぐため,操作に注意をはらう。硝安は潮解性であるので,製品を大気中に放置するとき,固結しやすい。そこで通常は最終工程で防結剤を加える。防結剤にはケイ藻土その他がよく使われる。
窒素質肥料としてはアンモニア性窒素,硝酸性窒素各16%を保証する。吸湿性を軽減させるため,油脂,パラフィン,ロジンその他を添加被覆させる試みも古くからある。水不溶性無機質粉末を混合することも多い。石灰石粉末を混合し造粒したものがヨーロッパで製造されており,〈硝酸アンモニア石灰混合肥料〉として日本にも輸入される。
用途
化学肥料,火薬,爆薬の原料,工業薬品(一酸化二窒素など)の製造原料とされ,また寒剤,酵母培養の養分にも用いられる。化学肥料の場合,硝酸性窒素の供給源として,硝安単独あるいは硝安含有複合肥料の形で用いられる。
→硝安
執筆者:金澤 孝文
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「硝酸アンモニウム」の意味・わかりやすい解説
硝酸アンモニウム
しょうさんあんもにうむ
ammonium nitrate
硝酸のアンモニウム塩。工業部門では俗に硝安とよばれる。50~70重量%の硝酸をガス状アンモニアで中和することによって大規模に生産されている。無色の結晶で、常圧において5変態をとるが、常温では斜方晶系のβ(ベータ)形がもっとも安定である。きわめて吸湿性に富み、水によく溶け、またエタノール(エチルアルコール)にも溶ける。通常空気中では安定であるが、可燃性物質が混入したり、密閉容器中で加熱、衝撃、摩擦などを受けると爆発することがある。開放状態で加熱すると、その温度により分解反応をおこす。密閉状態で加熱すると、容易に次の爆発反応に移行する。
4NH4NO3―→2NO2+8H2O+3N2
肥料、火薬や爆薬の原料などの用途があるが、寒剤、酵母培養の養分としても用いられる。
[鳥居泰男]
硝酸アンモニウム(データノート)
しょうさんあんもにうむでーたのーと
硝酸アンモニウム
NH4NO3
式量 80.0
融点 169.6℃
沸点 ―
比重 β;1.66, γ;1.725(測定温度25℃)
結晶系 α;正方(ほかに4変態がある)
溶解度 γ;118.3g/100g(水0℃)
3.8g/100g(エタノール20℃)
百科事典マイペディア 「硝酸アンモニウム」の意味・わかりやすい解説
硝酸アンモニウム【しょうさんアンモニウム】
→関連項目含水爆薬|硝安爆薬|硝安油剤爆薬|ダイナマイト|窒素肥料
出典 株式会社平凡社百科事典マイペディアについて 情報
化学辞典 第2版 「硝酸アンモニウム」の解説
硝酸アンモニウム
ショウサンアンモニウム
ammonium nitrate
NH4NO3(80.04).硝酸をアンモニアで中和すると得られる.白色の結晶.融点169.6 ℃.密度1.73 g cm-3(25 ℃).水に易溶,メタノール,エタノールに可溶.融点以上で徐々にアンモニアと一酸化二窒素に分解する.爆発反応では,窒素,酸素,水に分解する.硝安の名前で肥料とするほか,衝撃に安定な爆薬,寒剤,麻酔用の一酸化二窒素の製造などに用いられる.[CAS 6484-52-2]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「硝酸アンモニウム」の意味・わかりやすい解説
硝酸アンモニウム
しょうさんアンモニウム
ammonium nitrate
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
世界大百科事典(旧版)内の硝酸アンモニウムの言及
【硝安】より
…石灰肥料や有機質肥料との混合はさける。硝酸アンモニウム【茅野 充男】。…
※「硝酸アンモニウム」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...